低酯果胶协同NaCl对全蛋液凝胶性质的影响
2020-03-11王轶男迟玉杰
王轶男,程 缘,迟玉杰*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
鸡蛋既含有丰富的营养物质,又具有良好的功能性质,是食品加工的重要原辅料[1-3]。2017年我国鸡蛋总产量为2 394万 t,其中仅有7%加工成蛋制品,与国外30%~40%的加工比例相比,我国蛋制品加工业有着巨大的发展空间。目前,许多蛋品加工企业生产加盐或加糖蛋液,以改善蛋液的功能性质,如凝胶性质等,但现有的蛋液产品还无法完全替代鲜蛋,蛋液产品的品质还有待进一步提高[4]。
关于NaCl对蛋液品质的影响,诸多学者进行了大量的研究。Raikos等[5]研究了添加3%~6%的NaCl对鸡蛋蛋白热凝胶流变和质构性质的影响,结果表明NaCl的添加可以提高鸡蛋蛋白的凝胶强度,并影响凝胶结构,且对全蛋凝胶的影响大于蛋清和蛋黄。Li Junhua等[6]结合低场核磁共振(low field-nuclear magnetic resonance,LF-NMR)技术探究蛋清液和蛋黄液质构性质和水分迁移率随NaCl(0%、0.6%、1.8%和3.0%)的变化,实验证明NaCl可以提高蛋黄和蛋清的凝胶强度,促进自由水迁移成不易流动水。Li Junhua等[7]报道了NaCl(0.6%、1.8%、2.4%和3.0%)对全蛋液凝胶性质和分子间作用力的影响,发现NaCl添加量与全蛋的凝胶性质密切相关,通过增加全蛋蛋白疏水相互作用和二硫键改善全蛋凝胶结构和持水性。根据上述研究,NaCl能提高蛋液的凝胶性质和持水性,但往往添加量较大,远高于味觉可感知的限量,所以加盐的蛋液产品自带咸度,仅能用于部分咸味产品的加工,限制了蛋液产品的应用范围。为改善上述现状,寻求其他能够改善蛋液品质的物质迫在眉睫。
果胶是一种由半乳糖醛酸单元构成的复杂天然高分子化合物[8],其中低酯果胶(low ester pectin,LEP)具有良好的凝胶化和乳化稳定作用,因对水分有很强的吸附能力而作为品质改良剂广泛应用于面包、果冻、沙拉酱、酸奶等食品加工中[9-11]。有关于低酯果胶对肌纤维蛋白、乳清蛋白以及大豆蛋白等蛋白凝胶品质影响的诸多研究。例如,Donato等[12]报道Na+对β-乳球蛋白/牛血清白蛋白-LEP复合物热诱导凝胶性质的影响,结果表明Na+的加入改变了蛋白质间的静电斥力,促进LEP相分离过程,提高β-乳球蛋白/牛血清白蛋白-LEP复合物凝胶强度及力学性能。Setiowati等[13]通过干热处理LEP和乳清分离蛋白(whey protein isolate,WPI),形成的WPI-LEP偶联物乳状液能显著提高WPI乳状液的pH值敏感性和热敏性。Dekkers等[14]报道了大豆分离蛋白(soy protein isolate,SPI)与果胶共混物黏弹性的变化及成因分析,结果表明LEP释放的半乳糖醛酸能有效稳定体系中的分散相,防止相分离,并重新分配了体系中的水分,从而提高了凝胶的黏弹性。上述研究表明LEP能显著改善样品凝胶性质和持水性,但鲜有关于LEP对于鸡蛋中蛋白质凝胶性质的研究。
本研究添加LEP与NaCl协同使用,通过比较NaCl和LEP添加量对全蛋液混合体系凝胶性质及微观结构影响,以期降低NaCl用量,并获得更理想的凝胶性质和质地,为拓展全蛋液在食品加工领域的应用与新型鸡蛋制品开发提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜鸡蛋 市售;低酯果胶CP Kelco LM-101 AS(食品级,酯化度<50%);其他试剂均为分析纯。
1.2 仪器与设备
TA-XT plus质构分析仪 英国Stable Micro System公司;DISCOVERY HR-1流变仪 美国TA Instruments公司;Mq-20 LF-NMR分析仪 德国布鲁克公司;Mastersizer 2000激光粒度仪、Nano-ZS90 Zeta电位及纳米粒度分析仪 英国马尔文仪器有限公司;FE-SEM扫描电子显微镜 德国Carl Zeiss Microscopy GmbH公司;TU-1810紫外-可见分光光度仪 北京普析通用仪器有限责任公司;JJ-1精密增力电动搅拌机 上海浦东物理光学仪器厂。
1.3 方法
1.3.1 样品制备
新鲜鸡蛋经打蛋等工序得到新鲜全蛋液(稀释至蛋白质量分数为7%~8%)。向全蛋液中加入NaCl(添加量0.10%和0.15%)和LEP(添加量0.10%、0.20%和0.30%),经巴氏杀菌后,置于4 ℃贮藏待用。以不同NaCl和LEP添加量的全蛋液为实验组,以新鲜全蛋液为对照组。
1.3.2 Zeta电位测定
参照Church等[15]的方法,并加以修改。将全蛋液样品用去离子水稀释500 倍后,取3 mL注入Zeta电位仪,进行电位测试。测试参数为:激光散射角90°,蛋白折射率1.460,分散剂折射率1.330。每次测定最终电位均为连续3 次实验的平均值。
1.3.3 粒径测定
参考Schwenke等[16]的方法,并加以修改。取1 mL全蛋液样品注入装有500 mL去离子水的烧杯中,使用激光粒度仪测定平均粒径和粒径分布,测试参数为蛋白折射率1.460、分散剂折射率1.330。
1.3.4 可溶性蛋白含量测定
参照GB 5009.5ü2016《食品中蛋白质的测定》测定全蛋液样品总蛋白含量[17]。称取液态试样15 g,精确到0.001 g,按照凯氏定氮仪说明书的要求进行检测。
取1 mL全蛋液样品,并用蒸馏水稀释20 倍,将稀释后的全蛋液样品在5 000 r/min离心15 min,采用Lowry法[18]测定上清液中蛋白质含量,取1 mL上清液于洁净干燥的比色皿中作为待测样品,加碱性铜溶液5 mL,室温静置10 min,加入酚试剂0.5 mL,室温放置30 min,利用紫外分光光度计在650 nm波长处测定吸光度。以牛血清蛋白为标准蛋白作标准曲线测定上清液中蛋白质含量。按式(1)计算可溶性蛋白含量:
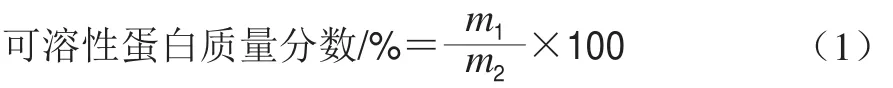
式中:m1为上清液蛋白质量/g;m2为总蛋白质量/g。
1.3.5 流变学性质测定
参考Egelandsdal等[19]的方法,并加以修改。流变学性质测定采用温度扫描模式。将全蛋液样品添加到流变仪平板上,平板直径为40 mm,选用探头直径为20 mm,板间距为0.5 mm。为防止水分的蒸发,采用石蜡油对两平行板间的缝隙进行密封。测定参数为:初始温度25 ℃,升温速率5 ℃/min,直到温度上升至90 ℃,降温速率5 ℃/min,直到降到初始温度,角频率为1 Hz,固定形变为1.00%。记录下储能模量G’和损耗模量G’数值的变化。

式中:K’为幂律模型常数;ω为角频率;n为频率指数。
1.3.6 凝胶性的测定
凝胶的制备及测定参考Mohammadi等[20]方法,并加以修改。取20 mL样品置于25 mL小烧杯中,用保鲜膜封口,在90 ℃水浴锅中加热15 min,取出后快速冷却,在4 ℃静置24 h待测。
凝胶性的测定:将全蛋凝胶切割成20 mmh 20 mmh10 mm大小的立方体,利用质构仪在25 ℃条件下对样品进行全质构分析程序测定。测定参数为探头p36R,距离样品上表面的高度5 mm,压缩程度50%,触发值5.0 g;测试前速率2 mm/s,测试速率1 mm/s,测试后速率2 mm/s;选取硬度、弹性和咀嚼性作为分析指标。
1.3.7 持水力的测定
参考Kocher等[21]的方法。称取一定量的凝胶,切割成大小均一的块状(5 mmh5 mmh5 mm),5 000 r/min离心15 min,取出离心管内的凝胶,用滤纸吸干凝胶表面水分后称量凝胶质量。按式(3)计算持水力:

式中:m1为离心前样品的质量/g;m2为离心后样品的质量/g。
1.3.8 水分分布的测定
参考Aursand等[22]的方法,并加以修改。将全蛋凝胶切割成大小均一的块状,放置于高度为18 cm、直径为1.8 cm的专用测定试管中,LF-NMR分析仪的磁场强度为0.47 T,质子共振频率为20 MHz。采用Carr-Purcell-Meiboom-Gill程序测定全蛋凝胶样品的横向弛豫时间T2,每个样品测定时自动扫描8 次,每次扫描重复的间隔时间为2 s。测定后,通过CONTIN软件分析每个样品的T2,计算弛豫时间。
1.3.9 微观结构测定
参考Woodward等[23]的方法。从全蛋凝胶样品上切下约4 mmh4 mmh2 mm的样品,浸泡于体积分数2.5%戊二醛-磷酸盐缓冲溶液(磷酸盐缓冲溶液浓度为0.1 mol/L,pH 7.2)中,放置于4 ℃冰箱中固定过夜。将一次固定样品加入2%四氧化锇二次固定,并在4 ℃冰箱中固定1.5 h。而后,将固定后的样品用pH 7.2的磷酸盐缓冲溶液(0.1 mol/L)冲洗3 次,每次浸泡10 min。而后分别用体积分数50%、70%、90%乙醇溶液进行脱水,每次10 min;再用100%乙醇脱水2 次,每次15 min。依次用V(乙醇)∶V(叔丁醇)=1∶1和100%叔丁醇各置换1 次,每次15 min。随后对样品进行冷冻干燥。挑选截面平整的样品黏贴在扫描电子显微镜专用台面上,对样品表面进行喷金处理,用扫描电子显微镜观察拍照,放大倍数为2 000 倍。
1.4 数据统计及分析
2 结果与分析
2.1 NaCl和LEP对全蛋液Zeta电位的影响
NaCl在水溶液中可解离出大量的正负离子,LEP为阴离子多糖。因此,添加NaCl和LEP对全蛋液电荷含量具有较大影响,而电荷平衡是维持体系稳定性的重要因素[24-25]。NaCl和LEP对全蛋液Zeta电位的影响见图1。
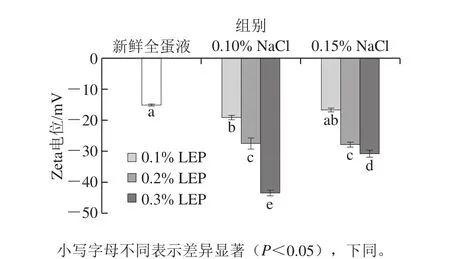
图1 NaCl和LEP对全蛋液Zeta电位的影响Fig. 1 Effect of combined addition of NaCl and LEP on zeta potential of liquid whole egg
由图1可知,添加NaCl和LEP的全蛋液Zeta电位绝对值均高于新鲜全蛋液。相同NaCl添加量的全蛋液Zeta电位绝对值随着LEP添加量的增加呈现上升趋势。而对于相同LEP添加量,NaCl添加量的增加导致全蛋液Zeta电位值绝对值降低(添加0.20% LEP时不变)。从图1可以看出,新鲜全蛋液带负电荷。LEP表面同样带有负电荷,所以随着LEP添加量的增加全蛋液中Zeta电位绝对值升高。因鸡蛋蛋白质与LEP带相同的电荷,且在溶液中浓度较低,所以鸡蛋蛋白质与LEP通过静电作用“共溶”,没有出现肉眼可见的相分离现象,但鸡蛋蛋白质和LEP均为高分子化合物,根据热力学第2定律和排空相互作用理论,蛋白质和多糖在水溶液中会产生液-液分离的现象[26]。而蛋白质和多糖的比例和离子强度等因素对该现象有极大影响。所以,NaCl添加量的增加会带来更多的正电荷,破坏了“蛋白-多糖”体系的电荷平衡,导致全蛋液中Zeta电位绝对值降低。但是,添加0.20% LEP时,NaCl添加量增加,全蛋液的Zeta电位变化不显著(P<0.05),说明此时“蛋白-多糖”体系比较稳定。此时Zeta电位在-25~-30 mV之间,根据DLVO理论,当Zeta电位≥25 mV时,液滴之间就能够产生良好的静电排斥效果,本研究结果与此相符[27]。所以,NaCl和LEP协同使用,可以在二者浓度均较低的情况下使得全蛋液体系稳定平衡,有助于凝胶三维网络结构的形成。
2.2 NaCl和LEP对全蛋液粒径分布及平均粒径的影响
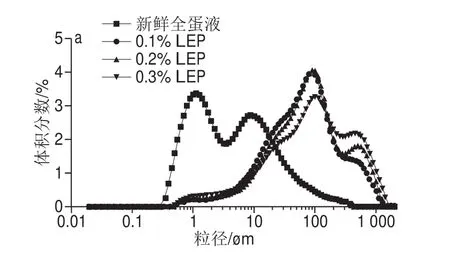
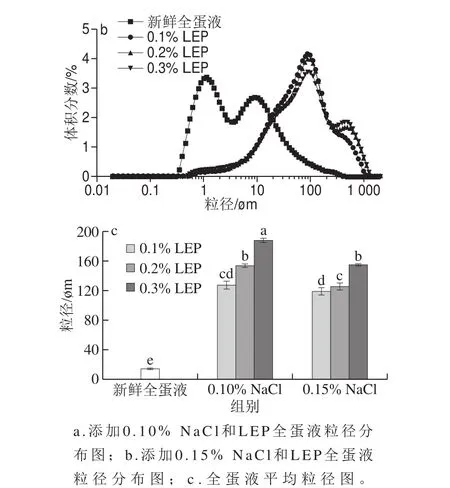
图2 NaCl和LEP对全蛋液粒径分布和平均粒径的影响Fig. 2 Effect of combined addition of NaCl and LEP on particle size distribution and average diameter of liquid whole egg
由图2可知,新鲜全蛋液粒径分布在0.3~400 μm范围内,在1 μm和10 μm附近有两个主要分布峰;而添加NaCl和LEP的全蛋液粒径分布在0.44~1 588 μm范围内,在100 μm附近有一个主分布峰。NaCl和LEP的添加显著提高了全蛋液的平均粒径(P<0.05),相同NaCl添加量全蛋液的平均粒径随着LEP添加量增加,提高显著(P<0.05),相同LEP添加量的全蛋液平均粒径与NaCl添加量呈反比。LEP的平均粒径为18 μm左右[28],所以LEP添加导致全蛋液粒径分布整体右移,平均粒径显著增加,并不是简单的共混,而是鸡蛋蛋白聚集所引起的。由于鸡蛋蛋白和LEP带同种电荷,并且根据排空相互作用理论,鸡蛋蛋白质附近LEP的构象熵减少,所以LEP被排除出鸡蛋蛋白附近,导致鸡蛋蛋白周围存在排空层(与LEP分子的均方根旋转半径相关)。当鸡蛋蛋白相互靠近时,彼此的排空层开始重叠,LEP被排除出重叠区域,溶液中和重叠区域间LEP的浓度差产生渗透压,渗透压的存在导致了鸡蛋蛋白相互吸引[29],聚集行为的发生,生成体积较大的聚集体。并且随着LEP添加量的增加,体系的熵增加,使得自由能降低,有效促进了鸡蛋蛋白间的进一步互相吸引,导致了微相分离。NaCl的添加同样会产生渗透压效应,导致鸡蛋蛋白聚集程度增加。另外,NaCl可能会在与LEP作用之前,先诱导蛋白质发生聚集。有研究表明,聚集蛋白之间的排空作用更强,增强相分离的发生。而NaCl添加量的进一步增加,会抑制鸡蛋蛋白与LEP的相互作用,导致蛋白聚集程度的减弱。Weinbreck等[30]研究发现当溶液中NaCl浓度达到70 mmol/L时,可抑制乳清分离蛋白与阿拉伯胶复合物的形成,与本实验结果相似。
2.3 NaCl和LEP对全蛋液可溶性蛋白含量的影响
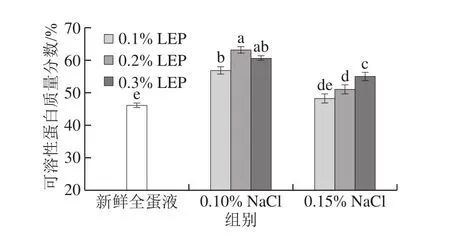
图3 NaCl和LEP对全蛋液可溶性蛋白含量的影响Fig. 3 Effect of combined addition of NaCl and LEP on soluble protein content of liquid whole egg
由图3可知,添加NaCl和LEP的全蛋液中可溶性蛋白含量均高于新鲜全蛋液。当NaCl添加量为0.10%时,全蛋液中可溶性蛋白含量随LEP添加量的增加先上升后下降。当NaCl添加量为0.15%时,全蛋液中可溶性蛋白含量随LEP添加量的增加呈现上升趋势。而相同LEP添加量的全蛋液中可溶性蛋白含量与NaCl添加量呈反比。且当NaCl添加量为0.10%、LEP添加量为0.20%时,全蛋液中可溶性蛋白含量达到最高,提高了36.95%。蛋白质在水溶液中的溶解主要取决于蛋白质分子表面离子周围的水分子数目,即蛋白质分子的亲水性以及蛋白质分子所带电荷情况[7]。由粒径的测定结果可知,添加NaCl和LEP导致鸡蛋蛋白发生聚集。而添加NaCl和LEP的全蛋液中可溶性蛋白含量增加说明生成的聚集体为可溶性聚集体。多糖LEP增加了全蛋液环境中的亲水基团,并且根据排空相互作用理论,促进了鸡蛋蛋白聚集体表面水化层的增加,可溶性蛋白含量随之增加[25]。而加入少量稀浓度的NaCl会提高全蛋液中鸡蛋蛋白质与水相互作用,促进盐溶现象的发生,有利于蛋白溶解。
2.4 NaCl和LEP对全蛋液流变学性能的影响
动态流变学反映流体在周期运动条件下,其流动性能和形变能力。G’代表凝胶弹性形变过程中存储的变形能量,可以反映样品的弹性程度。G"是指在发生形变时,由于黏性形变(不可逆)而损耗的能量大小,可以反映样品的黏性程度[31]。图4为新鲜全蛋液和添加NaCl和LEP全蛋液的G’的温度扫描图。
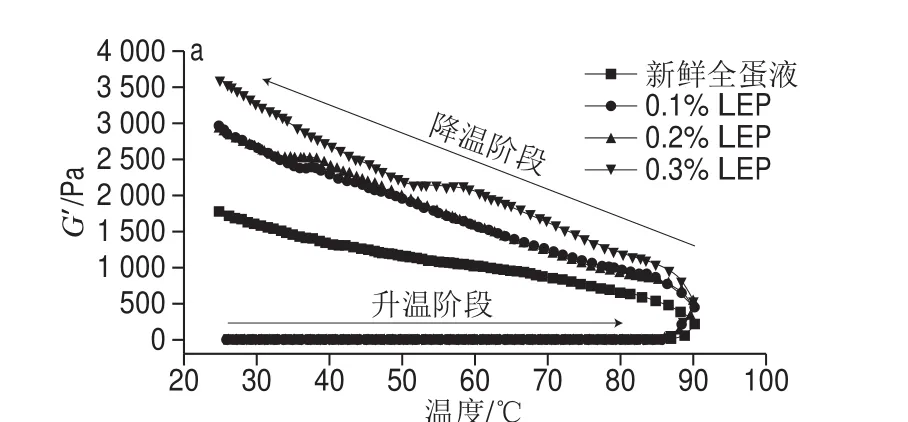
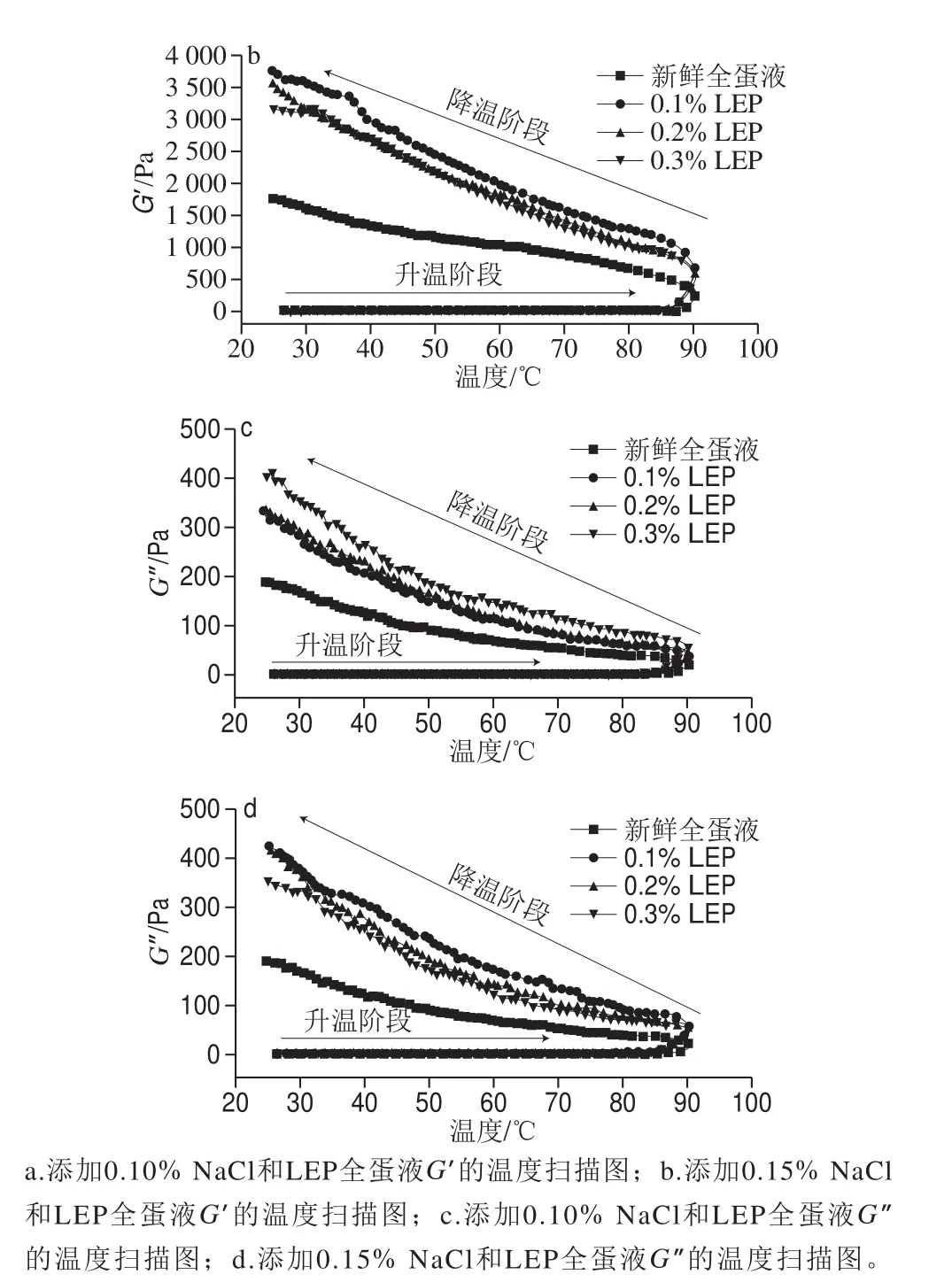
图4 NaCl和LEP对全蛋液动态流变性质的影响Fig. 4 Effect of combined addition of NaCl and LEP on dynamic rheological properties of liquid whole egg
流变测试升温至90 ℃,该温度为制备鸡蛋凝胶的常用温度。并且,所有样品在降温阶段的G’和G"变化趋势均相同,G’均高于G",即样品中弹性成分更突出,表现为典型的凝胶和类固体特征。在升温阶段,各样品的G’几乎未发生变化,因此并未形成凝胶。但是加热导致鸡蛋蛋白质分子发生解折叠,部分变性,鸡蛋蛋白质疏水基团暴露,LEP与其发生相互作用,形成缔合区[12]。而在降温过程中,所有样品的G’持续升高,但添加0.10% NaCl的样品(图4a)G’变化的连续性更强,并分别在55~60 ℃和35~40 ℃有一个“平台期”,生成的凝胶网络结构更加致密,保水性更强,与后续的实验结果一致。在添加0.10%的NaCl时,全蛋凝胶的G’和G"随着LEP添加量的增加而升高,均高于新鲜全蛋液;在添加0.15% NaCl时,全蛋凝胶的G’和G"随着LEP添加量的增加而降低,亦均高于新鲜全蛋液。NaCl添加量为0.10%、LEP添加量为0.20%的全蛋液G’和G"的差值最大,说明其凝胶强度最高[31],与质构的结果一致。当NaCl添加量为0.10%,NaCl分子改变了全蛋液的离子强度,促进了鸡蛋蛋白疏水基团的暴露,增进了鸡蛋蛋白与LEP的交互作用,形成强度较高的凝胶[32]。但是进一步增加NaCl的添加量,由于NaCl对水分子的竞争作用,影响了鸡蛋蛋白与LEP分子交互作用,导致最终凝胶强度降低。
2.5 NaCl和LEP对全蛋凝胶性质的影响
全蛋凝胶的弹性、硬度和咀嚼性数值越大,全蛋凝胶越富有弹性,口感越为弹嫩、饱满[33]。NaCl和LEP对全蛋凝胶弹性、硬度和咀嚼性的影响见表1。
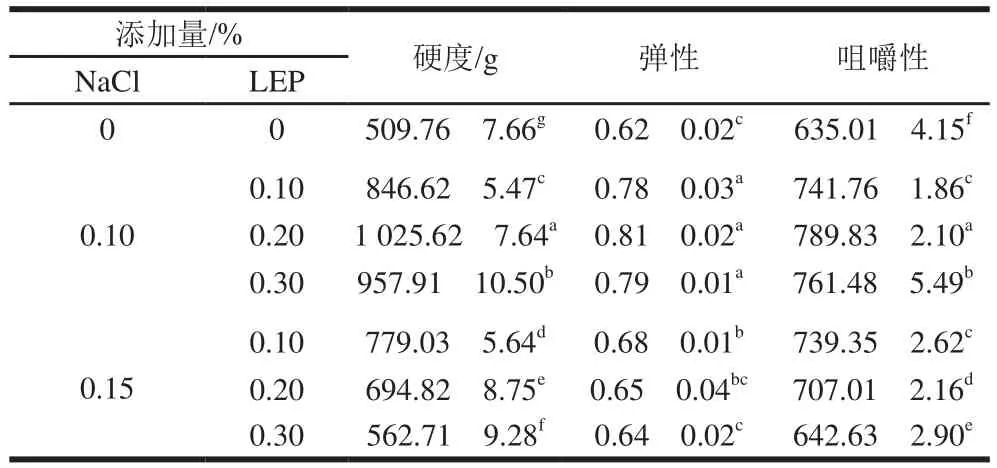
表1 NaCl和LEP对全蛋凝胶质构特性的影响Table 1 Effect of combined addition of NaCl and LEP on texture characteristics of liquid whole egg gel
添加NaCl和LEP后,样品全蛋凝胶弹性、硬度和咀嚼性均显著提高(P<0.05)。同时,实验结果表明,NaCl添加量相同时,随着LEP添加量的提高,样品凝胶弹性、硬度和咀嚼性呈上升趋势,提高显著(P<0.05),而相同LEP添加量的样品,NaCl添加量为0.15%时,样品凝胶弹性、硬度和咀嚼性与NaCl添加量为0.10%时相比均下降显著(P<0.05)。且当NaCl添加量0.10%、LEP添加量0.20%时,全蛋凝胶的硬度、弹性达到最高,分别提高了1.01 倍和30.64%。研究普遍认为,蛋白热凝胶的形成可分为两个阶段:1)蛋白质多肽链的展开;2)蛋白质之间以及蛋白质与水相互作用结合形成三维网状结构。有研究表明,如若蛋白质的凝集速率慢于变性速率,蛋白质分子就有足够时间进行有序的结合形成凝胶[34]。研究发现,NaCl和LEP会导致鸡蛋蛋白发生可溶性聚集,而蛋白质聚集在一定程度上减缓了多肽链展开变性的速率,有力于强化凝胶三维网络结构。另外,LEP会与蛋白质之间形成络合物,使得凝胶三维空间结构更加牢固,形成一个稳定的凝胶体系。全蛋凝胶性质与其三维网络结构的致密程度密切相关,LEP自由羧基形成的缔合区能够有效限制水分子迁移,使得蛋白质分子之间相互作用增强,形成交叉连接的作用,促进分子有序排列,导致凝胶弹性、硬度和咀嚼性增大,感官品质提高[35]。低NaCl浓度有助于LEP与鸡蛋中的蛋白质的络合作用,这与毋引子等[36]关于NaCl对全蛋液功能性质的影响研究结果一致,随着离子浓度增大,导致渗透压升高,影响结合水的含量,使得全蛋凝胶品质下降[7]。
2.6 NaCl和LEP对全蛋凝胶持水力的影响
持水力指食品保持水分或其他食品汁液的能力[37]。全蛋凝胶持水能力主要取决于参与形成凝胶的分子数量以及凝胶的结构,当参与形成凝胶的蛋白质和LEP分子越少时,凝胶的孔径越大且孔隙大小不均,其结构则更为粗糙,这种凝胶的持水能力也就相对较差[33]。NaCl和LEP对全蛋凝胶持水力的影响见图5。
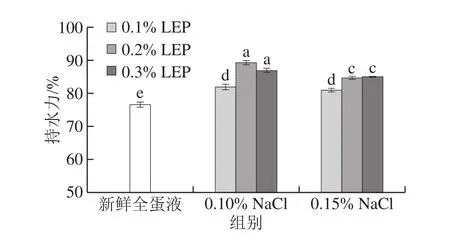
图5 NaCl和LEP对全蛋凝胶持水力的影响Fig. 5 Effect of combined addition of NaCl and LEP on water-binding capacity of liquid whole egg gel
由图5可知,添加NaCl和LEP的全蛋凝胶的持水性高于新鲜全蛋液。在添加0.10%和0.15%的NaCl时,全蛋凝胶持水性随LEP添加量的增加均先升高后不变。而相同LEP添加量的样品,添加0.10% NaCl的全蛋凝胶持水性高于添加0.15% NaCl。其中NaCl和LEP添加量分别为0.10%、0.20%时,样品凝胶的持水性最高,提高了16.48%。在热凝胶形成过程中,LEP与鸡蛋蛋白形成络合区,对水分束缚能力增强,持水力提高。在“蛋白-多糖”复合体系中,由于鸡蛋蛋白的浓度远高于LEP的浓度,所以鸡蛋蛋白应该处于“连续相”,而LEP处于“分散相”。随着LEP添加量进一步增加,微相分离现象加剧[38-39]。形成热凝胶时鸡蛋中的蛋白质聚集相尺寸增大,LEP大量嵌入全蛋凝胶网络中,导致聚集相体积膨胀变大,使凝胶孔径增大,结构致密程度变差,最终使全蛋凝胶持水能力降低。而离子浓度增加,促使LEP与鸡蛋蛋白分子发生相分离,渗透压增加导致相分离现象加剧,从而导致分子间间隙变小,使得鸡蛋中的蛋白质分子锁水能力下降。
2.7 NaCl和LEP对全蛋凝胶水分分布的影响
为进一步探究NaCl和LEP对全蛋凝胶保水性的改善作用,采用LF-NMR技术分析NaCl和LEP对全蛋凝胶水分分布的影响。全蛋凝胶弛豫时间T2分布图如图6所示,横向弛豫时间及弛豫峰面积百分数如表2所示。
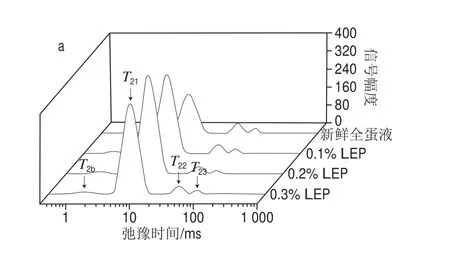
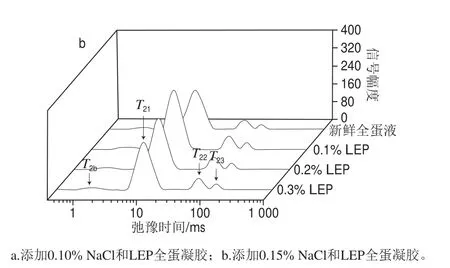
图6 NaCl和LEP对全蛋凝胶T2横向弛豫时间分布的影响Fig. 6 Effect of combined addition of NaCl and LEP on relaxation time T2 distribution of liquid whole egg gel
由图6所示,全蛋凝胶弛豫时间T2分布图有4 个峰,T2b(1~10 ms)代表体系内部紧密结合的结合水,这部分的水与体系内蛋白质分子通过化学键相互结合;T21和T22(10~100 ms)代表不易流动水,这些水在形成凝胶时束缚于凝胶的三维空间网络结构中;T23(100~1 000 ms)代表自由水,是指以游离状态存在于体系内部,在形成凝胶时被凝胶网络结构所屏蔽而可以自由流动的水。有研究表明,弛豫峰面积百分数A2可以体现各个状态水分分布变化情况[40-42],所以A2b反映结合水弛豫峰面积,A21和A22反映不易流动水弛豫峰面积,A23反映自由水弛豫峰面积。
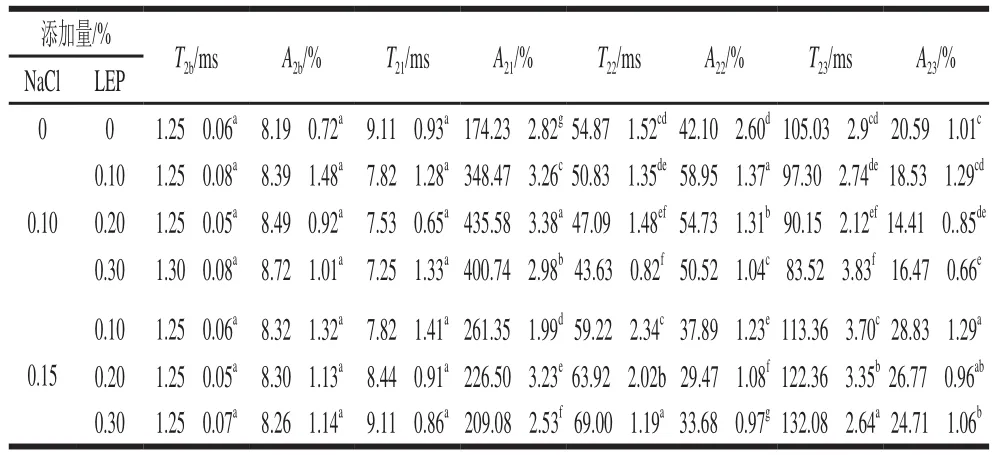
表2 NaCl和LEP对全蛋凝胶T2横向弛豫时间及弛豫峰面积百分数的影响Table 2 Effect of combined addition of NaCl and LEP on transverse relaxation time T2 and peak area fraction of liquid whole egg gel
由表2可知,新鲜全蛋液和添加NaCl、LEP全蛋液凝胶的A2b均无显著差异(P>0.05),可见添加NaCl和LEP后,全蛋液凝胶的结合水未发生转变,NaCl和LEP未导致鸡蛋中蛋白质与水分子之间化学键的断裂。与新鲜全蛋液相比,添加NaCl、LEP的A21、添加0.10%NaCl的A22和添加0.15% NaCl的A23的全蛋液均显著提高(P<0.05),而添加0.15% NaCl的A22和添加0.10% NaCl的A23的全蛋液均显著降低(P<0.05)。因为T21为主峰,在不易流动水中所占比例较大,所以从整体的趋势来看,添加NaCl和LEP后,全蛋液凝胶的不易流动水增加,为自由水迁移而来。当LEP的添加量相同时,添加0.10% NaCl的A21、A22均显著高于添加0.15% NaCl的全蛋凝胶(P<0.05),而A23显著低于添加0.15% NaCl的全蛋凝胶(P<0.05)。当NaCl的添加量相同时,随着LEP的添加量增加,A22显著降低(P<0.05),A23组间差异不显著(P>0.05)。与新鲜全蛋液相比,其中NaCl添加量为0.10%、LEP为0.20%时,样品凝胶的A21由174.23%提高至435.58%,而A23由20.59%降低至14.41%(P<0.05)。
LEP的添加导致自由水迁移为不易流动水可能是由于LEP分子与鸡蛋蛋白间形成的镶嵌结构,将更多的自由水锁在了络合区域内,部分自由水“态变”为不易流动水,从而起到了保水作用,这与凝胶持水力实验结果一致。Khemakhem等[37]探究了NaCl和食用胶对蛋清凝胶持水性和水分状态的影响,发现加入NaCl凝胶的持水性降低,但是同时加入蔗糖会有所改善。本实验中在相同LEP添加量的情况下,增加NaCl添加量,全蛋凝胶中不易流动水含量有所下降。Li Junhua等[6]研究添加NaCl的鸡蛋蛋黄发现其结合水含量随NaCl浓度的提高而减少,与本实验结果相反。这主要是因为蛋黄中添加NaCl破坏了蛋黄中不溶性成分中卵黄高磷蛋白和高密度脂蛋白间的“磷桥”,使得不溶性“颗粒”随着NaCl浓度增加逐渐溶解,破坏了蛋白质与水分子之间的化学键,导致结合水含量降低。而本研究的研究对象为全蛋液,其中自有水含量远高于蛋黄液,并且蛋清蛋白为蛋白质的主要成分,所以高浓度NaCl导致的上述现象被减弱。而且,本研究中LEP与全蛋液中蛋白质形成络合物,蛋液中蛋白质的“存在”状态发生改变,与鲜蛋液存在较大差异,从而改变了全蛋凝胶水分分布状态。
2.8 NaCl和LEP对全蛋凝胶微观结构的影响
由图7a所示,新鲜全蛋凝胶表面有大量的大小不均一的孔洞存在,呈现类似于“蜂窝”状的结构,这表明新鲜全蛋凝胶三维网络结构疏松,这也是全蛋凝胶持水性较差的原因。当NaCl为0.10%、LEP为0.10%时(图7b),样品凝胶表面含有丰富的纤细孔隙,这是样品凝胶持水性提高的表现。NaCl为0.10%、LEP为0.20%的全蛋凝胶(图7c)孔隙增加更为明显,这些孔径大小一致,凝胶结构疏松,所以此时凝胶持水性明显提高。而NaCl为0.15%、LEP为0.10%的全蛋凝胶(图7e)网络结构更为致密,孔洞数量明显减少,而随着LEP添加量的提高(图7f、g),孔径也明显缩小,持水区域减少导致凝胶持水能力下降,这符合LF-NMR测试所得到的不易流动水含量减少的实验结果,微观结构改变使得全蛋凝胶硬度、弹性和咀嚼性下降。Hermansson等[43]报道了离子强度与凝胶的微观结构存在相关性,低离子环境下凝胶呈现精细的微观结构,而高离子环境下凝胶呈现粗糙的结构。其结果与本研究相悖的原因可能是LEP的添加改变鸡蛋中蛋白质间的结构,进而降低了离子环境对凝胶微观结构的影响。

图7 NaCl和LEP对全蛋凝胶微观结构的影响(×2 000)Fig. 7 Effect of combined addition of NaCl and LEP on microstructure of liquid whole egg gel (× 2 000)
3 结 论
本实验研究了NaCl和LEP对全蛋液凝胶性质的影响。结果表明,NaCl和LEP复合使用能够提高全蛋液凝胶性质,促进全蛋液中自由水迁移为不易流动水,提高凝胶持水力。NaCl和LEP的添加增加了体系中的负电荷,促进了蛋白的可溶性聚集,全蛋液Zeta电位绝对值、平均粒径和可溶性蛋白含量显著升高(P<0.05)。综合各个指标可知,NaCl添加量0.10%、LEP添加量0.20%时,全蛋凝胶性质和持水性最佳。因此,LEP和NaCl协同使用可有效改善全蛋液凝胶性和持水性,且能够降低NaCl的添加量,拓宽了全蛋液的应用范围,为改善蛋液品质,促进蛋制品加工提供一定的理论依据。
