通过血清胱抑素C建立慢性肾脏病患者肾小球滤过率预测模型的临床研究
2020-03-11徐川岚陈梦莹沈宏春西南医科大学中西医结合学院四川泸州646000西南医科大学附属中医医院四川泸州646000
徐川岚,陶 杰,陈梦莹,沈宏春 (1.西南医科大学中西医结合学院,四川 泸州 646000;2.西南医科大学附属中医医院,四川 泸州 646000)
半胱氨酸蛋白酶抑制剂C(serum cystatin C,s-cystatin C),以前被称为γ-后球蛋白或者γ-微球蛋白,在临床上多称为胱抑素C,其编码基因位于人22号染色体短臂1区1带,是一种碱性非糖化的分泌性小分子蛋白质,由120个氨基酸残基组成。人体所有有核细胞均可产生胱抑素C,且产生率恒定,在各种体液中均存在胱抑素C。在循环系统中的胱抑素C基本不受其他因素影响,可经肾小球自由滤过,仅在近曲小管被重吸收并降解,肾脏是循环系统唯一可以清除胱抑素C的器官。因此,血清胱抑素C的浓度主要由肾小球滤过率决定,可作为反映肾小球滤过率变化的理想内源性标记物,胱抑素C也成为肾脏疾病领域预测肾小球滤过率的研究热点。目前也有部分研究者建立了s-cystatin C与肾小球滤过率(glomerular filtration rate,GFR)之间的关系模拟模型,但由于研究对象临床资料及指标检测方法的不同,各预测模型的适用性可能存在一定差异。本研究以我院慢性肾脏病(chronic kidney disease,CKD)患者为研究对象,以乳胶免疫比浊法检测血清s-cystatin C浓度,酶法测定同步血肌酐浓度,中国人简化的肾脏病饮食改良研究公式(the Modification of Diet in Renal Disease equation,MDRD)计算出eGFR(ml/min·1.73 m2)=1.233×186×血肌酐-1.154×年龄-0.203×[女性×0.742]计算出eGFR,建立了适宜于CKD患者的GFR预测模型,并进行验证,现报告如下。
1 临床资料
1.1一般资料:纳入患者情况:选取2019年3月~2019年10月在我院肾病科的84例CKD患者。男51例,女33例,平均年龄为(62.55±16.29)岁,慢性肾脏病的原发病分布情况:原发性肾小球疾病40例,糖尿病肾病24例,系统性红斑狼疮相关性肾病4例,高血压肾病4例,梗阻性肾病3例,安卡相关性肾病3例,IgA肾病患者2例,其他患者4例。
1.2诊断标准:依据肾脏病预后质量倡议(KDOQI) 工作组制定及修改后的CKD定义和分期为准[1]。慢性肾脏病的定义及诊断:慢性肾脏病定义为肾脏结构或功能异常>3个月。①即符合下列中任何一项指标异常,且持续时间超过3个月即可诊断。肾损伤标志:尿白蛋白肌酐比值≥30 mg/g(或≥3 mg/mmol) ]尿沉渣异常;肾小管相关病变;组织学异常;影像学所见结构异常;肾移植病史。②肾小球滤过率下降:eGFR<60 ml/(min·1.73 m2)。
慢性肾脏病根据肾小球滤过率(GFR)分为五期,G1期:正常或增高eGFR≥90 ml/(min·1.73 m2);G2期:轻度下降eGFR 60~89 ml/(min·1.73 m2);G3a期:轻至中度下降45~59 ml/(min·1.73 m2);G3b期:中至重度下降30~44 ml/(min·1.73 m2);G4期:重度下降15~29 ml/(min·1.73 m2);G5期:肾衰竭<15 ml/(min·1.73 m2)。
1.3纳入及排除标准:纳入标准:①符合慢性肾脏病诊断标准;②诊断为慢性肾脏病疾病超过6个月,肾脏疾病相对平稳;排除标准:①不符合纳入标准;②目前正进行其他临床试验;③使用明显影响肾脏功能及胱抑素的治疗及药物;④慢性肾脏疾病存在急性加重;⑤精神及心理障碍等,无法完成试验者。
2 方法
2.1试验设计:本研究为一项回顾性、随机、对照的临床试验研究。
2.2试验分组:84例符合纳入标准的研究对象,随机分为两组,试验组和验证组,每组各42例,试验组男25例,女17例,平均年龄为(60.52±15)岁,体重(61±11.26)kg,身高为(160.36±7.58)cm;验证组男26例,女16例,平均年龄为(64.57±17.42)岁,体重为(61±11.33)kg,身高为(160.83±6.59)cm。
2.3试验试剂及仪器:用真空非抗凝采血管采取空腹静脉血3 ml,送西南医科大学附属中医医院检验科检验,所有样本均采用罗氏Cobas®C702(Roche,德国)全自动生化分析仪检验,肌酐采用罗氏酶法试剂,血清s-cystatin C浓度采用乳胶免疫比浊法检测,配套的罗氏多项生化校准品。再根据中国人简化的肾脏病饮食改良研究公式(the Modification of Diet in Renal Disease equation,MDRD)计算出eGFR(ml/min·1.73 m2)=1.233×186×血肌酐-1.154×年龄-0.203×[女性×0.742],血肌酐单位为mg/dl,年龄单位为岁。
2.4统计学方法:采用SPSS23.0进行统计分析处理,首先对两组数据临床资料进行两独立样本均数比较t检验,然后在试验组中采用线性相关回归,分析胱抑素C与eGFR之间的线性关系,建立模拟回归方程,然后在验证组中对建立的回归方程进行验证,然后采用ROC曲线分析慢性肾脏病临床分期的eGFR值所对应的胱抑素C浓度值,当P<0.05为存在统计学差异。
3 结果
两组患者临床资料比较:见表1。

表1 两组患者临床资料比较
试验组与验证组两组患者的一般资料(年龄、性别、身高及体重)及检测指标(血肌酐、胱抑素C及eGFR)值组间比较差异无统计学意义(P>0.05),可以认为两组基本情况一致,可继续下一步试验研究。
4 讨论
4.1s-cystatin C与eGFR建立线性回归方程:在试验组中将s-cystatin C数值进行倒数换算后发现1/s-cystatin C与eGFR之间的散点图提示两者之间存在直线相关关系,相关系数r=0.86(P<0.001),可以认为胱抑素C的倒数越大,其eGFR值越大;因此对x(1/s-cystatin C)与y(eGFR)两个变量之间继续进行直线回归分析,建立了如下线性方程:y=93.531x - 4.631。方程相关系数为0.86,决定系数为0.74、校正的决定系数为0.734,剩余标准差为11.188,说明该方程的拟合度较好;且对该模型的方差分析提示F=114.027,P<0.001,说明该方程有意义,s-cystatin C与eGFR之间存在上述方程的联系。
4.2回归方程的验证及ROC曲线分析
4.2.1直线回归方程的验证:在验证组中,用血清胱抑素C的浓度,依据获得的直线回归方程模型推算出GFR值,定义为模型组,该模型组与中国改良MDRD方程获得的eGFR进行比较,模型组(31.23±15)ml/min·1.73 m2;验证组(35.96±21.69)ml/min·1.73m2。P值为0.248。
直线回归方程所获得的GFR值样本分布与中国人改良的MDRD方程获得的eGFR的样本分布,差异无统计学意义(P>0.248)。
4.2.2ROC曲线分析结果:将eGFR<60 ml/min·1.73 m2和eGFR<30 ml/min·1.73 m2作为两个临床诊断分界点,对血胱抑素C浓度与eGFR值诊断分界点进行ROC曲线分析,具体分析结果见下图1和图2。
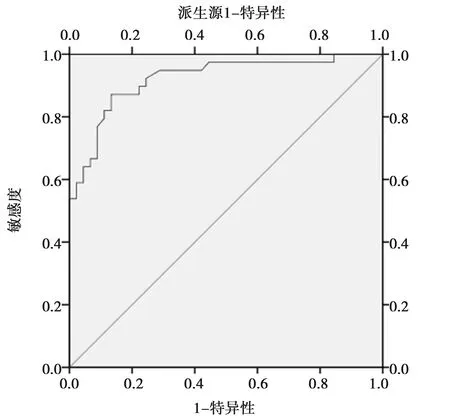
图1 ROC曲线分析(以eGFR<30 ml/min·1.73 m2为临床诊断分界点)
图1为将eGFR<30 ml/min·1.73 m2作为临床诊断分界点时,胱抑素C对eGFR的诊断面积AUC为0.922(P<0.001),当图2为将eGFR<60 ml/min· 1.73 m2作为临床诊断分界点时,胱抑素C对eGFR的诊断面积AUC为0.928(P<0.001),两次ROC的曲线下面积均大于9,诊断的价值较高。此外在临床CKD分期中G1-G5期所对应的eGFR值分别为90、60、30、15 ml/min·1.73 m2,而ROC曲线下对应的血胱抑素C浓度分别为1.15、1.805、2.6、3.805 mg/L。
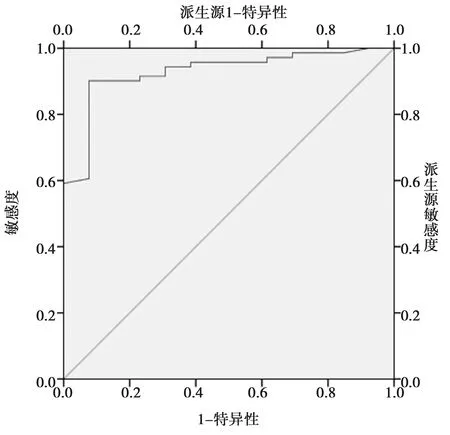
图2 ROC曲线分析(eGFR<60 ml/min·1.73 m2为临床诊断分界点)
5 结论
肾小球滤过率目前是国际上对慢性肾脏疾病进行临床分期的关键依据[1]。慢性肾脏疾病的临床分期不仅对指导肾脏疾病的治疗具有重要意义,临床很多药物的使用也对GFR有明确的要求和限制。GFR测定的公认金标准为静脉注入菊粉后,通过测定菊粉清除率来计算[2-3]。但这种检测方法需要在体内注入外源性物质,为一种有创性操作,且增加了临床工作量,因此临床上应用较少[2]。近年来较多采用放射性核素的清除率和内生肌酐的清除率作为eGFR的替代检测方法,但测定的结果和真实的GFR仍存在一定的差异性,且这些方法受到各医院设备条件限制。因此目前研究致力于寻找简便的、可靠的作为反映肾小球滤过率变化的理想内源性标记物[3-4]。胱抑素C是溶酶体半胱氨酸蛋白酶的内源性抑制剂,已被证明在人体的许多正常和病理代谢过程中发挥重要的作用[5-6],且在评估GFR中血清胱抑素C的浓度比血清尿素氮和肌酐的水平的价值更大,因为它与GFR呈显著的负相关,当GFR轻度受损时,血清胱抑素C水平已经显著升高,并随着疾病的加重而逐渐升高,而且血胱抑素C的浓度基本不受年龄、性别、炎性反应及肿瘤等状态的影响[3-4],因此其可作为反映肾小球滤过功能的理想内源性标记物。
目前,也有部分研究者Hoek和Orebro基于胱抑素C的eGFR估算模型[4-5],研究血清胱抑素C浓度与血肌酐水平、肾小球滤过率之间可能存在的关系。Hoek提出的估算模型为eGFR=80.35/s-cystatin C-4.32,其主要针对各种疑似肾脏病的患者而未考虑CKD的临床分期情况,其研究例数为123例,研究采用的是颗粒增强透射免疫比浊法检测s-cystatin C的浓度[4];Orebro采用的是高效液相色谱法检测血清胱抑素C的浓度,其估算模型为eGFR=124/s-cystatin C-22.3,Orebro的模型是基于临床上获得的所有381例患者数据,其患者的纳入标准不仅针对肾脏疾病患者,还包括其他非肾脏疾病的患者[5]。可见报道的文献研究中均证实血清胱抑素C浓度的倒数确实与eGFR存在明显的线性关系,且基于胱抑素C的eGFR估算方程的应用可能是中、重度CKD患者的最佳选择[7-10],此外马清光等研究者通过对胱抑素C文献荟萃分析也证实了血清胱抑素C浓度与GFR之间存在的相关性,对于肾功能轻、中、重度的降低,相应的血清胱抑素C都能显示出良好的灵敏性及临床价值[11-12]。最近文献报道可采用血清胱抑素C浓度与血肌酐水平结合的预测模型对CKD患者的eGFR进行评价,也取得了较好的预测价值[13]。而在笔者的研究中,主要纳入的是各种原因导致的肾脏病变,且已经诊断为CKD的中重度患者,笔者以(1/s-cystatin C)作为自变量,eGFR作为因变量,探索了两者的关系,并建立的直线回归方程y=93.531/s-cystatin C-4.631,方程相关系数为0.86,首次建立了一个针对中国的CKD患者,基于血清胱抑素C检测的浓度来预测CKD患者eGFR值的模型,从而可对CKD患者目前的临床分期进行预判。
目前国内外尚无血胱抑素C的检测统一标准方法,GFR的值也有多种方法进行估算,因此两者之间的关系公式也得出了多种[3-5],因此限制了血胱抑素C在评估慢性肾脏病临床分期的预测等方面的应用价值[6,14-15]。虽然目前较多的文献报道采用放射性核素清除率来估算GFR,考虑到很多医院对这项技术开展的条件限制以及对患者的接受度,且国内外指南及临床工作者更倾向于采用中国人简化的肾脏病饮食改良研究公式MDRD计算的eGFR作为判断CKD的分期标准,而本研究也是采用的中国改良版本的MDRD来计算eGFR,建立的血s-cystatin C浓度与eGFR直线回归方程,具有较大的实用价值及临床意义。
综上所述,本研究建立了基于血清胱抑素C与中国改良版本的MDRD方程计算的eGFR值之间的预测方程eGFR=93.531/s-cystatin C - 4.631,方程相关系数为0.86,且进行了验证,具有较高的拟合度及适用性,可尝试用于临床,对慢性肾脏病患者的临床分期进行初步判断。
