金花茶对低温胁迫的生理响应及耐寒性分析
2020-03-11张武君刘保财赵云青黄颖桢陈菁瑛
张武君 刘保财 赵云青 黄颖桢 陈菁瑛
(福建省农业科学院农业生物资源研究所/福建省农业科学院药用植物研究中心,福建 福州 350003)
金花茶(Camellia nitidissimaChi)为山茶科山茶属金花茶组灌木或小乔木[1],花色金黄,形美香雅,被誉为“植物界的大熊猫”、“茶族皇后”等,是世界珍稀濒危植物,属国家一级保护植物,不仅具有极高的观赏价值,同时也是广西壮族自治区的传统药用植物,具有清热解毒、利尿消肿的作用[2]。2010 年,金花茶被国家卫生部列入新资源食品,2015 年被国家林业局列入林药植物进行重点发展。金花茶主要分布于广西西南部北回归线以南的北热带雨林,广西的防城、南宁、隆安、扶绥等县(市)以及越南北部。金花茶喜暖畏寒,属热带性树种[3],其耐寒性不及茶梅、华东山茶[4],在原产地可忍耐-3℃的短暂低温[5],最低温为-4℃时未加任何措施虽未被冻死,但生长发育受限制[6]。金花茶各生育期对温度要求不同,植株萌动要求温度在10℃以上,营养生长期适宜温度18 ~23℃,开花期适宜温度13~24℃[5]。目前,关于金花茶的研究主要集中在种苗繁育、栽培管理、化学成分、药理作用等方面[7-8],而其耐寒性及生理特性的研究鲜见报道。李吉涛等[9-10]比较了8 种金花茶的耐寒性及部分生理指标,发现其耐寒性依次为金花茶>龙州金花茶>毛籽金花茶>柠檬黄金花茶>凹脉金花茶>直脉金花茶>东兴金花茶>平果金花茶。为进一步了解金花茶的耐寒性及其在不同低温胁迫的生理变化情况,本研究利用人工气候箱模拟不同温度低温胁迫环境,探讨金花茶幼苗响应低温胁迫的生理特性,以期为金花茶的引种栽培、抗寒育种提供理论依据。
1 材料与方法
1.1 试验材料及仪器
供试材料:防城普通种金花茶(经黄连冬高级工程师鉴定)2 a 生营养袋苗,长势基本一致,由福建世纪金花科技有限公司提供。试验前置于室外树阴下按常规管理,低温胁迫处理于2018 年1 月在福建省农业科学院果树所进行。
GXZ-0288 光照培养箱,宁波江南仪器厂;UV-1780 紫外-可见分光光度计,岛津仪器(苏州)有限公司;BS 110S 万分之一天平,德国赛多利斯公司;2W 阿贝折射仪,上海光学仪器五厂;FE30 电导率仪,梅特勒-托利多仪器(上海)有限公司。
1.2 试验设计
将营养袋苗移入光照培养箱内进行低温暗培养处理,设置6、3、0、-3、-6、-9℃6 个温度梯度,每个温度持续时间以每延长3 h 为一个梯度,即设置3、6、9、12 h 4 个时间梯度,共计24 个处理,每个处理4 株植株,共计96 株金花茶苗。待培养箱达到设定温度后,将金花茶苗放入培养箱中,到设定时间后取出,剪取当年生秋梢上的成熟叶进行相关指标的测定。将叶片洗净、擦干,除去主脉和叶缘后分为两部份,一部份立即用于细胞伤害率(cell injury rate,CIR)和束缚水(bound water,BW)与自由水(free water,FW)含量的测定,其中CIR 测定样品均匀剪成0.50 cm2,BW、FW 测定样品均匀剪成0.20 cm2;另一部分剪成0.50 cm2后按每包0.50 g 用硫酸纸包好,液氮冻存后置于-80℃保存,用于丙二醛(malondialdehyde,MDA)、脯氨酸(proline,Pro)、可溶性糖(soluble sugar,SS)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)等指标的测定。
1.3 试验项目与方法
CIR 测定参考陈爱葵等[11]、王学奎[12]的方法,并略做改进。准确称取待测叶片0.50 g 于试管中,加入20 mL 去离子水,静置21 h 后测定浸提液电导率(R,μs·cm-1),然后于沸水浴加热30 min,冷却至室温后摇匀,再次测定浸提液电导率(R0,μs·cm-1),以未胁迫处理的金花茶叶片的电导率为对照(control,CK)。按照公式计算CIR:
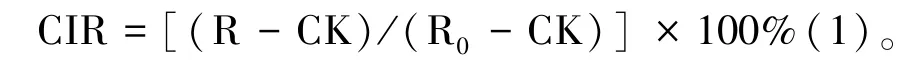
每个温度的处理均设置4 个重复。参照盖钧镒[13]的方法计算半致死温度(semi-cethal temperature,LT50),对同一胁迫持续时间下的不同处理温度及对应的平均CIR 进行Logistic 回归方程拟合。Logistic 方程为:
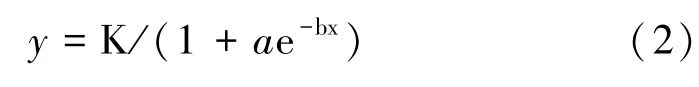
式中,y:CIR(%);x:处理温度(℃);K:CIR 的最大饱和容量;a、b:方程的参数。因CIR 计算中扣除了本底值,故K 值取100。按照公式计算金花茶叶片的低温LT50:

参照许允文[14]的方法测定BW/FW;参照王学奎[12]的方法测定MDA、Pro 和SS 含量;参照张志良[15]的方法测定POD 活性;采用试剂盒(南京建成生物研究所)测定SOD、CAT 活性。
1.4 数据处理
采用Microsoft Office Excel 2010 进行整理数据和作图;SPSS 19.0 软件进行多重比较和双变量相关性分析,采用Duncan’s 法进行差异显著性检验,采用Person’s 相关系数表示相关性。
2 结果与分析
2.1 低温胁迫对细胞伤害率和半致死温度的影响
由图1 可知,随着胁迫时间的延长,各温度下的CIR 呈上升趋势。随着处理温度的降低,金花茶叶片CIR 呈慢-快-慢的增长趋势,与处理温度间呈“S”型曲线,表现为6~0℃时,CIR 缓慢上升,0 ~-6℃时,CIR急剧上升,-6~-9℃时,CIR 上升减缓。处理温度为3~-9℃时CIR 均呈上升趋势,利用Logistic 回归方程对不同胁迫时间下处理温度与金花茶叶片CIR 进行拟合,得到低温LT50为-6.62~-3.94℃(表1),低温胁迫时间越长,LT50越高,表明细胞伤害程度受处理温度和胁迫持续时间的共同影响。

图1 低温胁迫对金花茶叶细胞伤害率的影响Fig.1 Effect of low temperature stress on CIR of C.nitidissima leaives

表1 不同胁迫时间下处理温度与细胞伤害率的Logistic 方程拟合Table 1 Logistic equation fitting of treatment temperatures and CIR under different stress time
2.2 低温胁迫对金花茶叶片MDA 含量的影响
由图2 可知,随着胁迫时间的延长,0℃下金花茶叶片MDA 含量明显上升;-3℃下MDA 含量呈先上升后下降的趋势;-6℃下MDA 含量呈下降趋势;6℃、3℃、-9℃下MDA 含量变化不显著。随着处理温度的降低,MDA 含量总体呈先上升后下降的趋势,变化较为平缓,表明低温胁迫下,MDA 含量不能较好地反应金花茶叶片细胞的伤害程度。
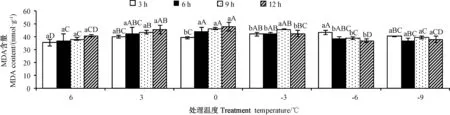
图2 低温胁迫对金花茶叶片MDA 含量的影响Fig.2 Effect of low temperature stress on MDA content of C.nitidissima leaives
2.3 低温胁迫对金花茶叶片保护酶活性的影响
由图3-A 可知,随着胁迫时间的延长,6℃下SOD活性呈先上升后下降的趋势,其他5 个温度下SOD 活性均呈不断下降趋势。3℃处理3 h 时SOD 活性最高,为27.80 U·g-1;-9℃处理12 h 时SOD 活性最低,为7.91 U·g-1。随着处理温度的降低,胁迫时间为3 h时,SOD 活性呈先上升后下降的趋势;胁迫时间为6、9、12 h 时,SOD 活性呈下降趋势。0℃为SOD 活性变化的转折点,0℃及以下低温处理的SOD 活性均维持在较低水平。表明金花茶SOD 活性总体随处理温度的降低及胁迫时间的延长呈下降趋势。
由图3-B 可知,随着胁迫时间的延长,6℃下POD活性小幅波动,3℃下先下降后上升,其余4 个温度下POD 活性均呈下降趋势。-9℃处理3 h 的POD 活性最高,为930.00 U·g-1·min-1,0℃处理12 h 的POD 活性最低,为272.34 U·g-1·min-1。随着处理温度的降低,胁迫时间为3、6 h 时,POD 活性均呈上升趋势;胁迫时间为9 h 时,POD 活性先降低后升高;胁迫时间为12 h 时,POD 活性呈先上升后下降再上升的趋势。表明金花茶POD 活性总体随处理温度的降低呈上升趋势,随胁迫时间延长呈下降趋势。
由图3-C 可知,金花茶叶片CAT 活性较低,重复间误差相对较大。随着胁迫时间的延长,各处理温度下CAT 活性仅小幅波动。-9℃处理3 h 时CAT 活性最高,为0.69 U·g-1;6℃处理6 h 时CAT 活性最低,为0.37 U·g-1。随着处理温度的降低,胁迫时间为3、12 h 时,CAT 活性呈上升趋势;胁迫时间为6 h,CAT 活性呈先上升后下降再上升的趋势;胁迫时间为9 h,CAT活性变化不显著。表明金花茶CAT 活性总体随处理温度的降低呈上升趋势,但随胁迫时间的延长变化不明显。
2.4 低温胁迫对金花茶叶片束缚水与自由水比值的影响
由图4 可知,随着胁迫时间的延长,处理温度为6、3、0℃时,BW/FW 呈小幅上升趋势;处理温度为-3℃时,BW/FW 呈先升后降趋势;处理温度为-6、-9℃呈下降趋势。-6℃处理3 h 时BW/FW 最高,为0.42,-9℃处理9 h 时BW/FW 最低,为0.25。随着处理温度的降低,BW/FW 在胁迫3、6、12 h 时均呈先上升后下降的趋势;在胁迫9 h 时呈先维持再下降的趋势。表明金花茶BW/FW 随着处理温度的降低总体呈先上升后下降的趋势,不同温度下随胁迫时间的延长变化不同。
2.5 低温胁迫对金花茶叶片细胞渗透调节物质含量的影响
由图5-A 可知,随着胁迫时间的延长,处理温度为6℃和3℃时,Pro 含量呈上升趋势;处理温度为0℃和-6℃时无显著差异;处理温度为-3℃和-9℃时,Pro含量呈先升高后降低趋势。0℃处理12 h 时Pro 含量最高,为13.74 μg·g-1,-9℃处理12 h 时Pro 含量最低,为3.13 μg·g-1。随着胁迫时间的延长,处理温度为6~0℃时Pro 含量呈上升趋势,处理温度为0℃和-3℃时Pro 含量较高,之后维持在较低水平。表明金花茶Pro 含量随着处理温度的降低总体呈先上升后下降的趋势,不同温度下随胁迫时间的延长变化不同。
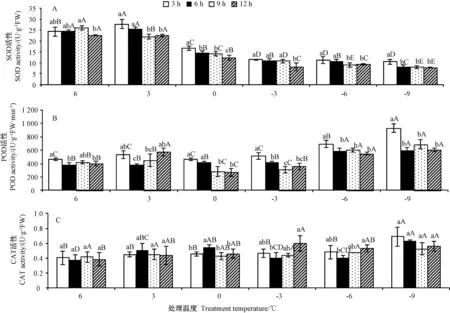
图3 低温胁迫对金花茶叶片SOD、CAT、POD 活性的影响Fig.3 Effect of low temperature stress on SOD,POD,CAT activities of C.nitidissima leaives
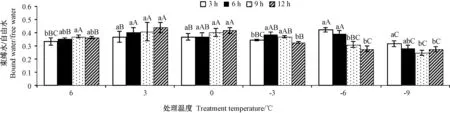
图4 低温胁迫对金花茶叶片束缚水与自由水比值的影响Fig.4 Effect of low temperature stress on ratio of bound water to free water(BW/FW)of C.nitidissima leaives
由图5-B 可知,随着胁迫时间的延长,处理温度为6、0、-6℃时,SS 含量无显著变化;处理温度为3、-3℃时,SS 含量呈先上升后下降的趋势;处理温度为-9℃时SS 含量呈下降趋势。-9℃处理3 h 时SS 含量最高,为6.40%;6℃处理9 h 时SS 含量最低,为3.87%。随着处理温度的降低,SS 在6 ~-6℃不断上升,-6 ~-9℃保持稳定。表明金花茶SS 含量随着处理温度的降低总体呈先上升再稳定的趋势,不同温度下随胁迫时间的延长变化不显著或最终下降。
2.6 低温胁迫中金花茶叶片各项抗寒生理指标的相关性分析
由表2 可知,处理温度与CIR 始终呈极显著负相关,表现为随着处理温度降低,CIR 显著上升。CIR 与BW/FW 在低温胁迫9、12 h 时分别呈极显著和显著负相关;与SS 含量在胁迫3、9、12 h 呈显著正相关;与SOD 活性在胁迫9 h 呈显著负相关;与POD 活性在胁迫3、6 h 呈极显著正相关;与CAT 活性在胁迫3 h 和胁迫9 h 分别呈极显著和显著正相关;与MDA 和Pro 含量无显著相关性。表明BW、SS 含量,SOD、POD、CAT 活性在胁迫的不同阶段对细胞的损伤进行响应,而MDA含量与Pro 含量对低温胁迫的响应无明显规律。
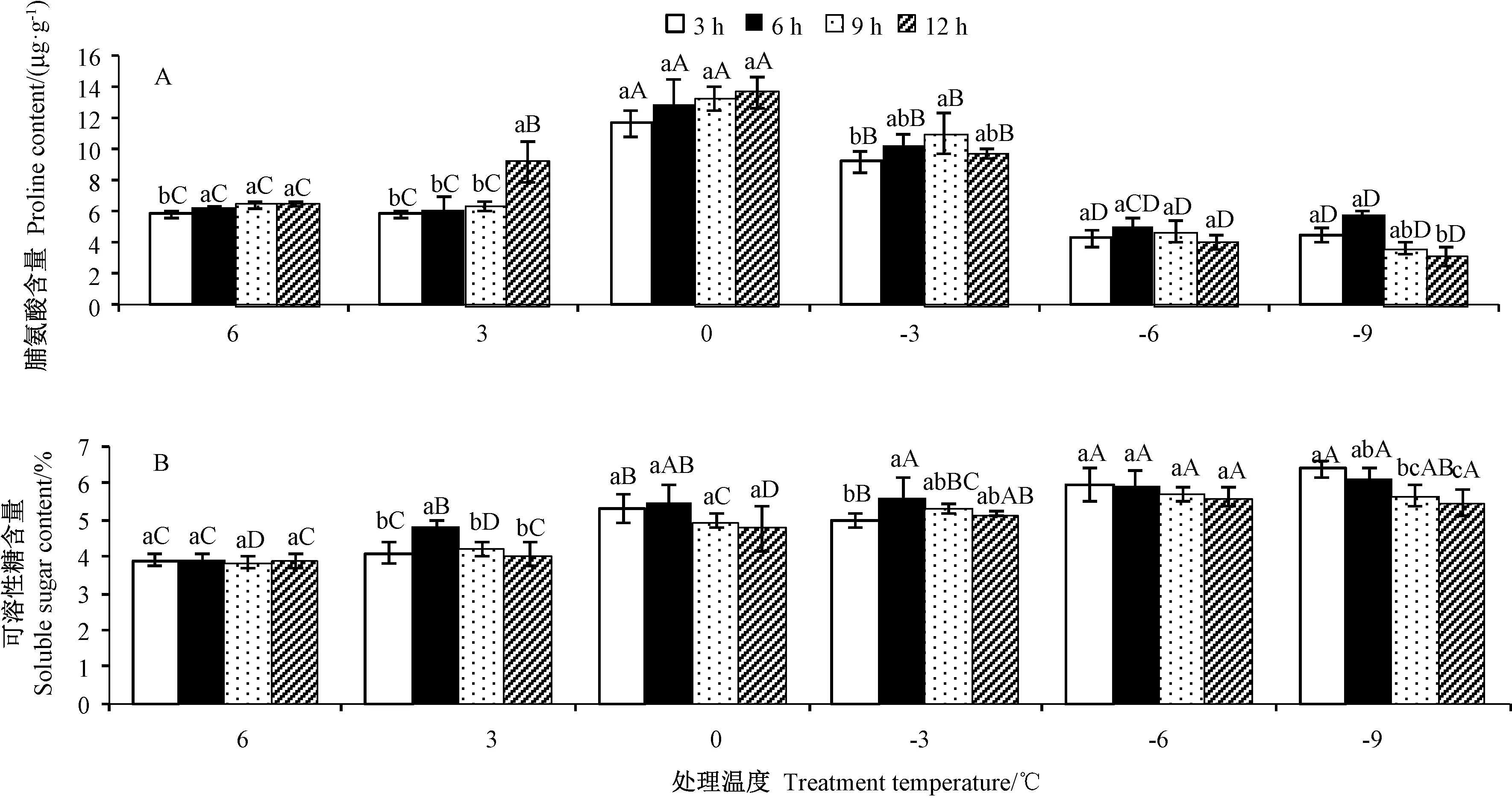
图5 低温胁迫对金花茶叶片脯氨酸和可溶性糖含量的影响Fig.5 Effect of low temperature stress on proline and soluble sugar content of C.nitidissima leaives
3 讨论
LT50是判断植物抗寒能力的重要生理指标之一,以LT50确定生态分布的最低温度,能快速鉴定植物的抗寒能力[16],可避免引种和推广工作中的盲目性。目前,该方法已被用于广西油茶[17]、香花油茶[18]、滇山茶[19]等山茶科植物抗寒能力的鉴定。本研究中,金花茶幼苗叶片在低温胁迫3 h 的LT50为-6.62℃。这与郭亚男等[20]测得的-6.16℃ 相近,但高于李吉涛等[10]测得的-14.58℃。这可能与本试验浸提时间更长,电解质外渗更充分等有关。
MDA 是细胞膜脂过氧化产物,其含量常作为膜系统损伤程度的指标。研究表明,MDA 含量随着胁迫温度的降低均有不同程度的上升[21-22]。而本研究中,MDA 含量随着处理温度的降低及胁迫时间的延长呈先上升后下降的趋势。这与李吉涛等[9]的研究结果相似,但其测得的MDA 含量达到峰值的温度低于LT50,与本研究不同,推测可能是由于本试验降温较快,导致细胞受低温伤害在较短的时间内死亡,MDA含量保持在一个较低水平,具体原因有待进一步研究。
SOD、POD、CAT 是抗氧化酶系统清除活性氧的主要酶[23-24]。本试验中,金花茶叶片SOD 活性随处理温度的降低而降低,POD、CAT 活性虽有波动,但总体呈上升趋势。前人研究表明,茶树SOD 同工酶活性及谱带数随处理温度的降低和胁迫时间的延长均呈不同程度的降低或减少[25],冬季低温导致茶树叶片的CAT、POD 活性提高,而POD 同工酶谱带增加[26]。这与本研究结果类似。
植物体内束缚水含量的增加有利于提高抗寒性。研究发现随着胁迫温度的降低,植物BW/FW 一般呈现持续上升[27]或先上升再下降[28-30]两种变化趋势。本研究中,金花茶叶片的BW/FW 总体呈先上升后下降的趋势,可能因为在一定的胁迫温度和时间内,金花茶植株能通过提高BW/FW 来降低代谢活性,减轻低温伤害,但当胁迫温度和时间超过其忍受范围后,细胞结构和代谢受到严重破坏,BW/FW 反而下降。
Pro 和SS 是细胞内重要的渗透调节物质,其中Pro 具有增强细胞抗脱水能力、稳定细胞蛋白质结构的作用[31],SS 可以通过提高细胞液浓度来降低冰点,其含量与植物的抗寒性相关[32-33]。田野等[34]研究发现SS、Pro 都是茶树抗寒物质,且SS 含量与温度的相关性大于Pro 含量与温度的相关性。本研究中,金花茶叶片Pro 含量随着处理温度的下降呈先上升后下降的趋势。这与李吉涛等[10]的研究结果相似,但Pro 含量达到最大值的温度不同;SS 含量随着处理温度的降低呈上升趋势,但随着胁迫时间的延长维持稳定或最终下降,可能原因是细胞受到低温胁迫后,水解能力增强,淀粉等大分子化合物降解成SS 等物质,随着胁迫时间的延长,糖类大分子化合物持续减少,使得产物SS 的含量保持稳定或下降。
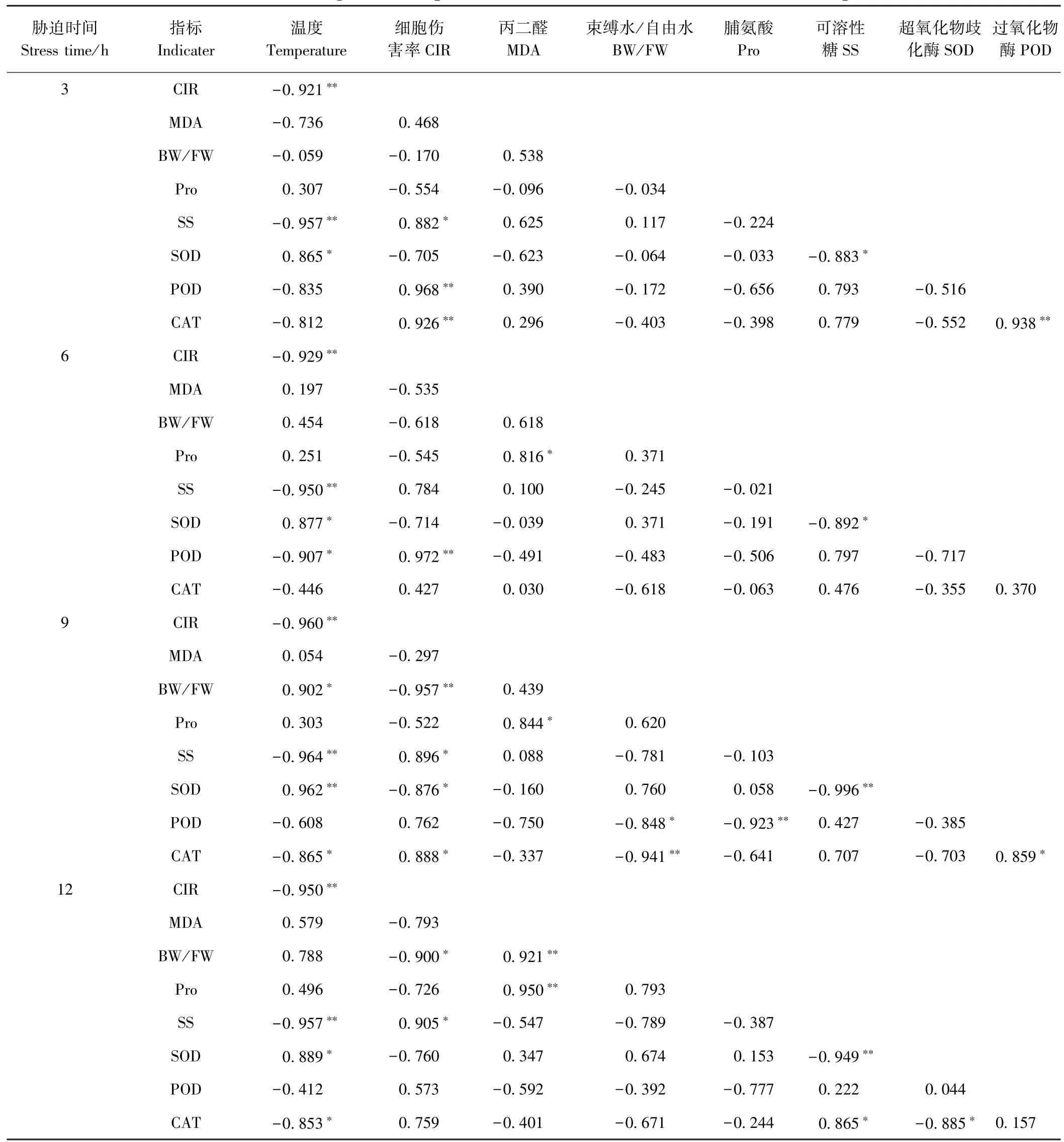
表2 不同低温胁迫下金花茶叶片各项指标的相关性分析Table 2 Correlations among the tested parameters of C.nitidissima leaives under low temperature stress
4 结论
本研究结果表明,金花茶幼苗引种地的极端低温不宜低于-6℃,建议如果引种地最低气温低于-6℃,应做好防寒保护措施或采用设施栽培。金花茶叶片的CIR 随着处理温度的降低呈显著上升的趋势,相关性分析表明BW、SS、SOD、POD、CAT 在胁迫的不同阶段与CIR 显著相关,因此可以将CIR 作为金花茶抗寒性鉴定的主要指标,将BW/FW、SS、SOD、POD、CAT 作为抗寒性鉴定的辅助指标。本研究为进一步探讨金花茶品种抗寒性及栽培区域选择提供了科学依据。
致谢:福建省农业科学院果树研究所为本研究提供了实验场地和实验仪器,谨此致谢!
