低温贮藏对美味猕猴桃布鲁诺果实主要挥发性物质和脂肪酸代谢的影响
2020-03-11陶淑华蒋镇烨宋倩倩宋亦超姜天甲郑小林
陶淑华 陈 丽 蒋镇烨 宋倩倩 宋亦超 姜天甲 郑小林
(浙江工商大学食品与生物工程学院,浙江 杭州 310018)
果实风味是评价采后果实品质的一项重要指标[1],主要由酯类、醛类、醇类、内酯类、萜类、羰基化合物及一些含硫化合物等多种挥发性物质通过累加、协同或抑制作用形成。果实风味具有种或品种差异,且采后果实风味会随贮藏进程发生变化。因此,采后果实的风味变化及其调控引起了研究者的广泛关注。已有研究表明,果实挥发性物质的生成存在多种合成途径,根据前体物质的不同可分为脂肪酸途径、氨基酸途径、单糖途径和萜类合成途径等,其中脂肪酸代谢途径又分为脂氧合酶(lipoxygenase,LOX)代谢途径和β-氧化途径[2-3]。
猕猴桃属于典型的呼吸跃变型果实,在后熟过程中会伴随挥发性物质的合成和转化,形成果实独特的风味。目前,已从中华猕猴桃、美味猕猴桃、毛花猕猴桃果实中鉴定出300 多种挥发性物质,主要包括酯类、醛酮类、醇类以及杂环化合物等[4]。研究表明,不同品种猕猴桃果实的挥发性成分和含量在成熟过程中发生变化,导致果实风味变化,其中,LOX 代谢途径在猕猴桃果实的成熟过程中起重要作用,并对果实风味物质尤其是酯类、醛酮类的合成至关重要[5]。低温能够降低采后果蔬的生理代谢活性,控制病原微生物生长,从而延缓果蔬的成熟衰老,降低果蔬的腐烂,保持产品的品质,因此,低温贮藏是采后果蔬贮藏保鲜最通用有效的方法[6]。同样,低温贮藏也是猕猴桃果实最常用的保鲜方法,但低温贮藏往往影响猕猴桃果实风味物质的形成,从而影响果品质量和商品性[7-8]。
美味猕猴桃布鲁诺(Actinidia deliciosa.cv.Bruno)是浙江省农业科学院园艺所从新西兰引进的优良栽培品种,其果实呈长圆柱形,外观好,大小适中,果肉呈翠绿色,糖度高,风味浓[9]。浙江工商大学食品与生物工程学院郑小林课题组前期研究了常温和低温贮藏对美味猕猴桃布鲁诺果实乙醇代谢和挥发性成分的影响,发现低温贮藏有助于保持果实品质,因其可有效抑制果实后熟过程中乙醇的代谢活性,从而避免果实完熟后产生过重“酒精味”;但低温贮藏减弱了果实后续的乙醇酯化反应,导致完熟果实的酯类物质种类及含量降低[8]。为此,本试验以美味猕猴桃布鲁诺果实为材料,比较分析常温和低温贮藏下猕猴桃果实脂肪酸合成途径关键酶活性及其基因相对表达量的变化,进一步探讨低温贮藏对猕猴桃果实挥发性物质合成代谢的影响,以期为调控猕猴桃采后果实的风味品质提供理论依据。
1 材料与方法
1.1 材料与处理
美味猕猴桃布鲁诺果实于2016 年10 月26 日采自浙江省温州市泰顺县尚进农业合作社猕猴桃种植基地。选取大小均匀、成熟度一致、无病虫害、无机械伤的果实,于室温下放置过夜,以去除果实残留田间热。次日将猕猴桃果实随机分为2 组,分别置于常温(20±0.5℃,相对湿度80%~90%)和低温(1±0.5℃,相对湿度80%~90%)恒温恒湿箱中贮藏。常温和低温贮藏组分别每隔3 d 和15 d 取样。每次分别从各组随机选取20 个果实,去除果皮和果心后,将果肉切碎混匀,液氮处理后保存于-80℃冰箱备用。
1.2 仪器与设备
7890A-5975C 气相色谱- 质谱联用仪(gas chromatography-mass spectrometer,GC-MS)、VF-WAXms色谱柱、SPME 手动进样器,美国安捷伦科技有限公司;50/30 μm DVB/CAR/PDMS 萃取头,美国Supelco公司;HH-4 数显水浴锅,常州澳华仪器有限公司;SIGMA3-30K 高速离心机,德国SIGMA 公司;UV-1800 紫外可见分光光度计,日本岛津公司;ORION STAR SERIES PH 计,美国THERMO 公司;CFX384 多重实时荧光定量PCR 仪,美国Bio-Rad 公司;AB135-S电子天平,瑞士METTLER TOLEDO 公司。
1.3 试验方法
1.3.1 果实挥发性物质测定 参考李盼盼等[8]的方法,稍作改动。取5 g 果肉,加入6 mL 饱和氯化钠溶液,冰浴研磨匀浆转入20 mL 顶空样品瓶中,用带有硅橡胶隔垫的瓶盖密封。将顶空样品瓶置于50℃水浴锅平衡30 min,然后将萃取头插入顶空瓶中距离液面1 cm 处,50℃吸附30 min,取出后插入GC 进样口,250℃解析3 min,进行GC-MS 分析,重复3 次。
色谱条件:色谱柱:VF-WAXms,30 m×0.25 mm ×0.25 μm(柱长× 内径× 膜厚);进样口温度250℃,分流比1∶1,载气为氦气,恒流模式,柱流速1 mL·min-1,柱温:35℃保持3 min,以2℃·min-1升至120℃,然后以4℃·min-1升至180℃,再以10℃·min-1升至240℃,保持5 min。
质谱条件:离子源:EI,离子源温度:230℃,四级杆温度:150℃,质量数扫描范围:33~400 amu。
1.3.2 挥发性成分定性和定量分析 定性方法:利用计算机检索NIST/WILLEY 标准谱库及资料分析对离子谱图进行匹配分析。
定量方法:挥发性成分相对百分含量用峰面积归一法计算。
1.3.3 果实特征风味物质分析 参照黄梅丽等[10]的方法,对相对含量大于1%且阈值相对较小的挥发性成分进行香气活性值分析,即香气活性值(odor activity value,OAV)=香味物质的浓度/香气阈值。
香气阈值参考文献[11-12]。当OAV 小于1 时,表示该成分对香味没有贡献;当OAV 大于1 时,其值越大则该成分对香味的贡献越大,也表明该成分是构成果实风味的特征风味之一。
1.3.4 亚油酸和亚麻酸含量测定 将果肉组织真空冷冻干燥36 h,取2 g 果肉组织干样于索氏提取器,烧瓶中加入100 mL 石油醚,于70℃水浴回流5 h,减压旋蒸除去石油醚,得到淡黄色或黄色透明提取液。取0.5 mL 样品提取液,加入4 mL 0.5 mol·L-1KOHCH3OH 溶液,置恒温水浴锅内70℃回流1 h,放置至室温后,加入3 mL 正己烷充分振荡,3 000 r·min-1离心20 min。将上层清液用适量的无水硫酸钠干燥后,过0.22 μm 有机膜,进行GC-MS 分析,重复3 次。
色谱条件:色谱柱:DB-WAX,60 m × 0.25 mm ×0.5 μm(柱长× 内径× 膜厚)。进样口温度:240℃,进样量:2.5 μL,不分流进样,恒流模式。柱流速:2 mL·min-1,柱温:50℃保持3 min,以20℃·min-1升至200℃,然后以3℃·min-1升至240℃,保持10 min。
质谱条件:离子源:EI,离子源温度:230℃,四级杆温度:150℃,质量数扫描范围:33~500 amu。
用正己烷配制不同浓度的亚油酸和亚麻酸标准溶液,确定出峰时间,以浓度为横坐标,峰面积为纵坐标绘制标准曲线。
1.3.5 脂肪酸代谢途径关键酶活性测定 脂氧合酶(lipoxygenase,LOX)测定:参考陈昆松等[13]的方法,略有改动。取2 g 果肉,加入10 mL 0.1 mol·L-1磷酸提取缓冲液(含4%聚乙烯聚吡咯烷酮crosslinking polyvingypyrrolidone PVPP,pH 值6.8),冰浴研磨匀浆,4℃、10 000×g离心20 min,上清液即为粗酶液,0℃冰浴保存备用。
脂氧合酶活性反应体系:2.75 mL 0.1 mol·L-1乙酸缓冲液(pH 值5.5),50 μL 5 mmol·L-1亚油酸钠,200 μL 粗酶液。于234 nm 波长处测定吸光度,加酶液15 s 开始计时,记录1 min 内吸光度值变化,结果用U·g-1FW 表示。
氢过氧化物裂解酶(hydroperoxidase,HPL)活性测定:参考Vick[14]的方法,略有改动。取2 g 果肉,加入4 mL 0.15 mol·L-1HEPES-KOH 提取缓冲液[含10 mmol·L-1MgCl2、10 mmol·L-1Ethylene Diamine Tetraactetic Acid(EDTA)、250 mmol·L-1山梨醇、0.1 mmol·L-1Phenylmethanesulfonyl fluoride(PMSF),4%PVPP、1%甘油,pH 值8.0],冰浴研磨匀浆,4℃、10 000×g离心20 min,上清液即为酶液,冰浴保存备用。酶活性测定参照HPL 试剂盒(上海岚派生物科技有限公司)的方法。
乙醇脱氢酶(ethanol dehydrogenase,ADH)活性测定:参考Longhurst 等[15]的方法,略有改动。取2 g 果肉,加入5 mL 0.1 mol·L-1MES-Tris 提取缓冲液[含2 mmol·L-1二硫苏糖醇DL-Dithiothreitol(DTT)、4%PVPP,pH 值6.5],冰浴研磨匀浆,4℃、12 000×g离心20 min,上清液即为酶液,冰浴保存备用。酶活性测定参照ADH 试剂盒(上海岚派生物科技有限公司)的方法。
醇酰基转移酶(alcohol acyltransferase,AAT)活性测定:参考Salas[16]的方法,略有改动。取2 g 果肉,加入4 mL 0.1 mol·L-1磷酸提取缓冲液(含1 mmol·L-1DTT、1% PVPP、0.1% Triton X-100,pH 值8.0),冰浴研磨匀浆,4℃、12 000×g离心20 min,上清液即为酶液,冰浴保存备用。酶活性测定参照AAT 试剂盒(上海岚派生物科技有限公司)的方法。
上述酶活性测定均重复3 次。
1.3.6 脂肪酸代谢途径相关酶基因表达的测定 猕猴桃果肉总RNA 提取参考Zhu 等[17]的方法,采用SuperScriptTMⅢFirst-Strand Synthesis SuperMix 进行逆转录试验。Real-Time PCR 检测:利用多重实时荧光定量PCR 仪进行扩增,引物序列及条件见表1。其中,AAT1、AAT17 编码基因引物序列及条件查询Günther 等[18]的结果。PCR 反应体系为20 μL,包括8.0 μL SDW、10.0 μL Power SYBR® Green Master Mix、0.5 μL(10 μmol·L-1)Forward Primer、0.5 μL(10 μmol·L-1)Reverse Primer,1.0 μL cDNA。PCR 反应程序采用二步法:95℃预变性1 min,95℃变性15 s,63℃退火25 s,40 个循环,在PCR 反应的第二步采集荧光信号。各基因的相对表达水平以2(Ct内参基因-Ct目的基因)进行统计分析。

表1 Real-Time PCR 引物序列及条件Table 1 Real-Time PCR primers and conditions
1.4 数据处理
采用Origin 9.0 和SPSS 21.0 软件进行数据统计分析与作图。
2 结果与分析
2.1 常温、低温贮藏期间果实主要挥发性成分相对含量的变化
对检测鉴定出的猕猴桃果实挥发性成分按酯类、醛酮类和醇类进行归类分析。由表2 可知,常温贮藏下,果实酯类物质相对含量持续升高,贮藏7 ~10 d 期间相对含量显著升高(P<0.05),10 d 时其含量为7 d 的10 倍;低温贮藏下,果实酯类物质含量呈波动式下降,总体变化幅度平缓。表明低温贮藏降低了猕猴桃果实酯类的相对含量,从而改变了果实特有风味。
常温贮藏下,果实醛酮类物质在整个贮藏期间呈先增大后减小的趋势,在贮藏4 d 时其相对含量达到最高(80.57%),随后下降,在贮藏10 d 时显著下降(P<0.05),此时其相对含量为贮藏7 d 的三分之一;低温贮藏下,果实醛酮类物质相对含量较稳定,在77.29%~82.30%范围内变化。
常温贮藏下,果实醇类物质相对含量呈先增加后减小的趋势,在贮藏7 d 时达到峰值(14.12%);低温贮藏下,果实醇类物质相对含量总体呈波动上升趋势,在贮藏后期达到最大值(14.04%)。虽然常温和低温贮藏下果实的醇类挥发性组分在最大相对含量差异不显著(P>0.05),但常温贮藏7 d 时,其含量达到高峰值,而后显著降低;而低温贮藏在61 d 时才出现高峰值。
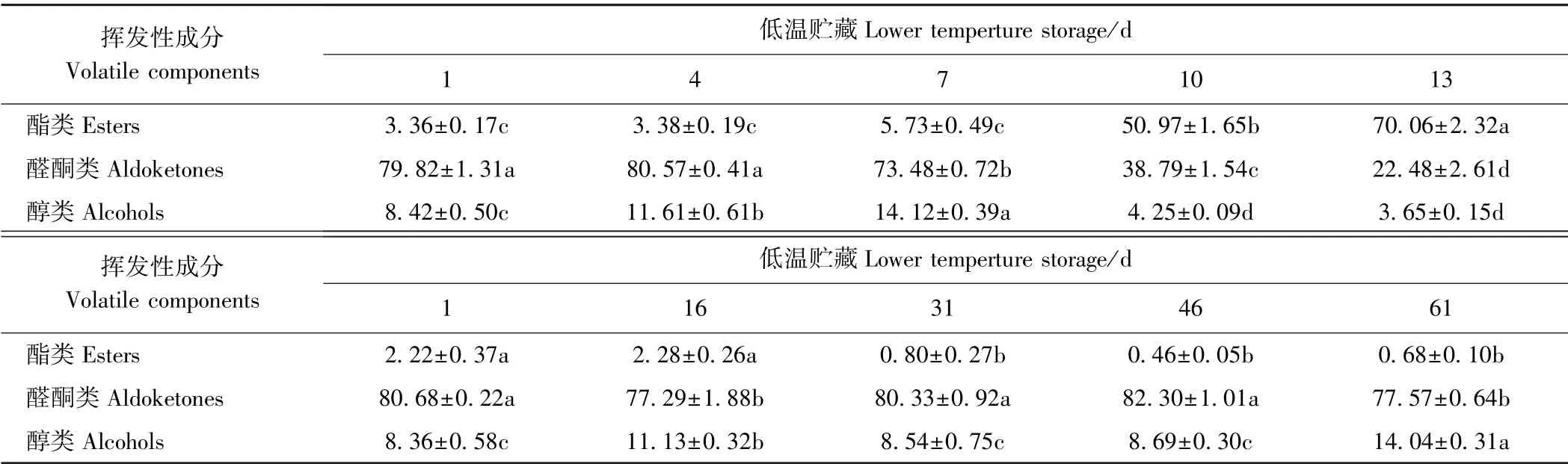
表2 常温和低温贮藏期间果实主要挥发性成分相对含量的变化Table 2 Changes in relative contents of the main volatile components in kiwifruit during storage at room and lower temperature /%
2.2 常温、低温贮藏期间果实特征风味物质分析
由表3 可知,常温贮藏下,果实的特征风味物质成分在整个过程中变化较大,在贮藏1 ~4 d 时有4 种特征风味物质,按香气活性值的大小依次为2-己烯醛、己醛、2-己烯醇和丁酸丁酯;贮藏7 ~13 d 时有9 种特征风味物质,按香气活性值的大小依次为丁酸乙酯、2-己烯醛、己醛、己酸乙酯、乙酸乙酯、丁酸甲酯、乙醇、2-己烯醇和丁酸丁酯。低温贮藏下,果实特征风味物质在整个过程相对稳定,包括2-己烯醛、己醛和2-己烯醇。表明猕猴桃采后果实特征风味物质主要是丁酸乙酯、己酸乙酯、2-己烯醛、乙酸乙酯、己醛、丁酸甲酯、乙醇、2-己烯醇和丁酸丁酯等。
在OAV 的基础上对常温和低温贮藏下果实特征风味物质进行主成分分析,由表4 可知,有2 个主成分特征值大于1,第一主成分(PCA1)特征值为7.402,贡献率为82.239%,第二主成分(PCA2)特征值为1.073,贡献率为11.923%,2 种主成分累计贡献率达94.162%,基本可以代表样品的全部信息特征。
由图1 可知,常温贮藏下各个贮藏时间点分布较为松散,表明在整个贮藏期间果实特征风味物质变化较大;而低温贮藏下各贮藏时间点分布相对集中,贮藏1 d 和16 d 的点分布于PCA2 正区,而贮藏31 d 之后的点分布较紧密,且处于PCA2 负区。表明在整个低温贮藏期间,猕猴桃果实特征风味物质发生变化的点处于贮藏16 d 左右。
本试验采用系统聚类法,以欧氏距离的平方为度量准则,通过离差平方和法,以猕猴桃果实挥发性物质中OAV 最高的8 种物质作为变量,对2 种贮藏温度下5 个贮藏期猕猴桃果实的挥发性物质进行聚类分析。由图2 可知,当横坐标距离为5 时,2 种贮藏温度下各贮藏期的猕猴桃果实可聚为两类,常温贮藏第10、第13 天的果实聚为一类,其他贮藏期的果实聚为一类。其中,低温贮藏第31、第46 天的果实首先聚为一类,随后低温贮藏第1、第16 天的果实聚为一类。挥发性物质的聚类分析说明,常温贮藏第10 天猕猴桃果实的风味物质发生了较大变化,而低温贮藏猕猴桃果实特征风味物质的变化可能发生在第16 和第46 天。
2.3 常温、低温贮藏期间果实不饱和脂肪酸含量的变化
由图3-A 可知,常温贮藏初期,果实亚麻酸含量急剧降低,至4 d 达到最低水平,之后随贮藏时间延长保持相对稳定;低温贮藏期间,果实亚麻酸含量在前16 d保持不变,之后急剧增加,在31 d 时达到高峰后开始降低。对比发现,低温贮藏前期亚麻酸的含量几乎不变,贮藏期果实亚麻酸含量最大值约为常温贮藏最大值的2 倍。
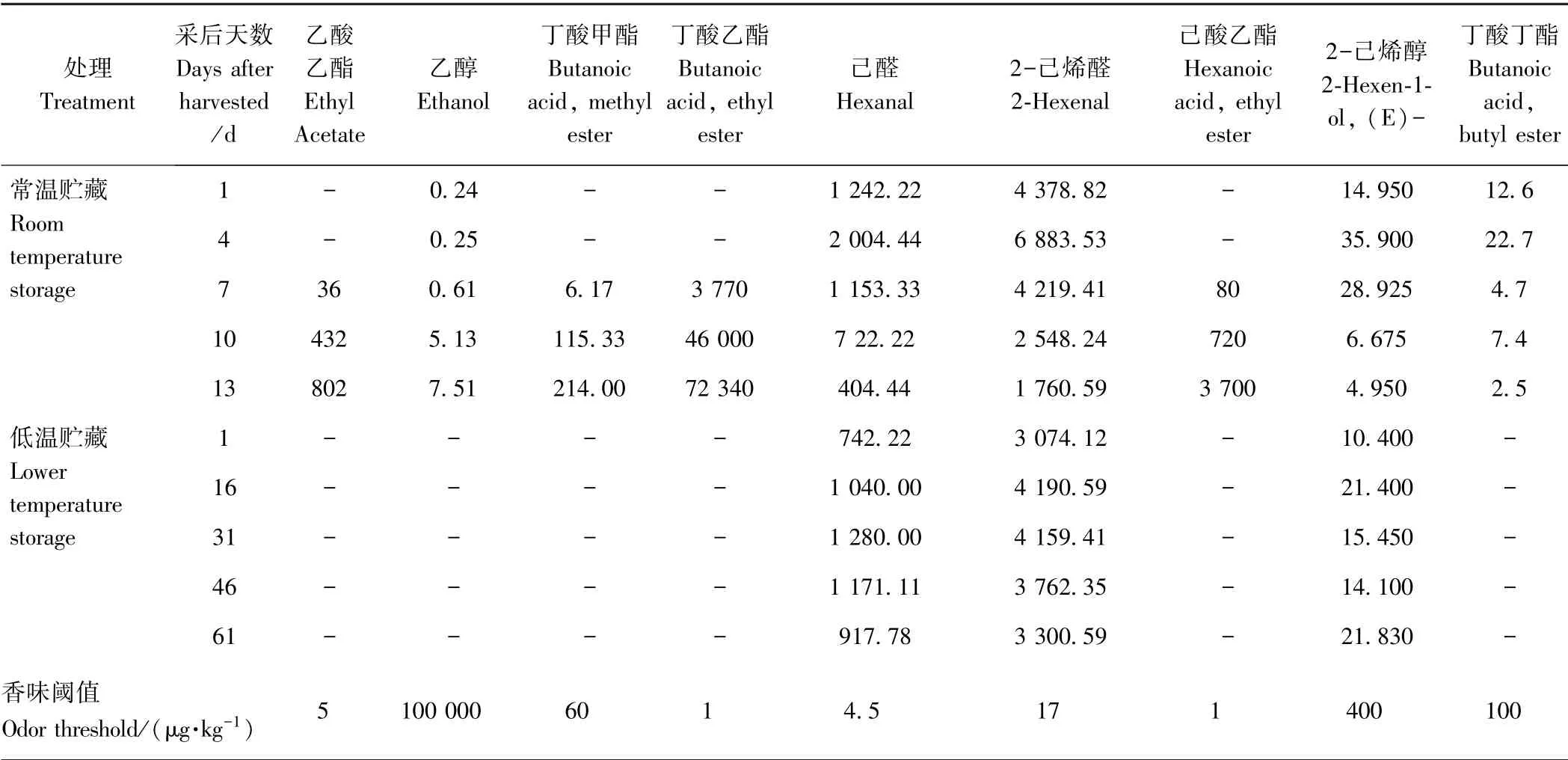
表3 常温和低温贮藏期间果实主要挥发性成分的香气值Table 3 Odor activity values of main volatile compounds in kiwifruit during storage at room or lower temperature

表4 4 个主成分的特征值及贡献率Table 4 Eigenvalues of 4 principal components and their contribution and cumulative contribution
由图3-B 可知,常温贮藏期间,猕猴桃果实亚油酸含量在第4 天时达到峰值,随后缓慢下降;低温贮藏下,果实亚油酸含量不断增加,贮藏46 d 时达到高峰,随后急剧降低。低温贮藏期间果实亚油酸含量均高于常温贮藏,且其最高含量约为常温贮藏期间最高含量的4 倍。
2.4 常温、低温贮藏下果实LOX、HPL、ADH 和AAT 活性的变化
由图4-A 可知,果实LOX 活性在常温贮藏下随贮藏时间的延长急剧增加,且在贮藏10 d 达到峰值,而后下降;低温贮藏下,果实LOX 活性逐渐增强,贮藏46 d 达到最大值,而后略微下降。常温贮藏果实LOX 活性均高于低温贮藏。表明低温缓解了果实贮藏期间LOX 活性的增加速率,从而降低氢过氧化物在果实内的积累。
由图4-B 可知,果实HPL 活性在常温贮藏期间呈波动变化趋势,贮藏7 d 时活性达到最高;而低温贮藏期间,果实HPL 活性前期略有下降而后上升,总体变化趋势不明显。常温贮藏期间果实HPL 活性高于低温贮藏,且其最大值是低温贮藏最大值的2 倍。表明低温同样抑制了HPL 活性,阻碍了果实中醛类物质的生成积累。
由图4-C 可知,果实ADH 活性在常温贮藏前7 d缓慢升高,而后急剧增加,至贮藏10 d 达到峰值随后迅速降低;低温贮藏期间,果实ADH 活性呈缓慢上升趋势,在贮藏61 d 时ADH 活性达到最高。与LOX 和HPL 相比,低温贮藏对ADH 活性的抑制效果更为明显,常温贮藏下ADH 活性最大值约是低温贮藏最大值的3.4 倍。
由图4-D 可知,果实AAT 活性在常温贮藏期间不断增加;但低温贮藏期间其活性不断下降,贮藏46 d达到最低值,而后略有增加。常温贮藏下果实AAT 在16 d 时达到最大值,约为低温贮藏最大值的2 倍。
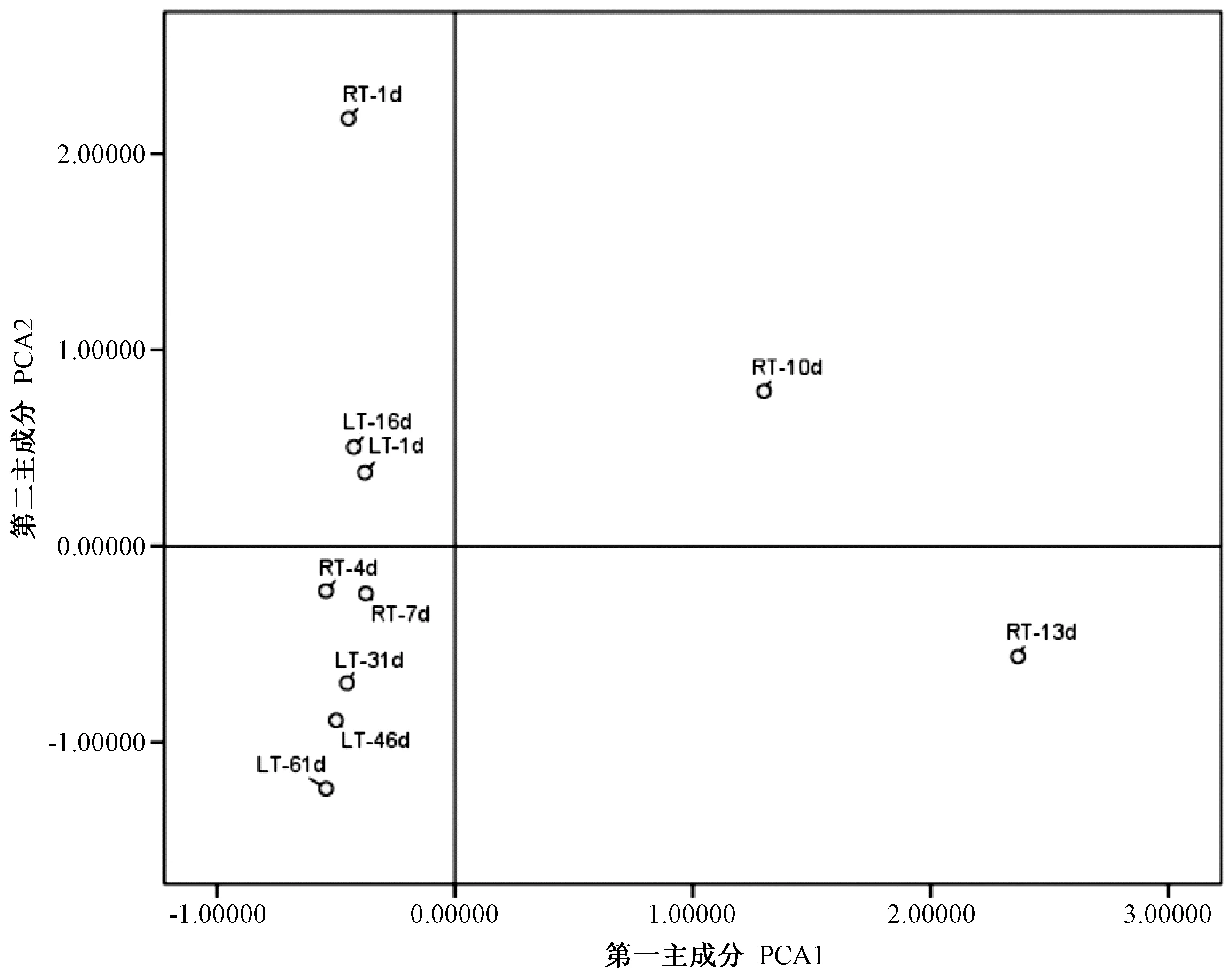
图1 常温低温贮藏期间布鲁诺猕猴桃果实特征风味物质的PCA 分析Fig.1 PCA analysis of Bruno characteristic flavor compounds during storage at room or lower temperature
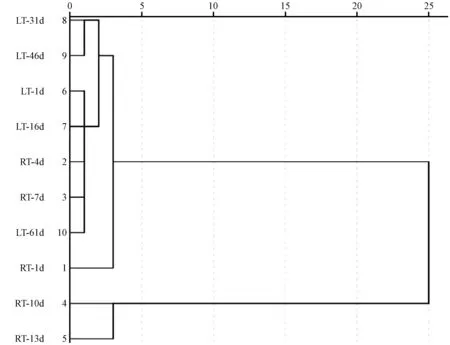
图2 常温低温贮藏期间布鲁诺猕猴桃果实特征风味物质的聚类分析Fig.2 Cluster analysis of Bruno characteristic flavor compounds during storage at room or lower temperature
2.5 常温、低温贮藏下果实LOX、HPL、ADH 和AAT相对表达量的变化
由图5-A 可知,果实LOX相对表达量在常温贮藏期间急剧增加;在低温贮藏前46 d 缓慢增加,而后快速增加。果实在常温和低温贮藏下LOX相对表达量在初期处于相同水平,随着贮藏时间的延长,两者的表达量差异逐渐增大。表明低温有效抑制了LOX的相对表达。

图3 常温和低温贮藏下果实亚麻酸和亚油酸含量的变化Fig.3 Changes in contents of linolenic acid and linoleic acid in kiwifruit during storage at room or lower temperature
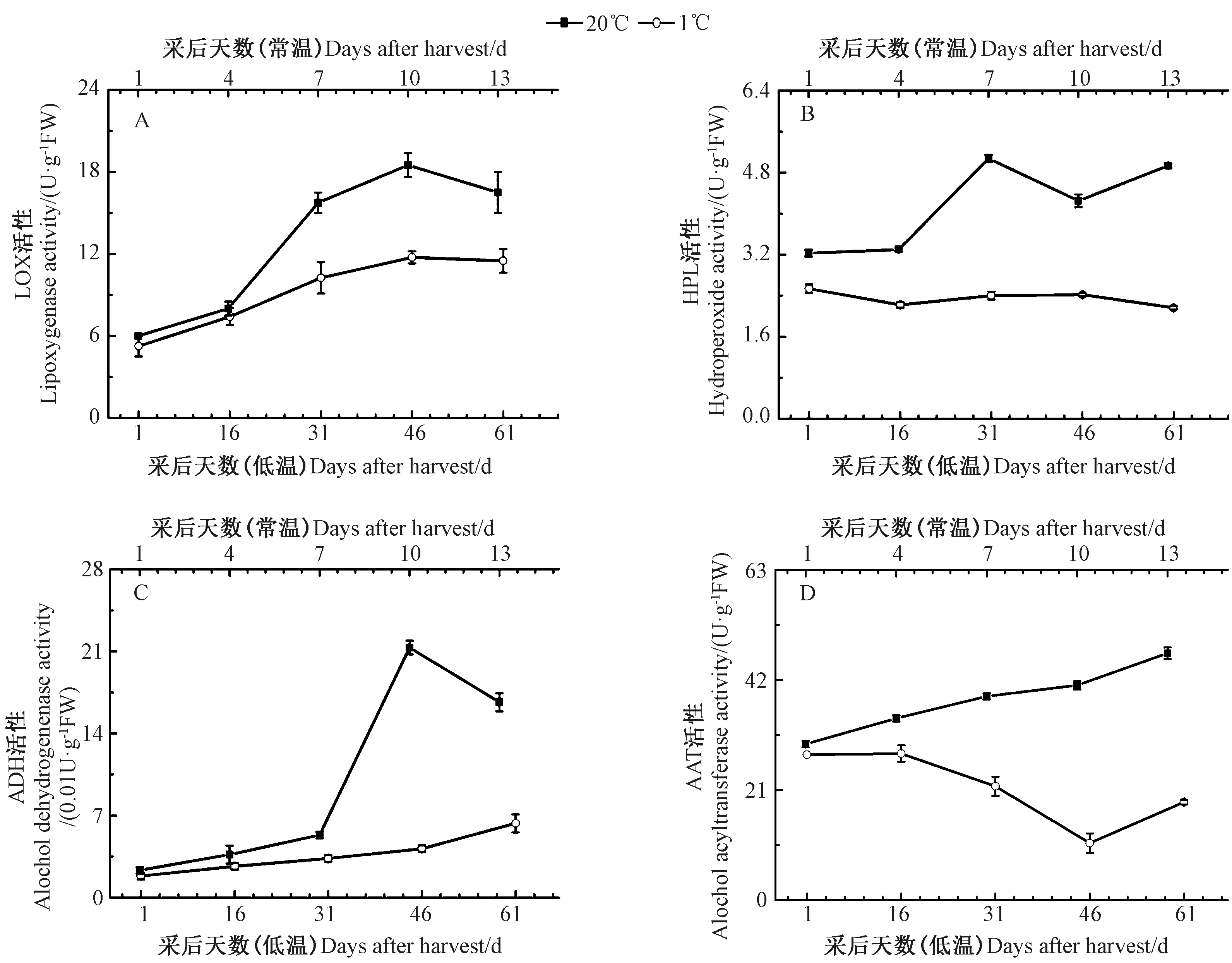
图4 常温和低温贮藏下果实LOX、HPL、ADH 和AAT 活性的变化Fig.4 Changes in activities of LOX,HPL,ADH,and AAT in kiwifruit during storage at room or lower temperature
由图5-B 可知,果实HPL相对表达量同样在常温贮藏期间急剧增加;而低温贮藏期间前16 d 保持稳定,而后呈波动增加趋势。果实低温贮藏虽减缓了HPL表达量的增加速度,但随着贮藏时间的延长,HPL相对表达量最终与常温贮藏水平相当。说明低温贮藏可延缓HPL表达速度。
由图5-C 可知,果实ADH相对表达量在常温贮藏期间先急剧增加,至贮藏10 d 时达到峰值,而后降低;低温贮藏前46 d 果实ADH保持相对稳定的表达水平,而后增加。虽然低温对猕猴桃果实ADH表达有抑制作用,但其相对表达量在2 种贮藏方式后期的水平相当。
由图5-D 可知,果实AAT1 相对表达量在常温贮藏期间急剧增加;低温贮藏期间其活性值不断增加至31 d 后降低,并在46 d 后再急剧增加。常温和低温贮藏下AAT1 的相对表达量存在差异,低温抑制了AAT1在贮藏中期的表达,后期抑制作用降低。

图5 常温和低温贮藏下果实LOX、HPL、ADH、AAT1 和AAT17 相对表达量的变化Fig.5 Changes in relative expressive level of LOX, HPL, ADH, AAT1,and AAT17 in kiwifruit during storage at room or lower temperature
由图5-E 可知,果实AAT17 相对表达量在常温贮藏期间先急剧增加至贮藏10 d 达到峰值,而后急剧下降;低温贮藏前16 d 略有下降,而后不断增加,贮藏46 d 时达到高峰,随后下降。与常温贮藏相比,低温贮藏后期其相对表达量也同样达到了相当水平。
3 讨论
挥发性物质的构成种类和含量是影响果实香味的关键因素。挥发性物质属于次级代谢产物,主要包括酯类、醛类、醇类、酸类和萜类等物质,但果实成熟过程中的挥发性风味物质主要是酯类[19-21]。不同的采后保鲜处理、贮藏条件和贮藏时间常常导致果实成熟过程中挥发性风味物质的种类和含量产生变化[22-24],尤其是低温贮藏影响果实成熟过程中挥发性风味物质的合成及转化[7-8,24]。王贵章等[25]研究表明低温贮藏抑制桃果实中19 种挥发性物质的合成。郭丽芳等[26]研究发现金艳猕猴桃在冷藏下风味物质的变化主要表现为抑制酯类及烯类物质的产生。本研究表明,在常温和低温贮藏下,布鲁诺猕猴桃果实的挥发性风味物质均包括酯类、醛类、酮类、醇类、酸类和烷烃类;其中,常温下随着贮藏时间延长,猕猴桃果实的酯类持续增加,醛酮类物质在后期大幅度降低;但与常温贮藏相比,低温贮藏降低了猕猴桃果实中酯类物质的种类和相对含量,并保持较高醛酮类物质种类和相对含量。另外,分析OAV 发现,常温下猕猴桃果实的特征风味物质是2-己烯醛、己醛、2 -己烯醇、丁酸乙酯、己酸乙酯、乙酸乙酯、丁酸甲酯和丁酸丁酯等,而在低温贮藏下仅有2-己烯醛、己醛和2 -己烯醇等3 种特征风味物质。说明美味猕猴桃布鲁诺采后果实可能主要通过脂肪酸代谢途径合成主要挥发性物质,而低温抑制了采后果实的脂肪酸代谢活性,从而抑制了醛酮类物质向酯类物质的进一步转化。
果实风味物质中的直链脂肪族醇、醛、酮和酯类物质主要来源于脂肪酸氧化[27]。LOX 催化亚油酸和亚麻酸等不饱和脂肪酸发生过氧化而形成过氧羟基脂肪酸,然后HPL 将其裂解形成醛类或烯醛类化合物;醛类化合物经ADH 催化形成相应的醇类,AAT 提供酰基可将这些醇类转化形成相应的酯类化合物[28]。研究表明LOX、HPL、ADH 和AAT 是薄皮甜瓜[29]、梨[30-31]、杏[32]、菠萝蜜[33]、番茄[34]等果实主要挥发性物质合成的关键酶,LOX 代谢途径是采后果实挥发性化合物形成的主要来源。本研究表明,常温下猕猴桃布鲁诺果实LOX、HPL、ADH 和AAT 活性及其基因的表达量大体随果实成熟进程而快速增加,并伴随酯类挥发性成分含量的急剧增加,醛酮类挥发性成分的急剧降低;但低温不仅降低了猕猴桃布鲁诺果实LOX 代谢前体物质亚油酸和亚麻酸的分解,而且抑制了LOX、HPL、ADH 和AAT 等代谢相关酶活性及其基因表达量,使果实在低温贮藏期间酯类含量保持在较低的水平,醛酮类含量维持在相对稳定的高水平状态。说明LOX 代谢途径在美味猕猴桃布鲁诺果实采后主要挥发性物质合成中发挥重要作用。然而,低温贮藏对猕猴桃果实货架期风味物质的影响,特别是果实低温贮藏后在常温货架期间能否达到与常温贮藏下相同的风味品质还有待进一步研究。
4 结论
低温贮藏影响美味猕猴桃布鲁诺果实风味物质的种类和含量,主要通过调控脂肪酸代谢的LOX 代谢途径相关酶及其基因的相对表达量来控制酯类、醛酮类物质的合成与分解;特别是抑制LOX 代谢途径中的ADH 和AAT 活性及其基因的表达,从而使果实在低温贮藏期间酯类挥发性物质含量保持很低的水平,醛酮类物质含量维持在相对稳定的高水平;当果实在低温贮藏61 d 后,其醛酮类物质含量为常温贮藏13 d(果实完全成熟)的3 倍以上。因此,低温贮藏抑制美味猕猴桃布鲁诺果实的脂肪酸代谢活性,使果实的脂类物质含量低,醛酮类物质含量高,从而较好维持了果实的特征风味。
