miR-29a在酉州乌羊不同体组织中表达特征及其在B16细胞中的动态表达分析
2020-03-11陈灿灿孙晓燕王高富周马友记任航行
陈灿灿 李 杰 付 琳 孙晓燕 王高富周 鹏 马友记 任航行
(1甘肃农业大学动物科学技术学院,甘肃 兰州 730070;2重庆市畜牧科学院,重庆 402460)
酉州乌羊(Capra hircus)是重庆特有的山羊品种,该羊全身被毛为白色,皮肤、嘴、眼、鼻、阴门和肛门等处的可视黏膜均为乌色,这种表型是一类罕见的纤维色素增生(fibromelanosis)现象,此前仅在家禽中出现过。此外,酉州乌羊的肉滋补作用极高,是食药兼用的优良品种,也被称为“药羊”,且可作为医学研究模型[1]。因此,对酉州乌羊这种珍稀品种资源进行研究具有重要的意义[2]。
miRNA 是一类长度约为18 ~22 个核苷酸具有调控功能的内源性单链非编码小分子RNA,具有高度保守性、时序性和组织特异性[3]。miRNA 通过完全或不完全的碱基互补配对结合靶基因的3′-UTR 抑制靶基因的表达,进而影响细胞的分化、增殖、凋亡和转移等[4-5]。大量研究表明,在毛色形成过程中参与毛色形成的基因较多,其中起重要作用的基因主要有黑素皮质素受体1(melanocortin 1 receptor,MC1R)[6]、小眼畸形相关转录因子(microphthalmia associated transcription factor,MITF)[7]、酪氨酸酶(tyrosinase,TYR)家 族[8]、α-促黑素细胞激素(melanocyte stimulating hormone α,α-MSH)[9]、Agouti 信号蛋白(agouti signaling protein,Asip)[10]等,且miRNA 可能调控这些基因的表达,进而参与黑色素的合成,如miR-146 抑制色素合成基因TYRP1 的表达[11]、miR-137 抑制CKT/TYRP2 的表达[12]、miR-324-3p 和miRNA-338-3P 抑制MC1R的表达等[13-14]。通过targetscan等软件预测发现miR-29a-5p 与鼠灰色基因(agouti singaling protein,Asip)存在靶向调控关系。而Asip 又是经典的生黑色素通路(KEGG:melanogenesis)中最上游的一个关键负调控因子,但Asip在不同被毛颜色的山羊组织可能存在不同的调控机制[6,15]。Asip和α-MSH基因竞争性地与黑色素细胞膜上的MC1R基因结合,引起黑色素细胞内真黑色素、褐黑色素的比例发生变化。α-促黑素细胞激素与MC1R 结合后,毛囊黑素细胞产生真黑色素(黑色/棕色),这种激素与黑色素细胞膜的结合如果被Agouti基因座编码的Agouti 信号蛋白(Asip)阻断,则生成褐黑色素[16]。此外,miR-29a 在各种肿瘤细胞中高表达,具有显著的促增殖、抗凋亡的作用,推测miR-29a 很可能通过调控黑色素细胞的行为学影响山羊皮肤黑色素的合成[17-18]。本研究分析酉州乌羊miR-29a 的组织表达谱及其在成熟的商品化B16 细胞增殖与分化过程中的动态表达规律,以期为明确miR-29a 在酉州乌羊各组织中的表达特性及其是否参与黑色素细胞行为学的调控提供理论证据。
1 材料与方法
1.1 材料
12 月龄左右酉州乌羊的各种体组织和渝东白山羊的皮肤均来自于酉阳县酉州乌羊国家级保种场,每组3 个生物学重复。组织采集参考赵亚运等[19]的方法,采集后用焦碳酸二乙酯(diethypyrocarbonate,DEPC)水清洗,置于冻存管中,然后迅速投入液氮中,于-80℃保存备用。
B16 细胞由重庆市山羊工程技术研究中心保存。TRIzol Reagent 购自美国invitrogen 公司;miRcute Plus miRNA Fast-Strand cDNA Kit 与miRcute Plus miRNA qPCR Kit 购自北京TIANGEN 公司;DMEM 和RPMI 1640 培养基购自北京gibco 公司;胎牛血清(fetal bovine serum,FBS)、马血清(horse serum,HS)和青链霉素购自新西兰HyClone 公司;其他化学试剂均为国产分析纯。
1.2 引物设计与合成
根据miRBase 中已经公布的羊源miR-29a(MIMAT0014967)的相关序列,进行引物设计,以U6为内参,然后用NCBI 中的BLAST 检测引物特异性,引物由上海生工生物工程技术服务有限公司合成。Reverse Primer 为反转录试剂盒自带通用引物。设计的引物序列信息详见表1。
1.3 B16 细胞增殖及分化培养
用含10%FBS 的RPMI1640 培养基复苏B16 细胞,使用完全培养基重悬细胞,并按照1.0×105个·mL-1铺板六孔板中,每个板设3 个重复。置于5%CO2、37℃培养箱中培养。隔天换1 次培养基。观察细胞的生长状况并拍照,取一板细胞用于提取RNA。使用含10%FBS 的RPMI1640 培养基培养细胞,待细胞长至70%~90%,吸弃增殖培养基。用含2%双抗的磷酸盐缓冲液清洗2~3 次,加入分化培养基,培养基成分为DMEM+2%HS+2%双抗。分化第4 天以后,每天更换培养基。用Olympus IX73 荧光倒置显微镜(Olympus,日本)观察细胞并拍照,每个样品随机拍3 个视野,比例尺为200~500 μm。
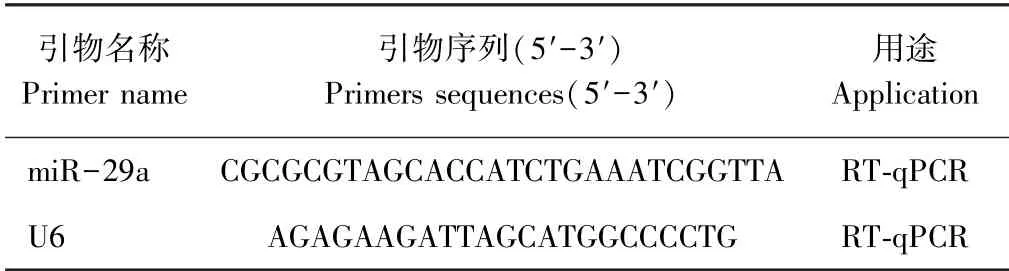
表1 引物序列Table 1 Primer sequence
1.4 RNA 的提取与反转录
用液氮快速研磨组织后,按照TRIzol Reagent提取试剂盒(Inritorgen 公司,美国)的操作说明书提取各组织和细胞总RNA。提取细胞RNA 时,吸弃培养基后,用预冷磷酸盐缓冲液清洗2 ~3 次,加入TRIzol 提取RNA。使用D2000 超微量分光光度计(ThermoFisher,美国)检测总RNA 的浓度与纯度,OD 值均在1.8 ~2.0 之间。用2%琼脂糖凝胶电泳检测其完整性,选择完整性良好的RNA,将其按照miRcute Plus miRNA First-Strand cDNA 合成试剂盒操作说明,反转录成cDNA,-20℃保存备用。按照体系:cDNA 1 μL、内参引物各为0.4 μL、mix 酶5 μL、RNase ddH2O 3.2 μL,进行常规PCR 扩增,并检测反转录结果。
1.5 实时荧光定量PCR
按照miRcute Plus miRNA qPCR Kit 建议的体系,在相同条件下,对退火温度55~65℃进行优化,细胞和组织均以U6 为内参进行PCR 扩增。反应体系为20 μL:2×mircute plus mirna premix 10 μL,上、下游引物各0.4 μL,cDNA 2 μL,RNase ddH2O 7.2 μL。反应程序:95℃预变性15 min;94℃变性20 s,60℃退火34 s,共40 个循环;溶解曲线分析程序:95℃变性15 s,60℃退火1 min,荧光信号采集时间为5 s。根据荧光定量所得的Ct 值,采用2-△△Ct法计算基因相对表达量。
1.6 数据统计
采用SPSS 22 软件进行单因素方差分析并检验其显著性,结果以平均值±标准误(SE)表示。P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 酉州乌羊不同组织中miR-29a 的表达特性
2.1.1 miR-29a 的组织表达谱 由图1 可知,miR-29a 在酉州乌羊不同组织中均有不同程度的表达,且相对表达量存在差异,其中在大脑中的相对表达量最高,腿肌和心脏次之,在肺和皮肤中表达量最低。
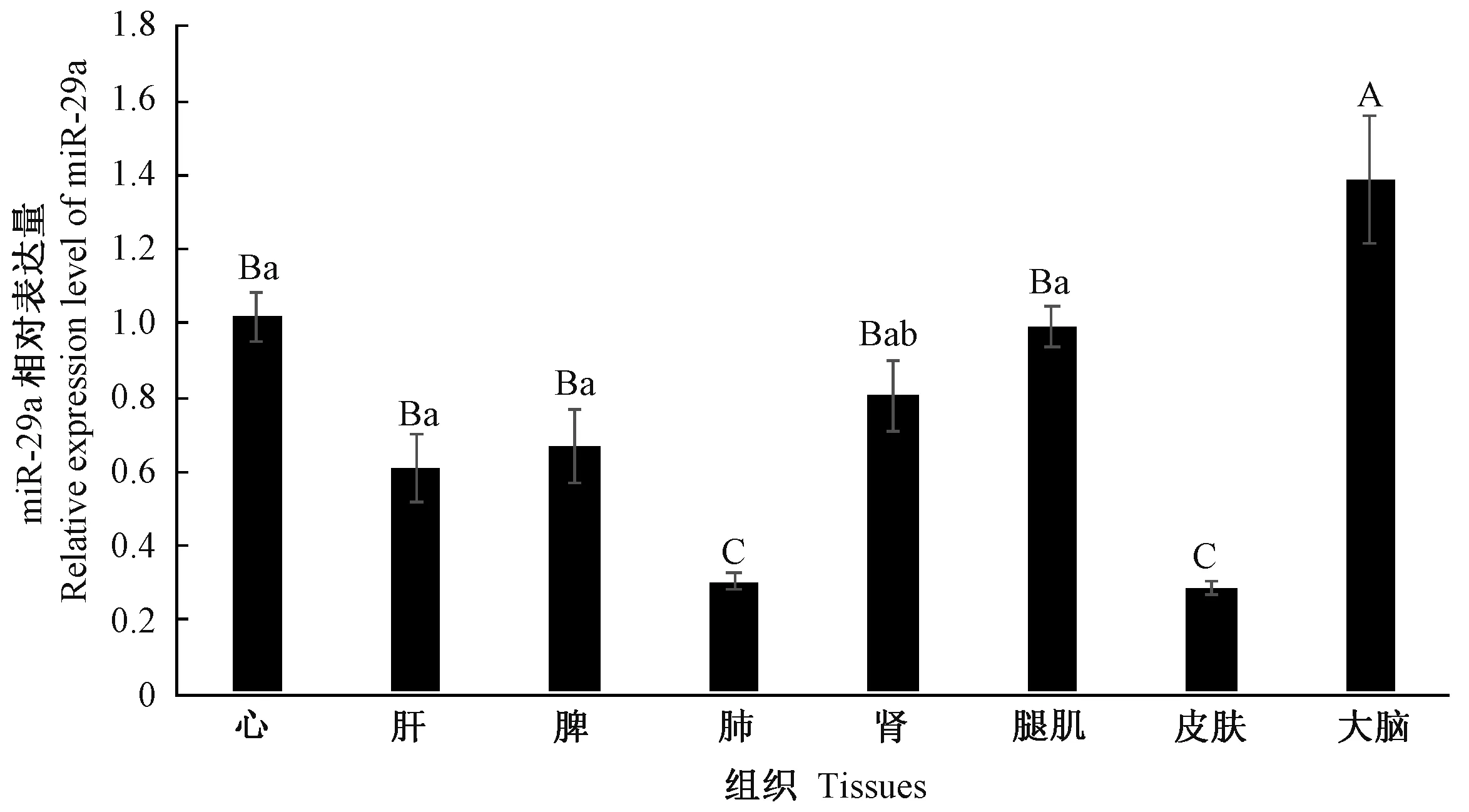
图1 miR-29a 在酉州乌羊不同组织中的表达分析Fig.1 Expression analysis of miR-29a in different tissues of Youzhou dark goats
2.1.2 miR-29a 在酉州乌羊与渝东白羊皮肤组织中的表达 由图2 可知,miR-29a 在不同肤色羊皮肤组织中均有表达,但在渝东白山羊皮肤中miR-29a 的相对表达量极显著高于酉州乌羊(P<0.01),渝东羊皮肤中miR-29a 的相对表达量是乌羊皮肤的3.44 倍,与前期测序结果一致[20]。表明miR-29a 可能与皮肤黑色素沉积有关。
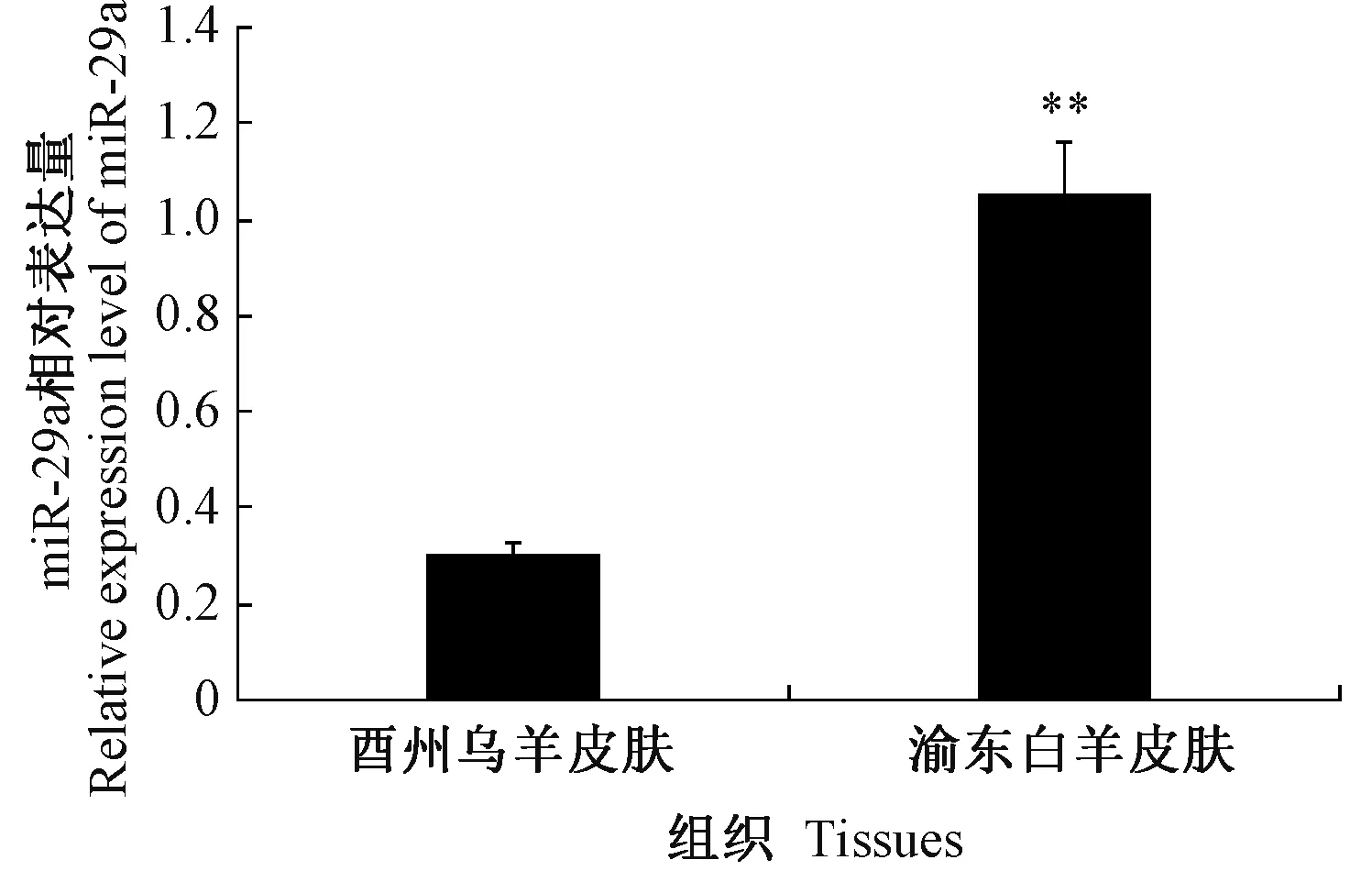
图2 miR-29a 在酉州乌羊与渝白羊皮肤组织中的相对表达量Fig.2 Relative expression of miR-29a in skin tissues of Youzhou dark goats and Yudong white goats
2.2 miR-29a 在B16 细胞增殖阶段的动态表达
B16 细胞在增殖介质中培养2、4、6 和8 d 时,RTqPCR 检测发现,miR-29a 在各时间点均有表达,且其相对表达量随着培养时间的延长呈升高趋势(图3)。显微镜下形态学观察发现,在第0 天时B16 细胞数量较少,细胞结构清晰;第4 天细胞基本铺满整个六孔板底部,细胞结构模糊,几乎分辩不出单个细胞;到第8天时,细胞成云海状(图4)。以上结果表明,miR-29a的递增表达可能促进了B16 细胞的增殖。
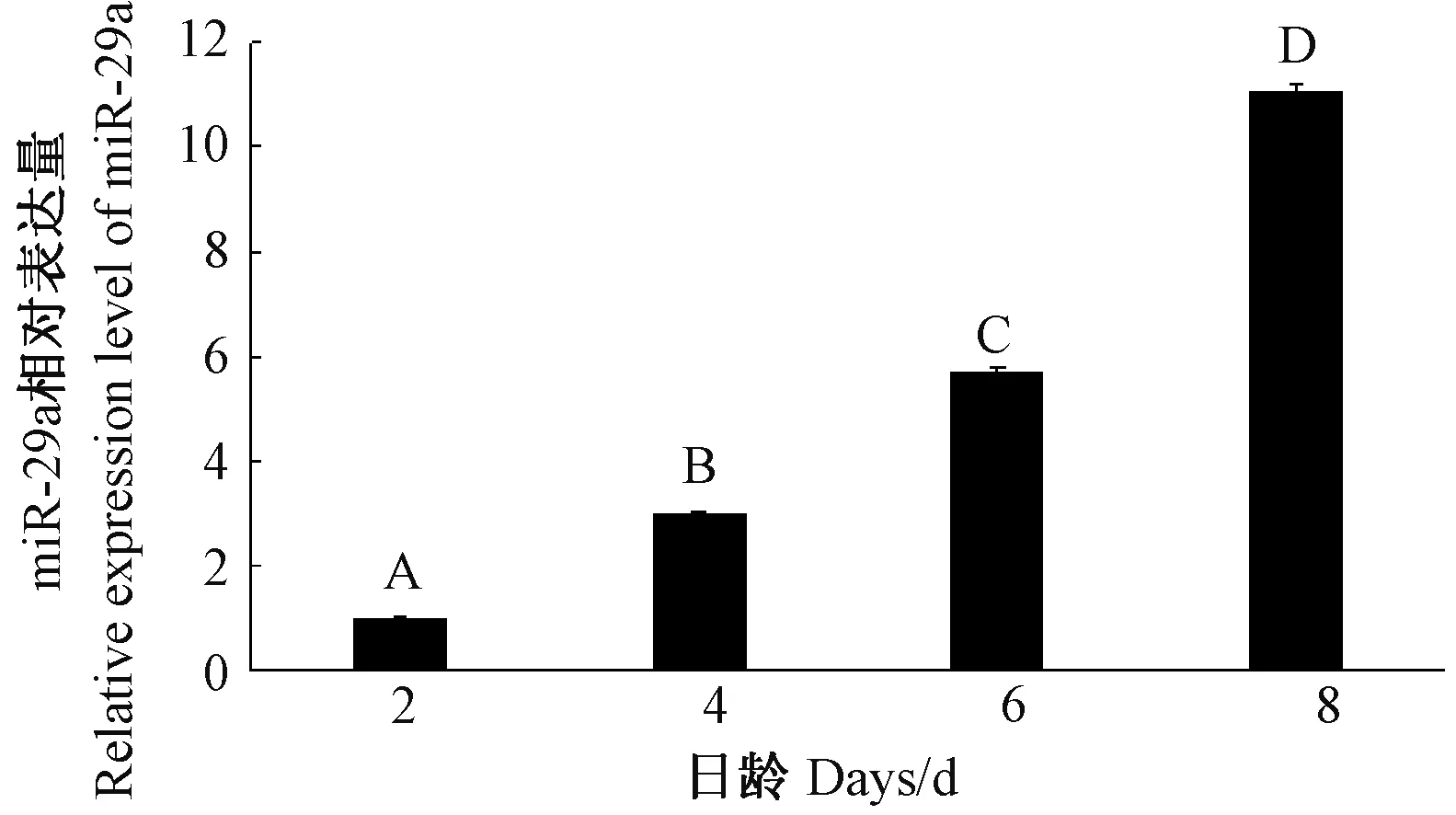
图3 miR-29a 在B16 细胞增殖阶段的相对表达量Fig.3 Relative expression of miR-29a in the proliferation phase of B16 cells
2.3 miR-29a 在B16 细胞分化阶段的动态表达
将B16 细胞在分化介质中培养8 d,通过RTqPCR 分别检测细胞分化第2、第4、第6、第8 天时miR-29a 的相对表达量(U6 为内参),结果表明,在分化第4、第6、第8 天的B16 黑色素细胞中miR-29a 相对表达量差异不显著(P>0.05),但都极显著低于分化第2天的相对表达量(P<0.01,图5)。形态学观察发现,加入分化培养基后,第2 天B16 黑色素细胞数目仍持续增加,第4、第6、第8 天细胞数量稳定,细胞核周围出现大量黑色素体,黑色素分泌量增加,相较于增殖阶段细胞突触增多且变长,细胞间通过突触相互交联。上述结果表明,miR-29a 的低表达可能有助于黑色素细胞的分化和黑色素生成(图6)。

图4 B16 黑色素细胞不同日龄的增殖结果Fig.4 Proliferation results of B16 cells at different day ages
3 讨论
miR-29a 参与了多种肿瘤的发生[21-22],但目前miR-29a 在皮肤黑色素沉积方面的研究尚鲜见报道。本研究通过RT-qPCR 检测酉州乌羊不同组织中的miR-29a 表达,结果显示,miR-29a 在酉州乌羊不同体组织中广泛表达,表明miR-29a 无组织特异性,这与王健等[23]在湖羊上研究结果基本一致。但miR-29a在酉州羊大脑中的相对表达量显著高于其他组织,一方面,可能是由于miR-29a 能够通过靶向作用于PTEN基因促进神经元分化并减少神经干细胞的星形胶质细胞分化[24];另一方面,在神经胶质瘤细胞中,随着胶质瘤恶性级别的升高,miR-29a 表达量降低[25-26]。因此在酉州乌羊健康脑组织中miR-29a 呈高表达,可能会抑制肿瘤的发生[27]。此外,本研究还观察到miR-29a 在酉州乌羊皮肤与肺中的相对表达量低于其他组织,但是渝东白羊皮肤miR-29a 相对表达量是酉州乌羊皮肤的3.44 倍,推测miR-29a 可能与皮肤黑色素沉积有关。
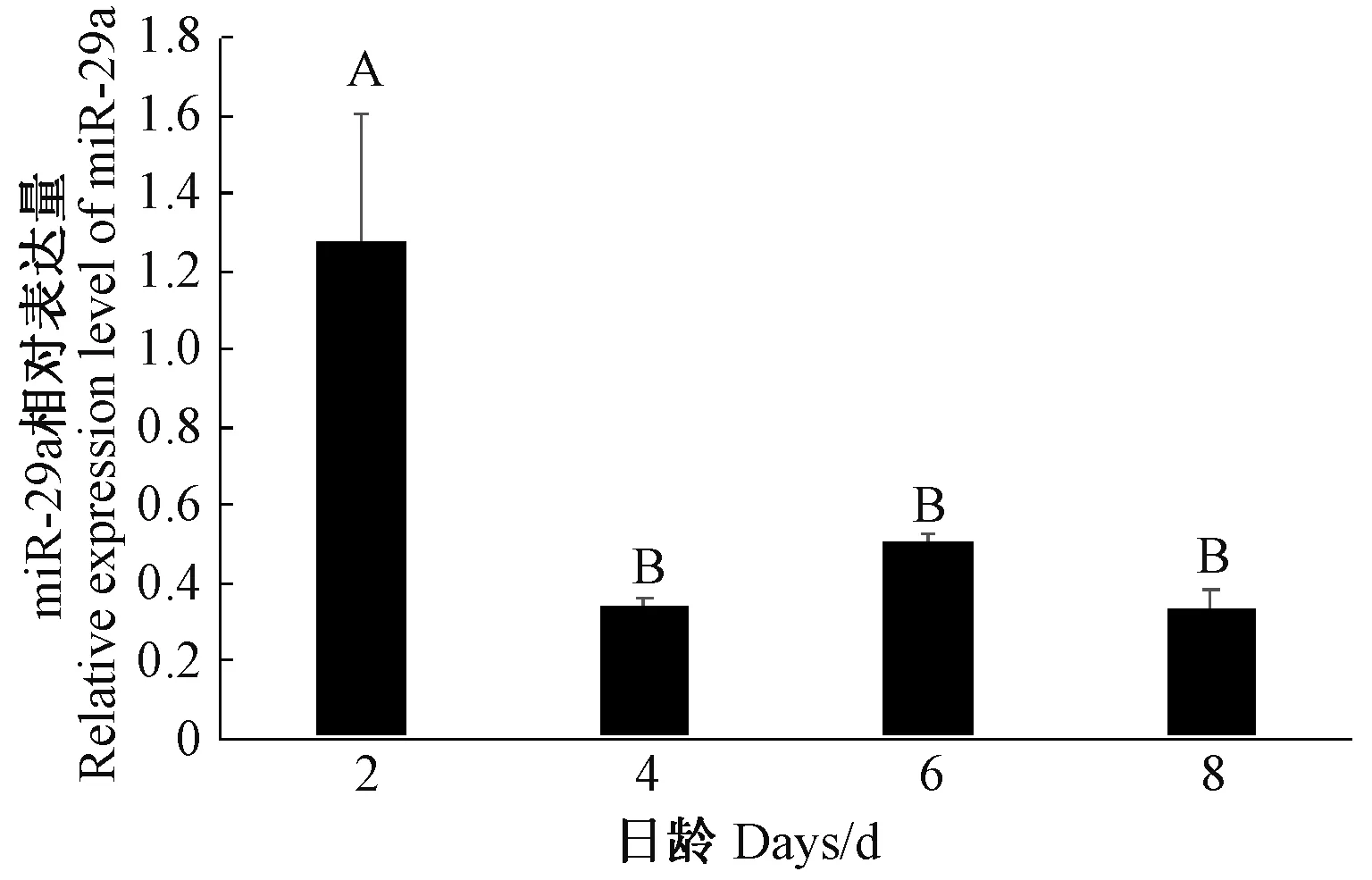
图5 miR-29a 在B16 细胞分化阶段的相对表达量Fig.5 Relative expression of the miR-29a in differentiation stage of B16 cells

图6 B16 细胞不同日龄分化结果Fig.6 Differentiation results of B16 cells at different day ages
大量研究表明,在癌症组织中miR-29 均下调表达[28-29],然而在神经干细胞分化过程中miR-29a 表达水平上调[24]。本研究体外试验发现,在增殖条件下,B16 细胞中miR-29a 的相对表达量随着培养时间的延长呈升高趋势,且各时间点表达差异明显,暗示miR-29a 可能与黑色素细胞的增殖密切相关。在B16 细胞分化阶段,miR-29a 相对表达量整体呈降低趋势,即第4、第6、第8 天的细胞中miR-29a 相对表达量都极显著低于分化第2 天,说明miR-29a 的低表达可能有助于B16 细胞分化及黑色素的生成。陈金妹等[30]研究表明,B16 细胞在RPMI-1640 培养基中的活力和分裂增殖能力较强,细胞产生黑色素能力较弱,与本研究结果基本一致。本研究在B16 细胞增殖阶段选择使用RPMI1640 培养基,形态学观察发现,细胞在第2 天开始出现树突,但突触较短小,第8 天有少量黑色素分泌,这可能是不同厂家或者不同批次的培养基成分略有差异造成的。推测miR-29a 可能通过调节ASIP 的表达来调控黑色素细胞的增殖、分化过程,进而导致酉州乌羊和渝东白羊2 个品种山羊皮肤黑色素沉积存在差异。但要获得miR-29a 参与黑色素细胞行为学调控的直接证据,还需要通过建立miR-29a 的过表达载体并转染黑色素细胞进行进一步的验证。
4 结论
本研究体内试验结果表明,miR-29a 在酉州乌羊体内各组织广泛表达,其中在肺和皮肤中的相对表达量最低,在大脑中相对表达量最高;渝东白羊皮肤中miR-29a 相对表达量是酉州乌羊的3.44 倍。体外试验研究发现,miR-29a 的相对表达量随着B16 细胞的增殖而升高,但随着B16 细胞的分化而降低,推测miR-29a 与B16 细胞的增殖与分化密切相关。本研究为miR-29a 参与黑色细胞行为学的调控提供了一定的理论依据。下一步可通过构建miR-29a 慢病毒载体并转染B16 细胞,探究miR-29a 对B16 细胞行为学变化的影响。
