曲克芦丁脂质体的制备及体外释放度研究
2020-03-10周永芳李林松杨硕晔
周永芳,李林松,李 锟*,杨硕晔
(1.黄河科技学院,河南 郑州 450063;2.河南工业大学 生物工程学院,河南 郑州 450001)
曲克芦丁(又称维生素P4)可抑制血小板凝聚,防止血栓形成,改善血液循环,增加毛细血管抵抗力,治疗急性缺血性脑损伤,使人体血管的一些病变得到改善;其还具有抗氧化功能,修复5-羟色胺、缓激肽等物质引起的血管损伤;曲克芦丁脑蛋白水解物注射液能有效治疗糖尿病脑梗死,提高糖尿病脑梗死的治愈率,降低其病死率[1]。
目前,曲克芦丁有多种剂型如胶囊剂、口腔崩解片、注射剂、片剂、散剂和颗粒剂等。曲克芦丁的水溶性和脂溶性均不好[2],口服及注射曲克芦丁制剂后,吸收不良,生物利用度低[3]。另外,注射剂因注射疼痛,患者依从性低,用药不便。脂质体作为药物载体,既可以包封水溶性物质又可以包封脂溶性物质,可增强其水溶性和稳定性,改变药物在体内的分布情况,还可以改良药物的吸收,提高药物的稳定性,提高生物利用度,延长药物作用时间[4]。
1 材料
1.1 仪器
TGL-16G台式离心机(上海安亭科学仪器厂);RE-52A旋转蒸发仪(上海亚荣生化仪器厂);T6紫外可见分光光度计(北京普析通用仪器有限责任公司);Agilent LC 1260液相色谱仪(日本安捷伦科技有限公司);G1322A标准真空脱气机;G1312C二元泵;G1316A标准柱温箱;G1314B可变波长检测器;FD-1-50真空冷冻干燥机(北京博医康实验仪器有限公司)。
1.2 药品与试剂
曲克芦丁(大连美仑生物技术有限公司);乙腈(分析纯,西陇科学股份有限公司);10 mg/mL鱼精蛋白(注射液,上海第一生化药业有限公司);豆磷脂95、98(注射用,上海太伟药业有限公司);胆固醇(美国Avanti公司)。
2 方法与结果
2.1 曲克芦丁脂质体的制备
分别称取大豆磷脂、胆固醇、曲克芦丁于圆底烧瓶中,加入10 mL甲醇,旋涡混合仪震荡5 min,超声 30 min,再加入8 mL的水进行超声2 h,待液相不分离的时候进行旋转蒸发,压力控制0.05 MPa,水浴温度30 ℃,20 min后取出,放入超声仪中使其分散均匀即得曲克芦丁脂质体[5]。
2.2 曲克芦丁脂质体包封率的测定
2.2.1 色谱条件
流动相∶V(甲醇)∶V(水)=6∶4,检测波长:350 nm,流速:1 mL/min,柱温:25 ℃。
2.2.2 准确度实验
取曲克芦丁标液(1000 μg/mL)10 μL,进样三次,求平均值;将曲克芦丁标液稀释10倍(100 μg/mL),进样三次,求平均值。根据 计算准确度为113.8%,说明高效液相色谱的测量结果可靠性较高,数值可信。
2.2.3 回收率实验
取标液100 μL(1000 μg/mg),加入900 μL甲醇,得到1000 μL对照溶液,摇匀,测定。分别取标液80 μL、100 μL、120 μL,再分别加入120 μL、100 μL、80 μL鱼精蛋白稀释液,最后再加800 μL甲醇,得到1000 μL溶液,摇匀,测定。计算得80%样品、100%样品、120%样品的回收率分别是100.4%、98.5%、102.4%,说明方法的回收率较好。
2.2.4 包封率的测定
采用HPLC法测定曲克芦丁[6]:取脂质体样品100 μL,然后加入4 mL甲醇破乳,涡旋后测定。取两只离心管,每只离心管中分别加入100 μL脂质体溶液,再加入100 μL鱼精蛋白,静置5 min。然后加入4 mL去离子水,12000 r/min离心10 min,将上清液全部直接进样测定,根据公式和测定数值计算包封率为14.28%。
2.2.5 冷冻干燥对脂质体包封率的影响
将放置一段时间的样品从冰箱(4 ℃)中取出,发现溶液中有固体颗粒物析出,使用涡旋混合器和超声波清洗机对样品进行分散。较长时间后观察样品,发现固体颗粒仍然不能完全溶解,继续用超声波细胞破碎仪来达到目的[7]。把样品放入冰浴中,使用细胞破碎仪进行破碎,完成后观察样品呈均匀溶液。将样品倒进小烧杯(50 mL)中,然后放入冻干机进行冻干,分别测定冻干前后脂质体的包封率,结果如图1所示。

图1 冷冻干燥前后包封率的变化
从图1可以看出冷冻干燥对处方11、处方13、处方14、处方16的包封率影响并不大。而处方15、处方17包封率变化较大,这可能与冻干后复溶时的操作不准确有关。
2.3 曲克芦丁脂质体体外释放度研究
2.3.1 测定方法
取100 mL的释放介质放于200 mL的烧杯中,取2 mL脂质体置于透析袋中,并将两端用细线封口,并置于以上所述的100 mL释放介质中,当温度达到37℃时开始启动摇床,摇床转动速度为85 r/min。分别在0,10,30,70 min及2,4,6,8,12 h时刻取样,每次取样2 mL,并及时补充2 mL释放介质,将取出的样品收集起来,之后测定其含量。
HPLC法测定不同时间点释放介质中药物的含量。同时取适量的脂质体,用甲醇破乳,测定总药量W,并根据下面公式计算其释放百分率[8]。
Qn=CnVo+∑CiVi(i=0~n-1) 释放百分率(%)=Q/W 100%
2.3.2 释放介质考察
取某一处方脂质体,分别以去离子水,PBS和生理盐水为释放介质,转速为85 r/min,按照上述方法溶出后,测定其释放度(表1),考察其体外释药的情况(图2)。

表1 不同释放介质的释放度
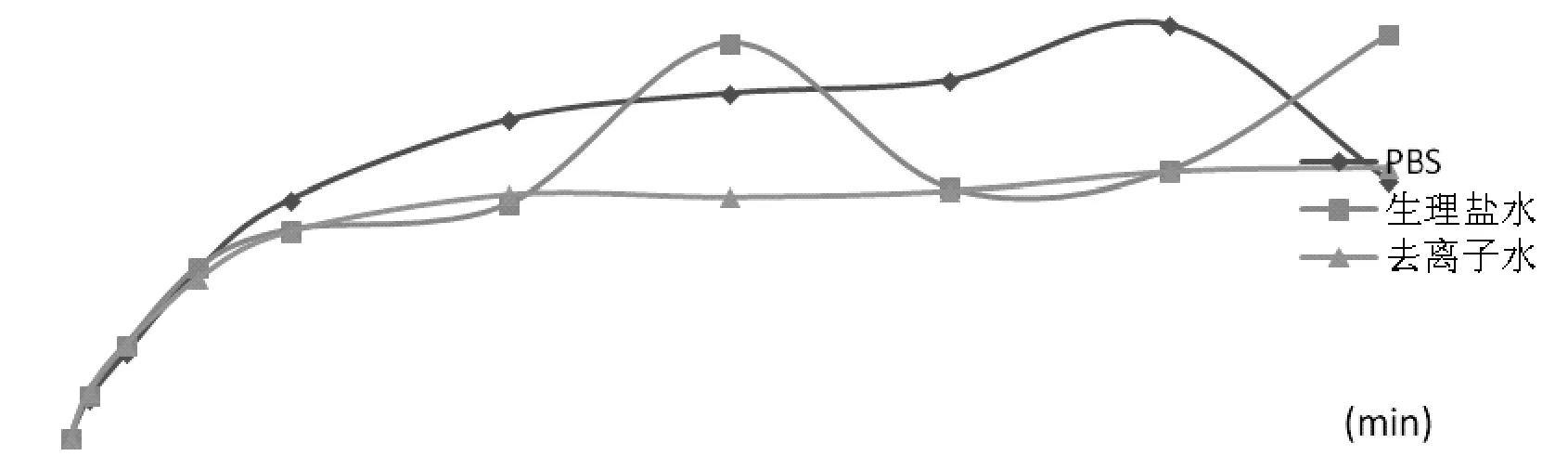
图2 不同释放介质释放度趋势图
由表1和图2可知,以PBS和生理盐水为释放介质时对释放度的影响均大于去离子水,虽然PBS和生理盐水的释放度相对较大,去离子水的释放度相对较小,但是它们做释放介质时释放度不够稳定,而去离子水是相对稳定的。因此选择去离子水作为释放介质。
2.3.3 不同处方的释放度比
在37℃的条件下,以去离子水为释放介质,转速85 r/min,分别测定处方3,处方6和处方9的释放度,并比较其释放度的差别[9](表2)。

表2 不同处方释放度
由表2可知,处方9的第5组数据有明显的波动性,数据不合理,而处方3和处方6均没有出现这种波动,而且从整体数据来看,药物没有突释现象,所以将这组数据舍去,建立一个新表格。而处方3的第一组数据不合理,是因为实验时的不可控因素造成,且数据可以接受,所以不将其舍去(表3,图3)。

表3 不同处方释放度
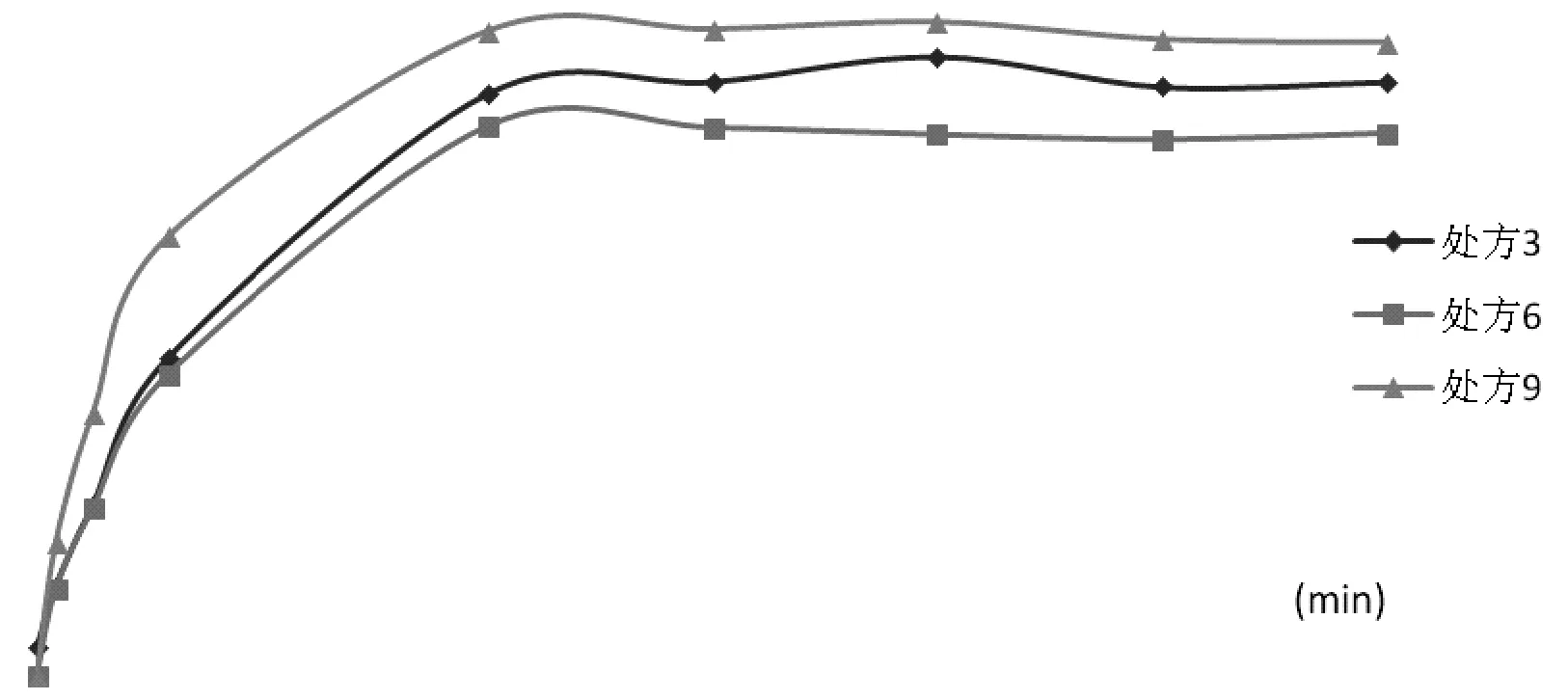
图3 不同处方释放度趋势图
由图3可知,三个处方释放度曲线趋势大致相同,而且相差较小,而且每个处方的释放度都能达到74%之上,可见每个处方脂质体包载的药物均能得到较好的释放。
2.3.4 数学模型拟合
分别以零级动力学,一级动力学和Higuchi方程,Ritger-Peppas方程,Webull方程对曲克芦丁脂质体的积累释放曲线进行方程拟合得拟合方程如表4所示[10]。
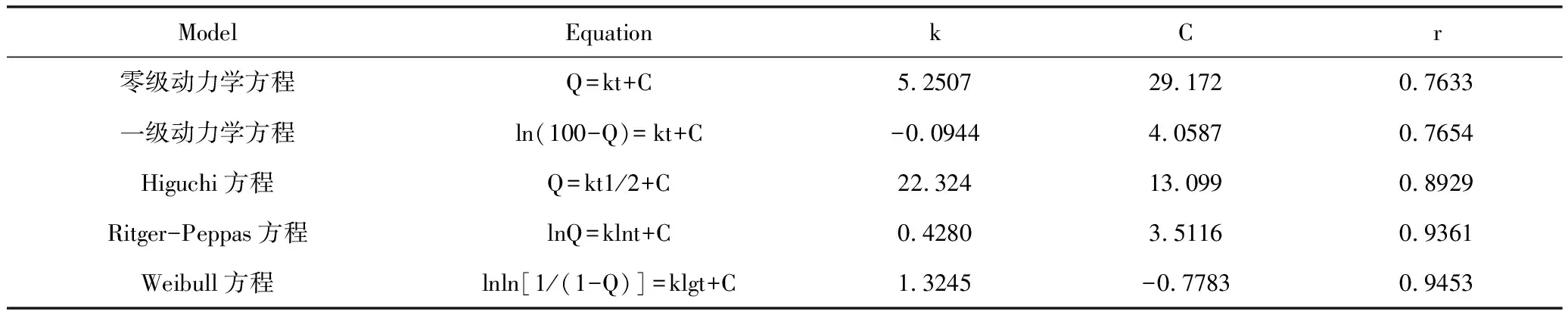
表4 处方拟合曲线
拟合结果表明的体外释放最优拟合均为Weibull模型。
3 结论
本研究建立的鱼精蛋白凝集法在测定曲克芦丁脂质体包封率时准确、有效、快速,可快速分离游离药物和脂质体,从而能够准确测定并计算得到曲克芦丁脂质体的包封率[11]。采用冷冻干燥技术可将曲克芦丁脂质体制成冻干样品, 根据数据,冷冻干燥对样品的药物含量影响较小,同样对样品的包封率也没有明显的影响。
通过对建立释放度测定的方法学,我们可以得出该方法专属性强,药物性质稳定,线性关系在一定浓度下良好,回收率高,精密度和准确度均良好。采用摇床释放药物的方法,选出三个处方对曲克芦丁脂质体进行体外释放度的研究[12]。采用的液相条件是:甲醇∶水=60∶40,检测波长:350 nm,流动速度:1.0 mL/min,柱温:25 ℃,进样量:10 μL。对三个处方分别进行了零级动力学方程,一级动力学方程,Higuchi方程,Ritger-Peppas方程,Weibull拟合,拟合结果表明曲克芦丁脂质体的体外释放最优拟合均为Weibull模型。
实验说明,将曲克芦丁制备成脂质体,并不会影响曲克芦丁药效的发挥,且辅料不会对曲克芦丁脂质体产生较大影响。曲克芦丁脂质体还会增强药物的稳定性,脂质体可以选择性的释放药物,使药物的作用靶向性增强,更有利于药物的吸收和利用。而且脂质体的载体材料和细胞膜组成相似,对人体没有免疫反应和毒害作用[13]。因此将曲克芦丁制成脂质体对其发挥药效具有很大的促进作用。但同时本实验也有不足之处,脂质体的稳定性有待进一步提高。
