偃松松塔多糖的单糖组成分析及活性研究
2020-03-09李子江司传领
李子江, 刘 慰, 吴 磊, 王 丹, 司传领*
(1.天津科技大学 天津市制浆造纸重点实验室,天津 300457; 2.山东商业职业技术学院,山东济南 250103; 3.江西省科学院应用化学研究所,江西 南昌 330096; 4.中国林业科学研究院林产化学工业研究所;江苏省生物质能源与材料重点实验室,江苏 南京 210042)
偃松(Pinuspumila(Pall.) Regel),又称日本石松、西伯利亚矮松树或Haimatsu,是分布在中国东北部、日本北部、韩国北部、耶尼斯河和东西伯利亚海拔1 000~2 300 m的特有植物[1-2]。偃松种子、芽、枝条、针叶、油树脂和根部在东北亚民间药物中被用于治疗神经痛、皮肤病、风湿病、黄癣、关节炎和肺结核等疾病[3],以及制备利尿剂与驱虫药。从偃松的松脂中可分离出单萜、二萜和三萜类化合物[4-6],偃松松塔一直作为副产物,附加值较低,不仅浪费生物资源,而且严重污染环境,而松塔富含蛋白质、多糖和多酚等生物活性物质[7]。多糖是一种高分子聚合物,常见于植物、动物和微生物中,不仅对生物的生长发育起着重要作用,而且具有抗氧化、免疫调节、抗肿瘤和抗炎等生物活性[8-10]。大多数多糖是相对无毒的,不会产生副作用。因此,利用多糖开发无毒天然食品和食品添加剂引起了食品和制药行业研究人员的极大兴趣。本课题组在前期的研究中,采用95%乙醇从松塔中提取并通过柱色谱分离得到7个甾醇和木脂素类物质,在此基础上,利用提取后的残渣,采用热水提取、喷雾干燥以及醇沉等方法,制备松塔多糖,通过Sevag法脱除蛋白、然后再用过氧化氢和活性炭相结合的方法对多糖进行脱色纯化处理,最后再进行纯化后多糖的结构表征以及活性的测定,以期为偃松松塔后期的综合开发利用提供理论支持。
1 材料与方法
1.1 材料与试剂
偃松松塔,2018年1月采集于黑龙江省大兴安岭,由中国林业科学院林业研究所的王军辉研究员鉴定为偃松(Pinuspumila(Pall.) Regel)。植物样本PPC-20180101存放于天津科技大学天津市制浆造纸重点实验室标本室。
阿拉伯糖、鼠李糖、木糖、甘露糖、半乳糖和葡萄糖购自阿拉丁试剂股份有限公司;二苯基苦基肼(DPPH)标准品,2,2-联氮-二(3-乙基-苯并噻唑- 6-磺酸)二铵盐(ABTS)、脂多糖(LPS)、二甲基亚砜(DMSO)以及甲氮甲唑蓝(MTT)均购于Sigma公司;胰蛋白酶、RPMI 1640培养基、磷酸盐缓冲液(PBS,pH值7.4)和胎牛血清均购于Gibco公司;肌醇、三氟乙酸、盐酸羟胺、吡啶、醋酸酐、苯酚、硫酸、N-1-萘乙二胺盐酸盐和对氨基苯磺酰胺等试剂,均为市售分析纯。
1.2 仪器与设备
FDU-1200型冷冻干燥机,日本东京理化公司;TD6A-WS PPR型,Sykam S501 Series 高效液相色谱仪,S-3250 示差检测器,TSKG5000色谱柱(300 mm×7.8 mm),Sykam色谱工作站,德国赛卡姆;GC-2010型气相色谱仪,Shimadzu公司;FID气相色谱检测器,WondaCap5型毛细管柱(0.25 mm×30.0 m×0.25 μm);YC-1800型实验室低温喷雾干燥机,上海雅程仪器设备有限公司;Tecan infinite M200 PRO型酶标仪,瑞士Tecan公司;FTIR-7600型傅里叶红外光谱仪,Lambad公司;KQ-500B型超声波清洗器,昆山市超声仪器有限公司;MCO-15AC型二氧化碳培养箱,日本Sanyo公司。
1.3 偃松松塔多糖的制备
1.3.1偃松松塔粗多糖提取 按文献[11]方法操作,将阴干的4 000.00 g偃松松塔粉碎至0.075 mm,以95%乙醇超声波提取3次,料液比1 ∶10(g ∶L),每次2 h,将所得到的偃松松塔渣在烘箱中烘干,去除乙醇残留。所得松塔渣采用蒸馏水作为提取用的溶剂,松塔渣和蒸馏水的比例为1 ∶50(g ∶mL),在100 ℃ 下用热回流提取两次,提取时间为2 h/次,离心,取上清液。将喷雾干燥机的入风口温度设为125 ℃,出风口温度设为85 ℃,压强0.4 MPa,然后加入上清液进行操作,得到偃松松塔的粗提物。所得偃松松塔粗提物在热水中复溶,将4倍体积的95%乙醇水溶液与其混合在一起,搅拌均匀,放置于4 ℃的冰箱中,第二天再进行离心操作,收集多糖沉淀,先后用无水乙醇、丙酮、无水乙醚洗涤3次,随后将得到的样品冷冻干燥,制得偃松松塔粗多糖。
1.3.2偃松松塔多糖的纯化 将所得偃松松塔粗多糖用热水溶解,加入Sevage试剂(氯仿-正丁醇,体积比5 ∶1),振荡1 h,静置分层,保留上层液体,重复3次。上层液体经减压浓缩除去残留的Sevage试剂,把溶液的pH值调整为9,分别取占溶液体积10%的双氧水和溶液质量2%的活性炭加入其中,在150转/min、 50 ℃条件下充分振荡3 h,随后上旋蒸仪。取截留分子质量为 3 000 u 的透析袋,把抽滤浓缩后的溶液装入其中,先用自来水透析,再用蒸馏水透析,时间均为48 h,冷冻干燥后得到纯化偃松松塔多糖(PPCP)[12]。
1.4 多糖的含量测定及结构表征
1.4.1多糖含量测定 使用苯酚-硫酸法[13]在490 nm处测定吸光值,以葡萄糖作标准曲线,计算多糖含量。
1.4.2红外光谱分析 按照文献[14]取KBr(光谱纯)少许,置于160 ℃环境下6 h烘干,而后置于干燥器中,备用。采用KBr压片法,取多糖样品2.0 mg,KBr 150.0 mg。红外灯照射下于玛瑙研钵中轻轻研磨,将多糖样品和溴化钾晶体充分研磨并混合均匀。将得到的样品上压片机,压成透明的薄片,进行背景采集后,在400~4000 cm-1红外光区,用显微红外光谱仪进行扫描。
1.4.3标准单糖衍生物的制备 取6支10 mL具塞试管,分别放入10 mg准确称取的鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖的标准品,添加10 mg的盐酸羟胺和内标8 mg,加吡啶0.5 mL,振荡摇匀,90 ℃水浴中加热反应30 min,间歇振荡。取出后冷却至室温,加醋酸酐0.5 mL,90 ℃下继续反应30 min。70 ℃水浴中将反应产物旋转蒸发至干,加1 mL氯仿振荡溶解,取样进行气相色谱分析。
1.4.4分子质量测定 PPCP的分子质量采用高效液相色谱仪进行测定。流动相为0.1 mol/L的PBS(pH值 7.2),流速0.5 mL/min,柱温30 ℃,进样量20 μL,运行时间20 min,以标准葡聚糖的保留时间和分子质量各取自然对数绘制标准曲线,计算纯化多糖的分子质量。
1.4.5多糖的水解和衍生化 称取PPCP(50.0 mg)放入密封玻璃管中,在100 ℃下用5 mL的4 mol/L三氟乙酸(TFA)进行水解6 h,取出于70 ℃真空减压浓缩至干。水解后的PPCP样品,按照1.5.2节方法将单糖衍生化。
1.4.6气相色谱分析 取衍生化后的标准品和样品用气相色谱检测。氮气30.0 mL/min;氢气40.0 mL/min;空气400 mL/min,进样压力100.0 kPa;进样温度240 ℃;检测器温度260 ℃;柱温 140 ℃ 保留3 min,以10 ℃/min的速度增加到240 ℃,最后保持15 min;进样体积为1 μL。
1.5 多糖抗氧化活性测定
1.5.1清除DPPH自由基的能力 根据文献[15]方法稍作修改,将200 μmol/L的DPPH溶液100 μL先后加入到100 μL不同浓度的样品溶液中,将混合物摇匀,在黑暗中静置30 min。在这个试验中,抗坏血酸(Vc)被用作阳性对照。用酶标仪在517 nm处测定吸光度,测定时每份样品都取平行操作3次后的平均值,计算DPPH自由基(DPPH·)清除率:
Y(DPPH·)=(A3-A1+A2)/A3×100%
式中:Y(DPPH·)—清除率,%;A1—DPPH溶液与样品液混合后的吸光度;A2—样品液与提取溶剂混合后的吸光度;A3—DPPH溶液与提取溶剂混合后的吸光度。
1.5.2清除ABTS自由基的能力 按照文献[16]稍作修改,制备ABTS储备液。将等体积的7 mmol/L的ABTS溶液(用pH值7.4的PBS进行配制)和2.45 mmol/L过硫酸钾充分混匀,在室温且避光的条件下反应12~16 h,用PBS将ABTS储备液进行稀释,使其在734 nm波长处吸光度为0.66±0.03。取96孔透明酶标板,分别加上20 μL不同浓度的多糖溶液,再取浓度为0.2 mmol/L的ABTS储备液各150 μL 加入其中,对照PBS,在室温下放置10 min,测定其517 nm下的吸光度,重复3次实验,每次3组平行,取平均值,计算ABTS自由基(·ABTS+)清除率。
Y(·ABTS+)=(A0-A)/A0×100%
式中:Y(·ABTS+)—清除率,%;A0—ABTS+工作液与PBS混合后的吸光度;A—ABTS+工作液与样品液混合后的吸光度。
1.5.3Fe3+还原能力 按照文献[17]稍作修改,向2 mL的离心管中依次分别加入0.2 mL不同浓度多糖溶液,0.5 mL PBS(0.2 mol/L pH值6.6),0.5 mL铁氰化钾(1%),混合充分,在50 ℃ 水浴中反应20 min,取出离心管,然后加入0.5 mL的三氯乙酸(10%),振荡混匀后静置10 min,吸取上述离心管中反应后的溶液0.5 mL加入新的离心管,分别向新的离心管中依次加入0.5 mL蒸馏水和0.1 mL 的三氯化铁(0.1%),振荡混匀后静置10 min,分别吸取200 μL加入到96孔板中,采用酶标仪在波长700 nm下测量吸光度。Vc作阳性对照,3次平行实验,取平均值,吸光度越大,说明多糖还原能力越强。
1.6 多糖的免疫调节活性
1.6.1细胞培养和药液配制 小鼠巨噬细胞系RAW 264.7用RPMI 1640培养基进行培养,培养基中含有10%胎牛血清(56 ℃水浴中灭活30 min)、100 U/mL青霉素和100 mg/L链霉素,培养条件为37 ℃、5% CO2,每2~3天更换一次培养基。当融合率达80%,细胞传代培养。将PPCP与DMSO混合,用RPMI 1640培养基稀释成DMSO不超过0.1%的供试药液[17]。
1.6.2细胞活性实验 采用传统的MTT实验法[18]测定了PPCP对原代RAW 264.7细胞活力的影响,对数生长期的细胞在96孔板上以1×106个细胞/孔接种。18 h后,向悬浮液中加入不同浓度的PPCP,培养24 h,抽吸上清液,加入100 μL MTT溶液(0.5 g/L)继续培养细胞3 h,然后向96孔板中加入100 μL MTT停止液(10%十二烷基磺酸钠(SDS),0.01 mol/L),继续进行16~20 h的培养,在550 nm处用酶标仪测定其吸光度,实验平行做3次,通过计算得到细胞的相对存活率。细胞相对存活率=(实验组孔吸光度-空白组孔吸光度)/(对照组孔吸光度-空白组孔吸光度)×100%。
1.6.3对RAW 264.7细胞NO分泌的影响 取96孔板,将RAW 264.7细胞以1×106细胞/孔的比例接种。18 h后,在悬浮液中加入不同浓度的PPCP,然后孵育24 h。设置阳性对照组,为加入1 mg/L LPS处理的细胞。用Griess法[19]测定细胞上清液中一氧化氮的分泌量。NaNO2用作标准品计算NO的浓度。
1.7 数据处理方法
所有试验均进行重复试验,重复3次,结果显示有平均值±标准偏差,P<0.05 认为有显著性差异,P>0.05则无显著性差异。数据分析和处理采用Excel 2013及Sigmaplot 10.0软件。
2 结果与讨论
2.1 偃松松塔多糖的提取与纯化
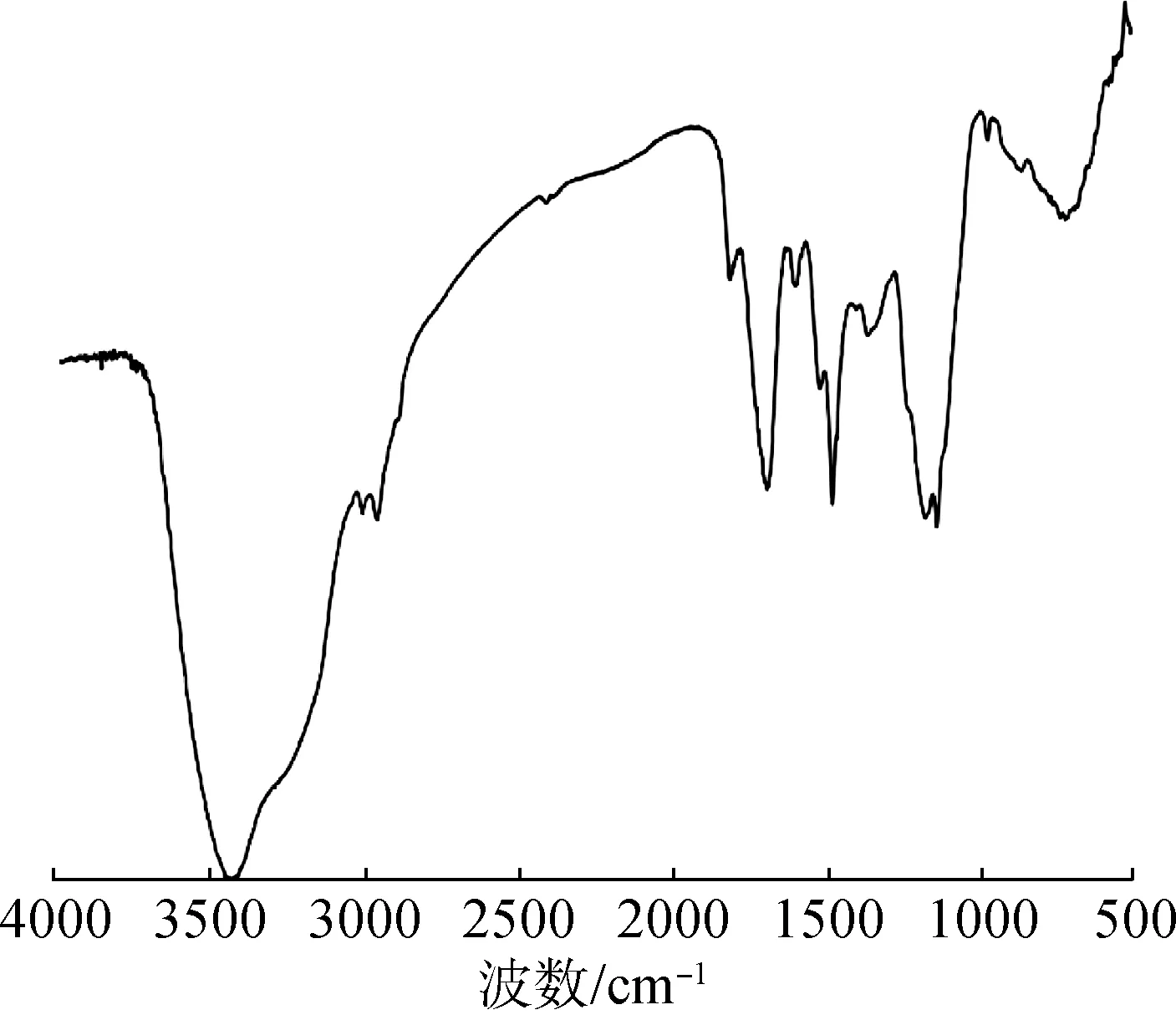
图1 PPCP的红外光谱图Fig.1 IR spectra of polysaccharides of P.pumila cones(PPCP)
偃松松塔粗多糖和纯化多糖的质量分别为123.18和69.24 g,经计算两者的得率分别为3.08%和1.73%,纯化多糖经苯酚-硫酸法测得梯度葡萄糖的吸光值,得到标准曲线,其回归方程为:Y=0.003 1X+0.018 2,R2=0.999 3,其中Y为吸光度,X为浓度。测得偃松松塔多糖(PPCP)纯度为68.78%,这可能由于在多糖纯化过程中,选择了单一的纯化方式,所得纯化的多糖中可能还含有大分子物质和微粒,如水溶性高聚物、残留蛋白质、多肽、核酸以及残留色素等杂质成分。
2.2 红外光谱分析

2.3 单糖组成及其分子质量分析
通过对7种标准单糖和偃松多糖样品先后进行气相色谱分析。由图2得知,多糖在此色谱下分离完全,有主要的4个峰。与混合标准单糖的色谱图对照,偃松松塔多糖主要由阿拉伯糖、甘露糖、葡萄糖、半乳糖与未知单糖。14.96 min处的单糖由于缺少相应单糖标品,暂时未分析出来。通过峰面积之比得出,4种单糖的物质的量比为2.33 ∶1.00 ∶2.20 ∶1.94。

1.鼠李糖rhamnose; 2.阿拉伯糖arabinose; 3.木糖xylose; 4.甘露糖mannose;5.葡萄糖glucose; 6.半乳糖galactose; 7.肌醇inositol
多糖的分子质量有相对性的特征,可以代表平均分布的相似链长,一般都通过多糖分子质量的大小来统计平均值[22]。通过高效液相凝胶色谱分析法,分别取葡聚糖标准品的保留时间和分子质量,取其自然对数后绘制标准曲线,再测定其分子质量。通过标准曲线和PPCP的保留时间,计算PPCP的分子质量为189.65 ku。
2.4 偃松松塔多糖的体外抗氧化活性
2.4.1对DPPH·的清除效果 DPPH自由基(DDPH·)清除模型是评价多糖清除自由基能力的常用方法。DPPH·清除的抗氧化机理是基于DPPH·对氢的接受,从而将DPPH·转化为非自由基形式(DPPH-H)。因此抗氧化活性是由于多糖的供氢能力[23-24],多糖中的羟基对其抗氧化活性起着重要作用。偃松松塔多糖对DPPH·的清除作用如图3(a)所示,0.02~2.0 g/L内,PPCP对DPPH·清除活性表现出剂量依赖性且随着浓度的增加逐渐增大,在质量浓度为2 g/L时,PPCP对DPPH·清除率(79.72%)达到最大。王薇薇[24]报道的质量浓度为10.0 g/L的红松松塔多糖,经过纯化后的与未纯化的清除DPPH·的效果差不多,都能达到清除率为80%的效果,与本研究相比略高,这可能由于偃松与红松两种植物本身的差异引起的。由此可见,偃松松塔多糖对DPPH·具有较强清除能力。
2.4.2对·ABTS+的清除效果 ABTS实验经常被用来评价植物中单体化合物和混合物的总抗氧化能力。需要强调的是,体外活性只能在生物系统中被视为潜在相关,而体内活性也取决于生物利用度和生物转化[25]。本研究对多糖在0.02~2.0 g/L范围内的·ABTS+清除能力进行了测定。从图3(b)可知,当质量浓度在0.02~2.0 g/L,多糖清除·ABTS+的能力随着浓度的增大而增强且清除能力较强,当质量浓度达到2.0 g/L时,清除率最大,达到39.63%,与对照组Vc对·ABTS+的清除能力相比,明显较低。与Zhang等[20]研究的红松松塔多糖对·ABTS+的清除能力相比也要弱,这可能是因为样品的差异,导致其中多糖的种类、组分的不同以及含有的蛋白、多酚类物而引起的。
2.4.3Fe3+还原力的测定 Fe3+还原力包括还原能力、防止链起始、过渡金属离子催化的结合、过氧化物的分解、防止继续吸氢和自由基清除等各种机制,都被认为是解释抗氧化活性的原因[25],偃松松塔多糖Fe3+还原能力如图3(c)所示,化合物的还原能力可作为潜在指示剂,表示抗氧化性的强弱。偃松松塔粗多糖及纯化后多糖在0.02~2.0 g/L内,Vc与PPCP的还原能力随着浓度的增加而逐渐增强,溶液质量浓度为2.0 g/L时,其还原能力分别达到最大,最大值分别为1.83和0.78。同一浓度下,与Vc还原能力相比,PPCP的还原能力较弱。
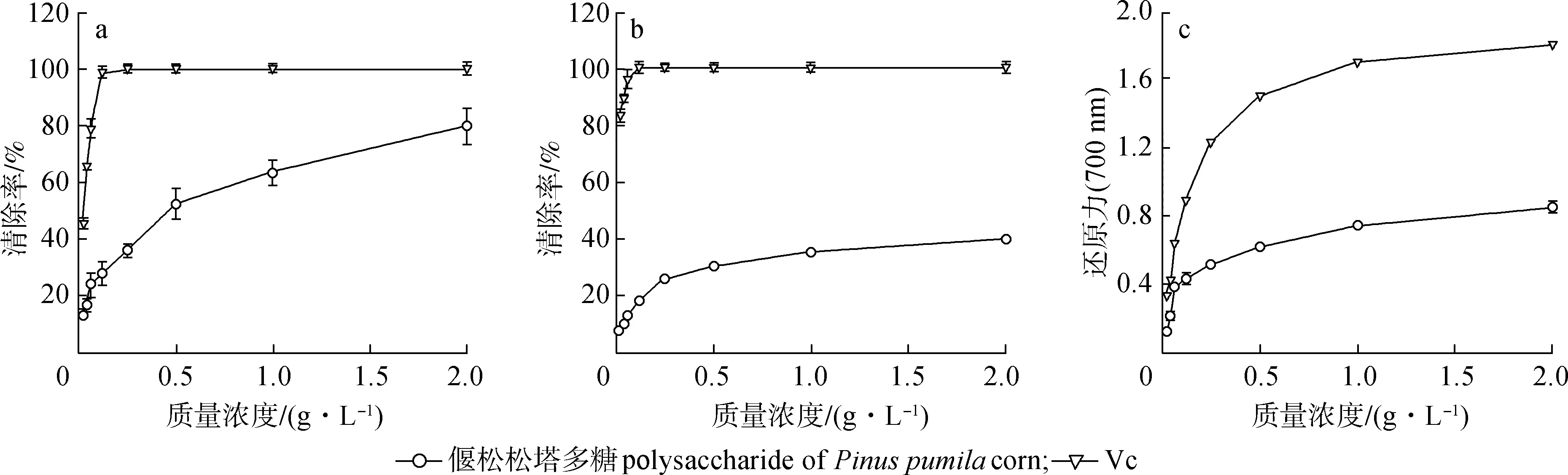
a.DPPH·; b.·ABTS+;c.还原力reducing power ability
2.5 偃松松塔多糖的生物活性

图4 偃松松塔多糖对RAW 264.7细胞存活率与NO释放的影响Fig.4 The effects of polysaccharide on cells viability and on NO production in RAW 264.7
2.5.1对细胞存活率的影响 采用MTT法测定多糖对RAW 264.7细胞存活率的影响,结果如图4所示。与空白对照组相比(多糖为0 mg/L时),在给药范围(0~200 mg/L)内,对偃松松塔多糖对细胞存活率基本上无影响。而在多糖质量浓度为300 mg/L时,偃松松塔多糖对细胞存在一定的毒性,存活率为(82.38±2.15)%。为了避免由于细胞毒性对细胞因子释放的影响,选取0~200 mg/L进行后期研究。
综上所述,偃松松塔多糖具有一定的抗氧化、免疫调节活性,可对其资源进一步开发,作为一种新型的天然抗氧化剂和免疫调节剂应用于保健食品、化妆品和生物制药等行业。接下来的研究方向是分析偃松松塔多糖的结构和结构-功能关系。
3 结 论
3.1以偃松松塔乙醇提取后渣为原料提取偃松松塔多糖,并进行GC分析,结果表明:偃松松塔多糖是一种杂多糖,主要由阿拉伯糖、甘露糖、葡萄糖和半乳糖组成,具有典型的多糖红外光谱特征,4种单糖物质的量比为2.33 ∶1.00 ∶2.20 ∶1.94。
3.2通过测定偃松松塔多糖清除DPPH自由基、ABTS自由基的能力以及还原能力评价抗氧化活性,然后通过体外实验评估其对RAW 264.7巨噬细胞免疫调节活性,结果表明:偃松松塔多糖对DPPH·和·ABTS+都有较强清除能力和还原能力,偃松松塔多糖以浓度依赖性方式表现出较强的抗氧化活性,多糖为2.0 g/L时,DPPH·和·ABTS+清除率分别为79.72%和39.63%。另外,松塔多糖能够刺激RAW 264.7巨噬细胞产生大量的NO,并没有对细胞增殖产生影响。
