开展光刺激治疗癫痫的研究
2020-03-09陈天玉蓉综述梁建民审校
陈天玉, 罗 蓉综述,梁建民审校
癫痫(Epilepsy,EP)是神经系统常见病,是全球重大健康问题,影响人口超过5000万[1]。我国总体癫痫患病约有900万,其中活动性癫痫患者约600万,每年新增约40万[2]。目前癫痫治疗仍以药物为主,近年来临床使用的10余种新一代抗癫痫药物(antiepileptic drugs,AEDs)主要用于控制癫痫发作症状,整体治疗状况并未明显改善,约有30%的患者对AEDs不敏感,成为药物难治性癫痫(drug resistant epilepsy,DREP)[3]。癫痫患者早期死亡率是普通人群的2~3倍,平均寿命减少2~10 y。我国癫痫死亡率为3.0~7.9/10万,儿童期较成人高5.3~8.8倍[4]。意外事故、癫痫猝死(sudden unexpected death in epilepsy,SUDEP)、癫痫持续状态(status epilepticus,SE)和自杀占癫痫死因的绝大多数[4]。SUDEP是指癫痫患者突发、意外、有或无目击、有或无癫痫发作证据且排除癫痫持续状态、非创伤性或非溺死性、死后尸检未发现结构性或中毒性死因的死亡[4]。据上海华山医院数据推测,我国每年SUDEP死亡人数高达约2万[5]。因此,深入癫痫机制研究仍然是神经科学领域面临的重要问题。
1 视觉刺激与癫痫活动有强烈互动
视觉光刺激能促发癫痫很早就被人们认识。1885年Gower最先报道了光敏性癫痫(photosensitive epilepsy,PSE),PSE是人类反射性癫痫的最常见类型,约10%的癫痫患儿受累,4%~9%的普通人群携带光敏感(photosensitivity)风险因素,至少80%PSE患者的癫痫发作由环境光刺激引起[6]。1997年日本学生观看卡通片时引起大规模癫痫发作的Pokemon事件震惊了世界,英国独立电视委员会(ITC)甚至启动一套保护性指南以避免这种光敏感的类似事件发生[7]。光敏感又称光阵发性反应(photoparoxysmal response,PPR),是对间断闪光刺激(intermittent photic stimulation,IPS)产生的异常脑电图(electroencephalogram,EEG)反应。临床上很早就通过避免节律性光刺激来预防PSE发作,例如避免快速变换的灯光照射,或使用交叉偏振眼镜、蓝光眼镜、黑色材质特制的Z1眼镜均能减少PSE癫痫发作[6],但相关研究稀少,神经机制不明。
2 节律性视觉刺激诱发癫痫已在临床广泛应用
间断闪光刺激(IPS)诱发试验是临床诊断PPR的主要依据[8]。1992年Waltz最早制定了IPS试验判定标准,包括4种类型:(1)棘波仅限于枕区,呈非持续性,与光刺激频率相关;(2)顶枕区棘波和双相慢波;(3)棘波和慢波传至额区;(4)广泛性2~5 Hz棘波和慢波复合波,以额区和中央区显著。IPS可诱发非典型失神发作、强直发作或全面强直阵挛发作(generalized tonic-elonie seizure,GTCS)[9]。PSE被分为单纯PSE和癫痫伴光敏感。前者约占40%,仅在视觉刺激时出现癫痫发作,包括特发性枕叶PSE和婴儿良性光敏性肌阵挛癫痫;后者约占60%,指既有自发性癫痫发作,又有光敏感[6],包括青少年肌阵挛癫痫(juvenile myoclonic epilepsy,JME)、儿童失神癫痫、青少年失神癫痫、早发性失神发作、眼睑肌阵挛伴失神(eyelid myoclonia with absences,EMA,即Jeavons综合征)、觉醒期GTCS癫痫、Dravet综合征、原发性阅读性癫痫、Doose综合征、良性婴儿肌阵挛癫痫和进行性肌阵挛性癫痫等10余种类型[6]。PSE的常见发作类型包括:失神发作、肌阵挛发作、强直性发作、局灶性发作和GTCS,其中以GTCS最常见(约80%),单纯PSE几乎均为GTCS[6]。特发性全面性癫痫(idiopathic generalized epilepsies,IGE)伴PPR患者的视皮质兴奋性明显高于不伴PPR者[10]。PSE发病机制至今不清楚。理论上,PSE主要涉及异常视觉信息处理、遗传学基础、皮质超兴奋性和结构异常等因素。研究表明,光敏感患者均有枕叶激活,枕叶激活可能是其主要机制之一[11]。
3 视觉系统的研究进展
视觉系统在全脑投射广泛,视觉系统是脑内主要信息高速通路,也是癫痫异常活动的主要传播径路。动物80%以上的外界信息由视觉通路获得[12]。视觉传导通路主要包括皮质视觉通路(cortical pathway)和皮质下视觉通路(sub-cortical pathway)(见图1)。
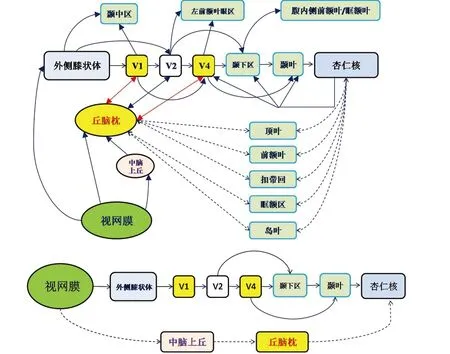
图1 脑内视觉通路及丘脑-视皮质神经回路示意图[24]
3.1 皮质视觉通路 视觉信息传递过程是:外界视觉信息-视网膜光感受器(视锥细胞和视杆细胞)光信号转为电信号-视神经(optic nerve)-视交叉(optic chiasma)-视束(optic tract)视外侧膝状体(lateral geniculate nucles,LGN)-初级视皮质(primary visualcortex,V1)[13]。由V1经高级视皮质(V2-4)分成两条通路:腹侧视觉通路(ventral visual pathways)和背侧视觉通路(dorsal visual pathways)。
3.1.1 腹侧视觉通路 即枕颞通路(occipitotempral pathway),起始于V1,依次经V2和V4进入下颞叶皮质(inferior temporal cortex,ITC),终至杏仁核(Amygdala,AMG)[13]。
3.1.2 背侧视觉通路 即枕顶通路(occipitalparietall pathway),起始于V1,经V2和V3进入背内侧区和中颞区(middle temporal,MT,亦称V5),达顶下小叶,终至杏仁核[13]。
3.1.3 腹-背视觉通路的相互作用 目前认为腹侧通路与背侧通路可能存在并行处理过程和复杂相互作用[14]。腹侧通路V4区具有刺激形状依赖性,82.7%的V4方向选择性神经元对颜色敏感,有助于检测空间结构刺激的运动方向和整合颜色信息[15]。V4还有方向功能柱结构,接受一定量背侧通路V3和MT的纤维投射。腹-背视觉通路均可投射至前额运动区,腹-背视觉通路既独立又相互作用,二者共同完成视觉感知功能[14]。
3.2 皮质下视觉通路 脑内有数条皮质下视觉通路,其中的视觉信息-视网膜-中脑上丘(superior colliculus,SC)-丘脑枕(pulvinar)-杏仁核通路较重要,视觉刺激可经皮质下结构直接传至杏仁核[16]。人脑杏仁核对早期视觉信息处理非常重要,在视觉刺激后74ms就能产生恐惧反应,较视皮质更迅速[17]。SC可直接参与恐惧视觉信息处理[18]。新近发现,小鼠有另外两条起源于SC,与杏仁核联系的双突触皮质下视通路,在对视觉危险信息的防御反应中起重要作用[19]。丘脑枕更适合传输低频信息及判断信息的重要性和显著性,视觉掩蔽可导致SC和丘脑枕的神经活动增强[16]。此外,皮质下视通路在拓扑视知觉过程中也起重要作用。小鼠在视知觉过程中能够提取拓扑信息,有助于快速判别环境危险信息[20]。
3.3 皮质视觉通路和皮质下视觉通路的联系 皮质下视觉通路无法脱离皮质控制,与皮质视觉通路存在广泛联系和相互作用[21]。杏仁核与腹侧通路中的视皮质、眶额叶和前扣带回有直接纤维联系,丘脑枕与背侧通路的视皮质-额顶网络-杏仁核之间均有直接纤维联系[22]。V1-SC-丘脑枕有神经投射联系,是皮质视通路和皮质下视通路视觉信息的重要交汇区[23]。当面临恐惧视觉信息时,皮质下视通路反应更迅速,随后由皮质视通路评估整合共同处理视觉信息[14],但皮质视通路与皮质下视通路相互作用的机制尚不清楚。
4 癫痫发生与视觉神经回路
癫痫发生的主要标志是神经元的超兴奋性和神经回路的超同步性[25]。丘脑在癫痫病理机制中起关键性作用,皮质-丘脑-皮质神经回路在癫痫网络中处于核心地位。皮质-丘脑-皮质神经回路兴奋性异常是失神癫痫及其他类型全身性癫痫发生及演化进展的主要机制[25]。该神经回路异常也与PPR发生机制密切相关,PSE患者存在与视觉丘脑的异常连接[26],PSE的常见发作类型即包括失神发作和GTCS[6]。失神癫痫是儿童癫痫最常见类型之一,占儿童癫痫的10%~17%,儿童失神癫痫的典型EEG表现为正常背景活动下3~4 Hz棘慢波发放[27]。普遍认为,皮质-丘脑-皮质神经回路联系强度和兴奋性的改变是导致失神癫痫棘慢波发放的主要机制[28]。对IGE患者和癫痫动物的研究均表明,丘脑-皮质回路参与棘波放电过程[29],当PPR先于GTCS出现时,丘脑参与诱发PPR[30]。EEG-fMRI研究发现,癫痫伴PPR患者在广泛性自发棘慢波放电时可出现丘脑激活和额顶叶区域失活[31]。PSE患者在IPS持续诱导PPR时出现丘脑、SC和视皮质血氧依赖性(blood oxygen level dependent,BOLD)信号增强,前顶叶区域BOLD信号减少[32]。EEG相干源动态成像研究表明,观察组10例失神癫痫患者均有丘脑受累[33]。图1箭头代表正常视觉信息的主要传输通路。在许多脑结构间存在反馈通路(双向箭头)。癫痫异常神经回路可能是某一个脑结构向另一脑结构的反馈投射被异常强化,其中丘脑枕和杏仁核存在大量反馈,被认为是癫痫回路的枢纽,但视皮质V1和V4在癫痫发病中的作用多被忽视[24]。
5 皮质抑制缺陷-癫痫放电-PPR
皮质抑制是阻止癫痫放电在视觉皮质扩布的机制之一,皮质抑制缺陷或称皮质超兴奋可能导致PPR[34]。皮质抑制缺陷和光敏感均有一定遗传学基础,与基因编码离子通道和神经元结构异常有关。PSE与基因组单核苷酸多态性(single nucleotide polymorphism,SNP)、染色质解旋酶DNA结合蛋白2(chromodomain helicase DNA-binding protein 2,CHD2)基因、编码含解偶联蛋白溴结构域的BRD2基因和及γ-氨基丁酸受体α1亚单位(Gamma-aminobutyric acid receptor alpha 1 subunit,GABRA1)基因等的变异相关[35~37]。尽管确切致病基因或易感位点未明,总体认为光敏感呈常染色体显性遗传,外显率随年龄增长而增高[38]。
6 小结
综上所述,视觉信息可以通过多条视觉通路并行处理,广泛激活视觉脑区和其他脑区。丘脑枕是视觉通路的主要节点,与枕叶视皮质联系极为密切,丘脑枕-枕叶皮质间的神经回路是丘脑-皮质回路的重要组成部分,可能参与PSE的枕叶激活机制,并影响其他类型癫痫回路的形成与自我强化过程。光敏感与癫痫发病联系密切,以往的研究主要集中在对光敏感现象的临床描述性研究,对光刺激-枕叶激活-其他脑区激活-癫痫发生之间关系的理论研究十分稀少。节律性光刺激与视觉系统可以产生强烈互动,激活视觉系统的异常神经回路而导致癫痫发作。若对视觉通路给予非节律性光刺激,很可能通过干扰癫痫回路阻止癫痫发作。若长期给予非节律性视觉刺激,有可能减少异常兴奋性神经回路的自我强化,减少癫痫发作,甚至彻底消除癫痫回路中的异常强化点,有望发展成无创性非药物抗癫痫的新疗法。
