响应面法优化番木瓜籽蛋白质提取工艺
2020-03-09廖灿杰杨宏王玉栋庄洋
廖灿杰,杨宏,2,3,*,王玉栋,庄洋
(1.华中农业大学食品科学技术学院,湖北武汉430070;2.湖南文理学院水产高效健康生产湖南省协同创新中心,湖南常德415000;3.华中农业大学环境食品学教育部重点实验室,湖北武汉430070)
食品工业生产、制备和消费产生大量固体和液体废物。这些废物造成潜在的处理和污染问题,同时损失有价值的生物元素和营养物质。而且,由于严格的国家国际法规,废物管理已成为必然。食品加工废物有可能转化为有用的产品,甚至作为其他行业的原料。利用水果和蔬菜加工废物作为提取功能性成分的来源是一个充满前景的领域[1]。例如最大限度地减少加工操作产生的废物,对副产品进行处理和处置或者可持续性生产。食品加工残留物的生物转化越来越受到关注,因为这些剩余物质有可能转化为有用产品和可利用的资源[2]。
番木瓜(Carica papaya L.)是一种具有高营养价值和经济价值的热带植物[3],不仅作为新鲜水果食用、生产果汁或果酱,还被用来提取木瓜蛋白酶、做化妆品;全球年产量达到1122 万吨,占热带水果总产量的15.36%[4]。由于年度消费量高,工业加工中产生的大量番木瓜籽,被认为是废弃物;据粗略计算,番木瓜籽占番木瓜重量的15%~20%[5]。目前有关番木瓜籽的研究主要集中在油脂和多酚等成分的提取和分析,关于番木瓜籽蛋白质的研究很少。同时,国内邓楚津等对番木瓜籽基本成分进行分析,发现其蛋白质含量在25%左右;同时与联合国粮食及农业组织和世界卫生组织参考模式作对比,番木瓜籽蛋白的氨基酸含量丰富,种类齐全[5]。有关番木瓜籽蛋白质最佳获取条件的研究很少,因此本文研究了最合适的番木瓜籽蛋白质提取条件,为蛋白质作为食品添加物提供技术支撑。
pH 值、温度、离子强度、提取时间和液料比等因素对甜瓜籽粕[6]、亚麻籽[7]蛋白质提取均有影响。根据最终用途要求,遵循各种提取、分离和分馏程序。通常,在碱性溶液中提取富含蛋白质的物质,然后进行等电沉淀,应用于食品。响应面法(response surface method,RSM)由一组数学和统计技术组成,这些技术基于经验模型与试验设计相关的试验数据的拟合[8]。当多种因素相互作用影响蛋白质的浸提效果时,响应面法作为一种既能找到最优因素值也能通过图形技术直观的反应各因素之间的函数关系,进而获取最佳优化条件的分析方法[9],在各类化学物质提取中均有广泛应用,例如菜籽油[10]、葡萄多酚[11]的提取。
在本研究采用碱溶酸沉法提取蛋白,采用响应面法优化番木瓜籽蛋白质提取条件,为番木瓜籽蛋白质的工业化生产及其深加工提供指导,提升番木瓜籽的利用价值。
1 材料与方法
1.1 材料与试剂
番木瓜:海南水果超市;牛血清蛋白(bovine serum albumin,BSA):美国 Roche 上海肯强事业有限公司;考马斯亮蓝G-250:北京兰杰柯科技有限公司;氢氧化钠、浓硫酸、浓盐酸均为分析纯。
1.2 仪器与设备
PB-10 型 pH 计、AL-204 型电子分析天平:梅特勒-托利多仪器(上海)有限公司;K9840 型凯氏定氮仪:济南海能仪器股份有限公司;Beckman Coulter Allegra X-22R 高速冷冻离心机:克曼库尔特实验室有限公司;UV-1800 型紫外分光光度计:日本岛津公司;GZX-9070 型MBE 数显鼓风干燥箱:上海博讯实业有限公司;HH-6 型恒温水浴锅:国华电器有限公司。
1.3 试验方法
1.3.1 原料预处理
番木瓜籽粉制备:番木瓜籽水中淘洗去除籽粒表面残余果肉,沥干水分,40 ℃条件下烘干,高速粉碎机粉碎过80 目筛;采用索氏抽提法脱脂6 h~7 h,重复2次,然后番木瓜籽粉放入通风橱风干过夜,存于自封袋中,常温储存。
1.3.2 番木瓜籽蛋白质提取
采用碱溶酸沉法[12]提取:取10 g 脱脂番木瓜籽粉与去离子水按一定比例混合,在一定温度条件下用0.2 mol/L NaOH 或 0.2 mol/L HCL 调节 pH 值,搅拌一定时间后将悬浮液在常温条件下7 000 r/min 离心12 min,收集上清液,并测定上清液中蛋白质含量。
1.3.3 蛋白质含量测定
1.3.3.1 番木瓜籽总蛋白含量测定
采用微量凯氏定氮法,参照GB 5009.5-2016《食品安全国家标准食品中蛋白质的测定》。
1.3.3.2 番木瓜籽蛋白提取液蛋白质含量测定
采用考马斯亮蓝法[13],标准曲线方程:Y=5.724 1X-0.01,R2=0.996 5
其式中:Y 为吸光度;X 为蛋白质质量浓度,mg/mL。
1.3.3.3 提取液蛋白质含量测定
取稀释到适当浓度的提取液1 mL,加入5 mL 考马斯亮蓝G-250 溶液,在595 nm 处测定吸光值,计算蛋白质的含量。
番木瓜籽蛋白质提取率/%=提取液中蛋白质含量/番木瓜籽蛋白质总含量×100
1.3.4 等电点测定
取20 mL 蛋白提取液,用0.2 mol/L HCL 调至pH值 至 2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0,静置2 h,8 000 r/min 离心10 min 后去掉上清液,沉淀在50 ℃烘干30 min 称重,重复3 次,蛋白质沉淀量最大对应的pH 值即为蛋白质的等电点。
1.3.5 单因素试验
选取pH 值、液料比、时间、温度4 个因素作单因素试验,以番木瓜籽蛋白质提取率为考察对象,考察各因素对蛋白质提取效果的影响。
探究不同 pH 值(8、9、10、11、12)对蛋白质提取率的影响,取10 g 脱脂番木瓜籽粉在液料比30(mL/g)、浸提时间180 min、温度40 ℃的条件下。
探究不同液料比[10、20、30、40、50(mL/g)]蛋白质提取率的影响,取10 g 脱脂番木瓜籽粉在pH 值为11、浸提时间180 min、温度40 ℃的条件下。
探究不同时间(60、120、180、240、300 min)对蛋白质提取率的影响,取10 g 脱脂番木瓜籽粉在pH 值为11、液料比 40(mL/g)、温度 40 ℃的条件下。
探究不同温度(20、30、40、50、60 ℃)对蛋白质提取率的影响,取1 g 脱脂番木瓜籽粉在pH 值为11、液料比 40(mL/g)、时间 240 min 的条件下。
1.3.6 响应面试验设计
利用3 个水平,4 个变量和中心复合设计(central composite response design,CCRD)[14]的统计工具,具有29 个单独的点,用于研究4 个变量对从番木瓜籽提取蛋白质的影响。基于前面单因素试验选择自变量及其水平。
29 次运行以完全随机的顺序进行,以最大限度地减少偏差。每个试验具有两次重复,并且将平均提取的蛋白质作为响应值Y。独立变量及其水平如表1所示。

表1 试验因素水平和编码Table 1 Code and level of factors chosen for the trials
1.3.7 数据分析
用 IBM SPSS Statistics 21、Origin 8.5 进行试验数据分析和图表制作,使用Dsign-Expert V8.0 进行响应面试验设计。每组试验重复3 次。
2 结果与分析
2.1 番木瓜籽蛋白质等电点
不同pH 值下的蛋白质沉淀量见图1。

图1 不同pH 值下的蛋白质沉淀量Fig.1 The quality of protein precipitation at different pH
蛋白质分子表面有大量具有不同解离常数的带电基团,不同pH 值条件下总电荷数就不同。当pH 值为某一特定值,即蛋白质所带电荷的总和为零时,该pH 值即为该蛋白质等电点。此时,蛋白质会聚集沉淀,而不会变性。由图1 可知,随着pH 值增加,蛋白质沉淀量呈先升高后降低。当pH 值在3.0~3.5 范围时,蛋白质沉淀量较高,此时,蛋白质净的正、负电荷数总和接近于零,蛋白质-水相互作用降低、蛋白质-蛋白质间静电排斥作用降低而引发蛋白质聚合沉淀[15]。表明番木瓜籽蛋白质的等电点pH 值在3.0 附近,这与棉籽(pI=4.5)[16]、亚麻籽(pI=5.4)[7]等植物种子蛋白等电点有区别。
2.2 番木瓜籽蛋白质提取单因素试验
2.2.1 pH 值对蛋白质提取效率的影响
pH 值对番木瓜籽蛋白质提取率的影响见图2。

图2 pH 值对番木瓜籽蛋白质提取率的影响Fig.2 The effect of pH value on extraction rate of Carica papaya L.seed
通常情况使用偏碱性的浸提液可以提高蛋白质溶解度,大多数植物蛋白质(如大豆分离蛋白、花生分离蛋白、奇亚籽分离蛋白)都属于偏酸性的蛋白质。由于番木瓜籽蛋白质等电点为3.0,在碱性环境中蛋白质呈负电性,进而导致蛋白质-蛋白质之间斥力升高;且蛋白质表面的亲水基团暴露,加强其与水分子的结合,提高溶解度。探究单因素pH 值对番木瓜籽蛋白质提取率影响由图2 可知,pH 值对蛋白质提取率影响效果显著;pH 值在8~11 范围内,蛋白质提取率与pH值呈正相关;在 pH 值 10~12 范围内,pH 值为 11 时达到最高值,但该范围内蛋白质提取率变化浮动较小。
一般来说,在较小的pH 值条件下,蛋白质酸式解离效果不佳,在水溶液中分散性较低,蛋白浸出效果不佳。但pH 值相对较大时,提取液的颜色加深,影响蛋白质产品的视觉感官,从色泽考虑作为食品添加物也不合适;同时pH 值过高会导致,浸提液黏度变大,影响蛋白质酸沉效果,降低得率;而且由于番木瓜籽中碳水化合物含量较高,过碱的环境可能诱导蛋白质结构发生一定程度的变化,促使美拉德反应的发生,不仅导致必需氨基酸损失,还可能会有异味物质和有毒缩合氨基酸产生[17],影响蛋白质健康的食用。综合考虑,响应面优化pH 值得选定范围为10~12。
2.2.2 液料比对蛋白质提取效率的影响
液料比对番木瓜籽蛋白质提取率的影响见图3。

图3 料液比对番木瓜籽蛋白质提取率的影响Fig.3 The effect of liquid-solid ratio on extraction rate of Carica papaya L.seed
蛋白质提取过程中,提取液体积减少会降低蛋白质分子的扩散速率和溶解度;在一定范围内,蛋白质溶解量会达到一种平衡,类似于溶液的饱和状态;过高的浸提液体积会导致溶液分散性加大,不利于蛋白质沉淀获取,同时也浪费水资源和提取液排放造成污染环境。为了获取最佳的液料比条件,观察图3 可发现,蛋白质提取率因液料比的不同而差异明显。液料比在 10(mL/g)~40(mL/g)范围里,蛋白质提取率显著上升;这是由于料液比较小时,溶液黏度较大,分子扩散速度慢,溶液达到饱和时可以溶解的蛋白质量较低;随着料液比增大,溶液中分子扩散和碰撞速率加快,促进蛋白质分子的溶解。当液料比增加到50(mL/g),较 40(mL/g)提取率反而降低且料液比的增大,蛋白质分子分散性加大,不易酸沉获得蛋白质;同时一些可溶性杂质(如多糖等)溶解性增加不利于获得纯度较好的蛋白质[18]。综合考虑水资源和获取率,液料比的最佳条件在40(mL/g)左右。
2.2.3 时间对蛋白质提取效率的影响
时间对番木瓜籽蛋白质提取率的影响见图4。

图4 时间对番木瓜籽蛋白质提取率的影响Fig.4 The effect of time on extraction rate of Carica papaya L.seed
在特定条件下,蛋白质的浸出需要一定时间达到平衡状态;时间较短,分子扩散效率一定,蛋白质溶出量有限;时间过长,可能有更多非蛋白质成分浸出,从经济性考虑时间成本增加不利于工业生产。研究图4发现,时间对于蛋白质提取率的影响较显著,呈先上升后降低的“倒V”型。时间在60 min~240 min 之间时,蛋白质溶出量逐步增加,在240 min 左右蛋白质在溶液中溶解量趋于饱和,处于平衡状态。延长浸提时间蛋白质提取率呈降低的趋势,由于蛋白质长时间在碱性环境中会发生轻微水解和变性,而且时间增加,耗能也会增长,生产成本相应也会变大,不利于蛋白质工业化生产;时间延长也会增加非蛋白物质(如糖类、多酚等)浸出,溶于浸提液,影响蛋白质进一步沉淀和蛋白制品纯度[19]。因此选取时间为240 min 左右为宜。
2.2.4 温度对蛋白质提取效率的影响
温度对番木瓜籽蛋白质提取率的影响见图5。

图5 温度对番木瓜籽蛋白质提取率的影响Fig.5 The effect of temperature on extraction rate of Carica papaya L.seed
温度的提升可以加快分子扩散速率和分子碰撞概率,促进蛋白质分子的溶出,同时可以降低提取液的粘度,有利于提高蛋白质得率;但温度超出一定范围会引起蛋白质结构的发生不可逆的变化和氨基酸损失,降低其营养价值[20]。从经济性考虑,提升温度也会损耗更多的能源。温度对番木瓜籽蛋白质提取率的影响见图5,在20 ℃~50 ℃范围内,蛋白质提取率呈升高趋势,温度提高,分子运动速率加快,分子之间的碰撞加快,蛋白质分子溶出量增加;温度的上升也会促进蛋白质表面结构发生轻微改变,利于蛋白质与水之间的相互作用,进而从番木瓜籽粉中浸提出来进入提取液。当温度继续升高,蛋白质提取率出现下降的趋势,较高的温度会诱导蛋白质结构发生变化,破坏蛋白质分子表面侧链基团与水相互作用的平衡,导致蛋白质与蛋白质之间发生聚集,增加浸提液粘度,对蛋白质溶出不利[21]。因此蛋白质提取温度选取在50 ℃。
2.3 响应面试验
2.3.1 试验结果及方差分析
该研究利用RSM 模拟出一种预测模型,用于优化从番木瓜籽中提取蛋白质的条件。试验条件和试验设计的相应响应值如表2 所示。分析独立变量和因变量以获得可预测给定范围内响应的回归方程和方程中系数的值如表3 所示。蛋白质提取的回归方程(Y)如下:


表2 基于Box-Behnken 设计的试验和预测值Table 2 Experiments and predictions based on Box-Behnken design

续表2 基于Box-Behnken 设计的试验和预测值Continue table 2 Experiments and predictions based on Box-Behnken design
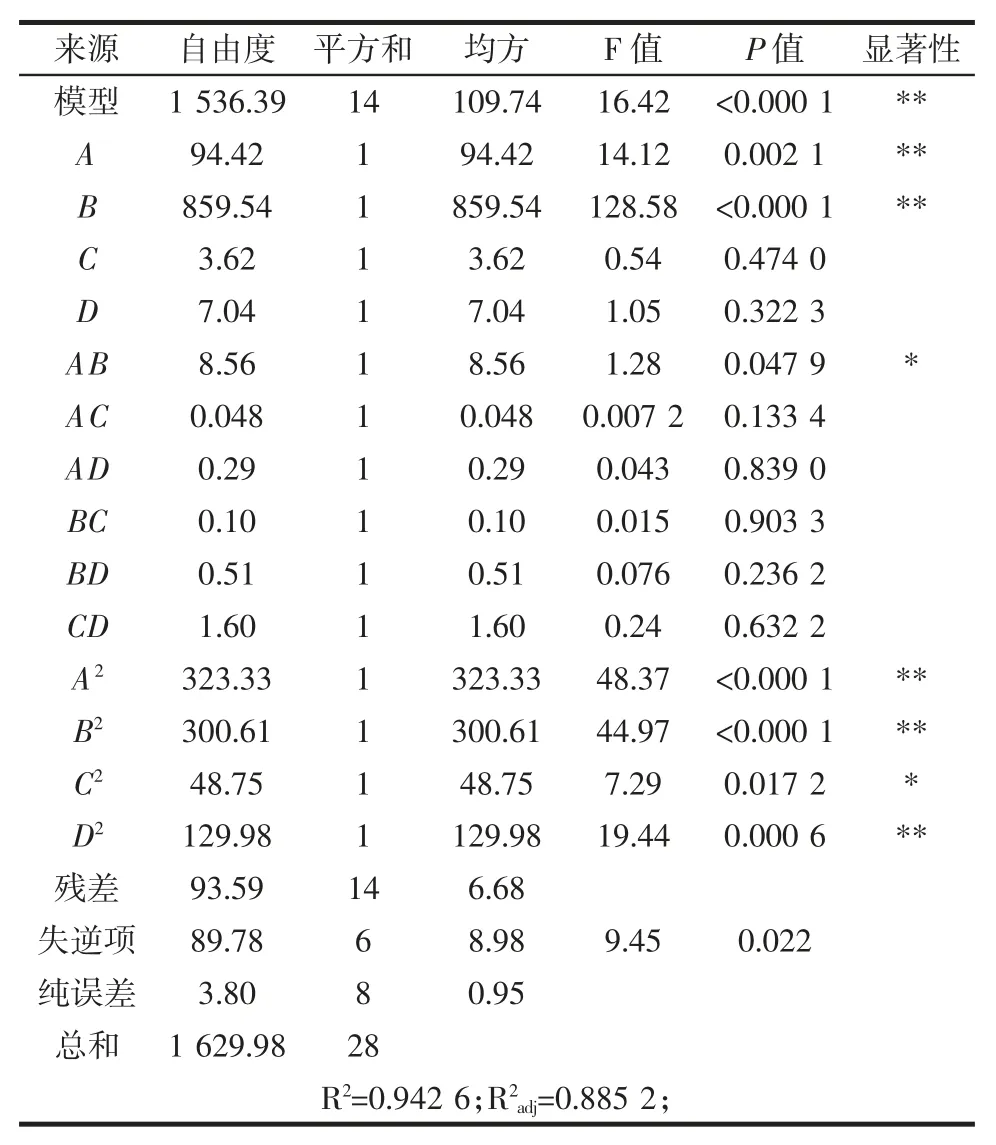
表3 回归方程方差分析和显著性检验表Table 3 Regression equation analysis of variance and significance test
如表3 所示,对于一个拟合的模型,确定系数(R2)用来度量适合度[22],其值为0.942 6。这意味着94.26%的变化可以通过拟合模型来解释。Gupta 和Kabe 认为,如果模型的拟合良好,R2应该至少为0.80[22]。回归模型显著性的P 值小于0.000 1。因此,该拟合模型可以充分代表所选参数之间的真实关系。
通过拟合二阶多项式的回归系数,可以得到番木瓜籽的处理条件对蛋白质提取的影响。显然,pH 值和液料比的线性项为极显著(P<0.01),一个二次项(pH值和液料比)为显著(P<0.05),而其他因素及交叉项均无显著性(P>0.05)。结果表明,pH 值和液料比的影响是从番木瓜籽中提取蛋白质的主要因素。然而,在试验范围内,时间和温度对番木瓜籽蛋白质提取没有显著影响(P>0.05)。
2.3.2 自变量对响应值的影响
绘制三维表面图以说明自变量对依赖变量的主要和交互作用[23]。通过施加恒定值(即,考虑到一个独立变量的间隔的中心点)来绘制这些图。二维图即等高线图,其形状(圆形或椭圆形)表明变量之间的相互作用是否重要;若为圆形等值线图,则表明相应变量之间的相互作用可忽略不计,而等高线图的椭圆或鞍形则表明变量之间的相互作用显著[23]。为了更显著的观察不同因素对蛋白质提取率的影响,研究图6 中三维表面图和二维等高线图。
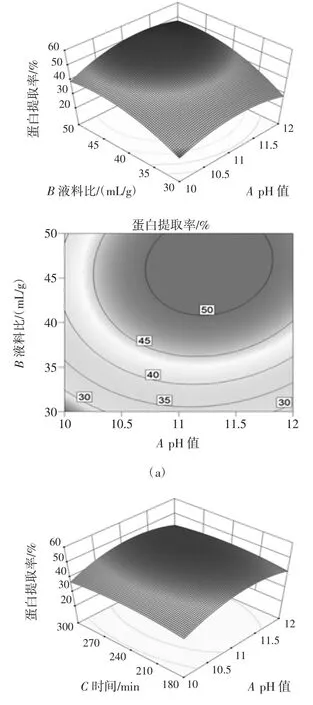

图6 自变量对蛋白质提取率影响的响应面图Fig.6 Response surface plots of independent variables on protein extraction rate
图6(a)是pH 值和液料比对蛋白质提取率的影响趋势均是先增加后下降且影响显著(P<0.01)。可能是因为适当的pH 值利于蛋白质的浸提,而过大的pH值诱导蛋白质结构发生轻微变化,可能促使美拉德反应,影响蛋白质得率;适当的液料比可以最大化的溶出蛋白质,降低溶液粘度,利于蛋白质沉淀提高得率。由图6(b)可知,pH 值对提取率的影响效果较时间影响更为显著,且观察表3 发现两个变量的相互作用对蛋白质提取率影响不显著(P>0.05)。已经报道了对脱脂萝卜籽、鹰嘴豆和豌豆蛋白质提取物的提取时间对蛋白质产量的影响的类似报道[24-26]。图6(c)是料液比和温度两个自变量对蛋白质提取率的影响效果与pH值和时间的趋势类似,液料比影响效果显著优于温度;观察表3 可知,两个自变量(液料比和温度)相互作用对于蛋白质提取率的影响效果不显著(P>0.05)。
有关番木瓜籽蛋白质的提取报道较少;然而,已经有报道使用其他植物材料的类似研究。Mechmeche,Manel 采用响应面法优化番茄籽蛋白质的提取工艺,发现时间,温度,pH 值和液料比对蛋白质提取率都有影响,并得出最佳提取条件为pH 8.0,时间30 min,温度50 ℃,液料比 8(mL/g)[27]。对亚麻籽[7]和木豆[28]蛋白的研究与本研究一致,随着液料比和pH 值的增加,蛋白质产量明显增加,而温度和时间影响没有那么显著。
2.3.3 蛋白质优化条件的试验验证
使用推荐的最佳条件[(pH 11.3、料液比1∶45(g/mL)、时间224 min、温度47.5 ℃]测试模型方程对于预测最佳响应值的适用性。通过RSM 优化方法模拟出这组最佳条件进行试验验证,并使用模型方程得出预测响应值。预测番木瓜籽蛋白质提取率为55.21%,在此试验条件下,验证试验结果平均值为53.74%,发现试验值与预测值基本一致。对比王标诗等正交优化试验结果48.53%,有一定程度的提高[29]。
3 结论
采用响应面法中心复合设计建设的数学模型失逆项不显著和R2值为94.26%,可使用该方程模拟优化蛋白质提取条件。通过29 种pH 值、液料比、温度、时间组合优化之后,模拟得到最佳提取条件:pH 11.3、液料比 45(mL/g)、时间 224 min、温度 47.5 ℃,番木瓜籽蛋白质提取率为53.74%,与理论值55.21%差异不明显。综合考量产品得率和外观,最终确定优化条件为:pH 11、液料比 40(mL/g)、时间 220 min、温度 47 ℃。因此,可使用中心复合设计对碱溶酸沉法提取番木瓜籽蛋白质进行工艺参数优化,为提升番木瓜籽蛋白质利用价值提取提供理论支撑和依据。
