金花甜茶浸提条件的研究
2020-03-09陈明珠洪佳宝
陈明珠,洪佳宝
(武夷学院茶与食品学院,福建武夷山354300)
广西金秀大瑶山甜茶(Rubus Suavissimus S.Lee)是蔷薇科悬钩子属植物。广西甜茶含最具有价值的黄酮类物质、茶多酚和甜茶素等[1-2],甜茶无毒害作用,具有降血糖、降低胆固醇、抗氧化、抗肿瘤、抗炎[3]、咳祛痰、润肺等药理功效。
甜茶素(rubusoside)易溶于水、甲醇、乙醇等常用溶剂[4]。甜茶素热量为蔗糖1%,甜度是蔗糖的300 倍[5]。甜茶素具降血糖、降血脂、抗癌[6]、抗龋[7-8]等功效,是理想的食品代糖,用于食品、医药保健、饮料工业等行业[9],具有广阔的应用前景。
茶多酚(tea polyphenols)又称茶单宁或茶鞣,是甜茶叶主要活性成分之一。茶多酚具有抗氧化、降低胆固醇、抑制血糖上升、抗疲劳、抑制心血管疾病、防癌、清除自由基、减肥、改善人体免疫力、预防口腔疾病、抑菌、防辐射、抗过敏等作用[10-16]。茶多酚具有较高的营养和保健价值,具有很广阔的应用市场,已经遍及食品、服装、日用品等各个领域。因此茶多酚的提取研究意义重大。其中热水提取法是应用最广泛的方法之一。
“金花菌”主要是一种冠突散囊菌(Eurotium cristatum),为优势微生物。金花菌具有降脂、减肥、抗氧化、抗癌、抑菌、改善人体肠道、促进消化的功效[17-22],并无毒副作用。金花菌在发酵过程产生多种酶类,会将原料中的蛋白质、纤维素、淀粉、果胶质等物质分解和转化,从而提高原料茶的品质,使金花菌发酵的茶叶具有独特的色、香、味。
因此近几年将金花菌接种到各类茶进行发酵的研究已经成为热点。金花菌除了常用于茯砖茶、六堡茶等黑茶的发酵之外,其他类茶也可接种[23]。虞飞等[24]对金花菌发花的不同红茶和绿茶的感官品质进行研究。刘菲等[25]对人工接种金花菌的白茶滋味物质的变化进行研究。而且还可以对一些特殊的植物进行接种发酵并对发花工艺、发花过程中品质、化学成分变化进行研究,比如藤茶、杜仲茶和银杏等[26-30]。金花菌不仅可以接种于砖茶,还可以散茶接种发酵[31]。金花菌不仅可以在固态茶叶进行接种发酵,也可以进行茶叶接种的液态发酵[32]。而且还对不同嫩度的鲜茶叶的接种发酵进行研究。徐小云等[33]对不同嫩度茶树鲜叶,如一芽一二叶、一芽三四叶和一芽五六叶3 种茶树鲜叶发酵的金花散茶理化成分的变化进行研究,得出以一芽三四叶最佳。还可以利用不同阶段茶叶,比如夏秋茶进行金花发酵,变废为宝[34]。
但是前人并没有广西大瑶山甜茶进行金花菌发酵的研究,而且只停留在植物接种金花菌的接种条件、制作工艺、发花过程品质及化学成分变化的研究,无金花菌接种植物的产品浸提条件的研究。本研究利用广西金秀大瑶山甜茶进行金花菌接种干鲜叶散茶发酵(不经过渥堆),并对此发酵的甜茶进行热水浸提条件的研究。通过研究热水浸提时间、料水比及浸提温度对金花甜茶甜茶素和茶多酚浸提率的影响,以此确定最佳浸提条件,为金花甜茶开发成为饮料或口服液提供理论基础。
1 材料与方法
1.1 材料和设备
金花甜茶:华中农业大学发酵制作;甜茶:广西大瑶山;甜茶素标品(纯度>98%,色谱纯):上海源叶生物有限公司;茶多酚标品(≥99%,分析纯):山东西亚化学工业有限公司;硫酸亚铁、酒石酸钾钠、磷酸氢二钠、磷酸二氢钾(分析纯):上海展云化工有限公司;水系和有机系膜:天津津腾仪器设备有限公司;甲醇(色谱纯):美国默克有限公司。
循环水式多用真空泵(HSZ-D(III)):予华仪器有限公司;电子天平(CPA223S):赛多利斯科学仪器有限公司;液相色谱仪(Agilent 1260):美国安捷伦科技公司;皇代粉碎机(430):浙江金华铂欧五金厂;紫外可见分光光度计(UVmini-1240 型):岛津公司(日本);数显恒温水浴锅(HH-4CW):鸿科仪器厂;数控超声波清机(KQ5200DE 型):昆州市超声仪器有限公;高速离心机(HC-2517):中科中佳科学仪器有限公司。
1.2 方法
1.2.1 金花甜茶水提液的制备
精确称取3 份1 g 甜茶(40 目筛)粉末于150 mL锥形瓶中,加入若干体积的纯水,封口置于一定温度下热水浸提,期间晃动3 次,迅速抽滤得滤液,收集金花甜茶水提液。
1.2.2 甜茶素的高效液相色谱(high performance liquid chromatography,HPLC)测定方法
1.2.2.1 色谱条件
选择甲醇-水作为流动相,210 nm 为检测波长。色谱柱:Ultimate LP-C18(4.6 mm×250 mm,5 μm);检测器:Aglient 1260;柱温:20 ℃;色谱甲醇和水的体积比为 80 ∶20;流速:1.0 mL/min;进样量:20 μL。首次使用,经过测试液测定得理论塔板数大于20 000,平时测定过程不低于9 000。
1.2.2.2 色谱条件标准溶液的配制
色谱条件标准溶液的配制流程如图1 所示。

图1 甜茶素标准溶液的配制流程Fig.1 The preparing process of the standard solution of rubusoside
1.2.2.3 含量测定
1.2.3 金花甜茶多酚的测定
1.2.3.1 标准溶液配制
茶多酚标准溶液配制流程如图3 所示。
1.2.3.2 含量测定
茶多酚含量按照QB/T 4068-2010《食品工业用茶浓缩液》酒石酸亚铁比色法进行测定。
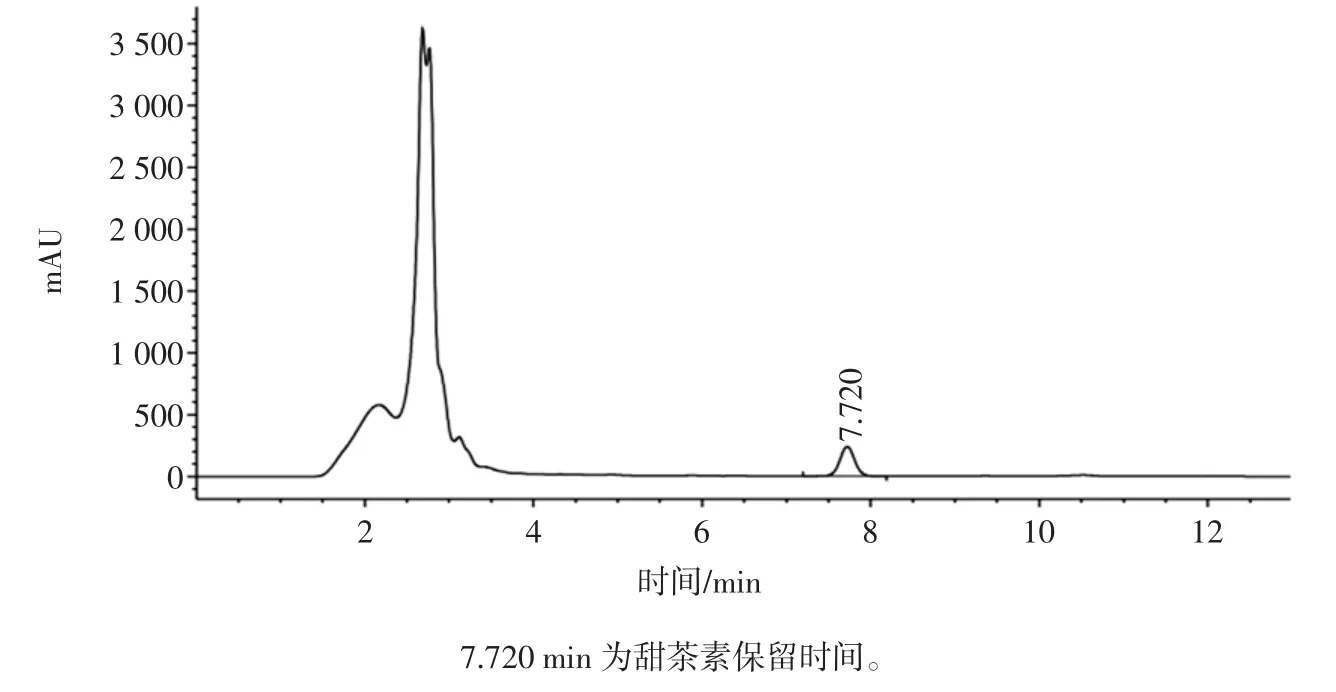
图2 金花甜茶浸提液甜茶素的HPLC 色谱图Fig.2 The HPLC chromatogram of the Eurotium cristatum sweet tea rubusoside

图3 茶多酚标准溶液的配制流程Fig.3 The preparing process of the standard solution of tea polyphenol
1.3 试验方法
1.3.1 金花甜茶甜茶素和茶多酚的浸提路线
金花甜茶→粉碎过筛(40 目)→热水浸提→过滤→茶多酚待测水提取液→离心→取上清液加入甲醇→甜茶素待测甲醇水溶液。
人工栽培的黄芩品质受栽培区域生态因子及田间管理影响较大,如山东莒县所产黄芩中黄芩苷含量显著高于甘肃产黄芩[4]。生产过程中,由于各地生态因子及田间管理差异,出现了施肥种类差异大、中耕除草难以规范以及农药不合理使用等现象[5],部分产区连作加重了黄芩根腐病的发生几率[6],农残重金属超标越发严重,以上因素单一或综合限制了黄芩药材的产量及品质,造成市售黄芩药材质量不一,影响药材药效,同时也影响临床用药安全和黄芩的市场竞争力。中药无公害栽培体系尚不完善[7],现阶段开展黄芩无公害栽培技术研究具有迫切性。
1.3.2 单因素试验
取 1 g 的金花甜茶粉末,按照料液比 1 ∶60(g/mL)加入纯水,在温度85 ℃下,浸提时间分别为 15、30、45、60、75、90、105、120、135 min,研究浸提时间对金花甜茶甜茶素和茶多酚浸提率的影响。每个试验重复3 次求平均值。
取1 g 的金花甜茶粉末,按照料液比分别为1 ∶10、1 ∶20、1 ∶30、1 ∶40、1 ∶50、1 ∶60、1 ∶70(g/mL)加入纯水,在浸提温度85 ℃下,浸提45 min,研究料液比对金花甜茶甜茶素和茶多酚浸提率的影响。每个试验重复3 次求平均值。
取 1 g 的金花甜茶粉末,按照料液比 1 ∶60(g/mL)加入纯水,在浸提时间为45 min 下,浸提温度分别为35、45、55、65、75、85、95 ℃,研究浸提温度对金花甜茶甜茶素和茶多酚浸提率的影响。每个试验重复3 次求平均值。
1.3.3 正交试验
在单因素基础上,以金花甜茶浸提时间(A)、料液比(B)、浸提温度(C)3 个因素,做L9(33)正交试验,对甜茶素和茶多酚浸提率影响进行研究。每个试验重复3 次求平均值。试验因素水平表如表1 所示。

表1 正交试验的因素水平表Table 1 Factor level of orthogonal test
2 结果与分析
2.1 单因素试验结果
2.1.1 浸提时间对金花甜茶甜茶素和茶多酚浸提率的影响
浸提时间对金花甜茶甜茶素浸提率的影响见图4。
由图4 可知,甜茶素随着浸提时间的延长呈先升高后稍微降低的趋势,在45 min 时达到最高。说明甜茶素在较短时间内传质过程就达到平衡。
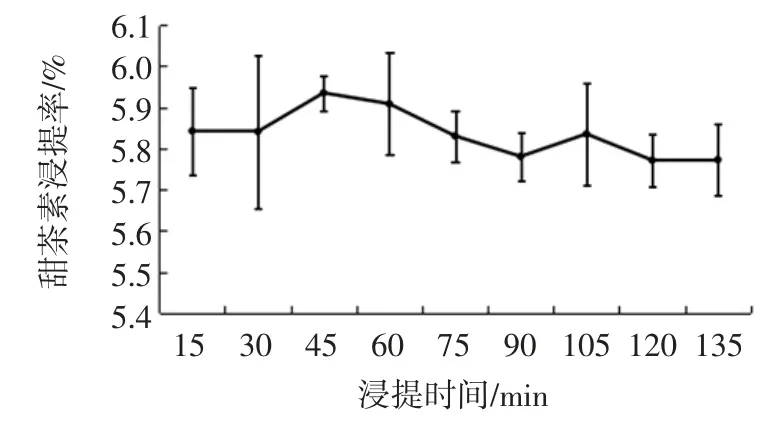
图4 浸提时间对金花甜茶甜茶素浸提率影响Fig.4 The effect of the extracting time on the extracting rate of the Eurotium cristatum sweet tea rubusoside
浸提时间对金花甜茶多酚浸提率的影响见图5。

图5 浸提时间对金花甜茶多酚浸提率影响Fig.5 The effect of the extracting time on the extracting rate of the Eurotium cristatum sweet tea polyphenol
由图5 可以看出,在15 min~60 min 之间茶多酚浸提率呈先增长后降低的趋势,45 min 时达到较高水平,茶多酚浸提率为12.25%,为最高值的98.3%;60 min~135 min 茶多酚浸提率也呈先增长后降低的趋势,75 min 时茶多酚浸提率达到最高。可能是在较长时间高温作用下,茶多酚发生氧化、水解等作用,使浸提率下降。综合考虑浸提时间对甜茶素和茶多酚的影响,确定最佳浸提时间为45 min。
2.1.2 料液比对金花甜茶甜茶素和茶多酚浸提率的影响
料液比对金花甜茶甜茶素浸提率的影响见图6。

图6 料液比对金花甜茶甜茶素浸提率影响Fig.6 The effect of solid-liquid ratior on the extracting rate of the Eurotium cristatum sweet tea rubusoside
料液比对金花甜茶多酚浸提率的影响见图7。

图7 料液比对金花甜茶多酚浸提率影响Fig.7 The effect of solid-liquid ratior on the extracting rate of the Eurotium cristatum sweet tea polyphenol
由图6 和图7 可以得出,随着溶剂体积的增加,金花甜茶的甜茶素和茶多酚浸提率呈逐渐增加的趋势,直到1 ∶60(g/mL)后维持平稳。这可能是因为溶剂体积较小时,浸提浓度很快达到平衡,抑制甜茶素和茶多酚的继续溶出;随着溶剂体积增大,物料内、外溶液的浓度差增大,促进甜茶素和茶多酚溶出。1 ∶70(g/mL)时金花甜茶甜茶素和茶多酚浸提率增加不明显。因为当溶剂体积增加到一定值时,金花甜茶的甜茶素和茶多酚基本溶出,即使继续增大溶剂体积,甜茶素和茶多酚浸提率增加很小。随着溶剂体积的增加,成本增加。综合考虑,确定最佳料液比为1 ∶60(g/mL)。
2.1.3 浸提温度对金花甜茶甜茶素和茶多酚浸提率的影响
浸提温度对金花甜茶甜茶素浸提率的影响见图8。

图8 浸提温度对金花甜茶甜茶素浸提率影响Fig.8 The effect of the extracting temperature on the extracting rate of the Eurotium cristatum sweet tea rubusoside
由图8 可以看出随着温度的增高,金花甜茶的甜茶素浸提率呈增大的趋势,75 ℃达到最高后保持稳定。
浸提温度对金花甜茶多酚浸提率的影响见图9。
由图9 可以看出,随着浸提温度逐渐增高,茶多酚的浸提率逐渐增加,95 ℃达到最大。这可能是因为升高温度使分子运动加剧,促进了扩散作用,甜茶素和茶多酚的溶解度增加;当温度升高到某个值时,金花甜茶内、外溶液的甜茶素浓度达到平衡,扩散作用达到动态平衡。因为过高的温度会导致茶多酚的降解,因此确定最佳浸提温度为85 ℃。

图9 浸提温度对金花甜茶多酚浸提率影响Fig.9 The effect of the extracting temperature on the extracting rate of the Eurotium cristatum sweet tea polyphenol
2.2 正交试验结果
金花甜茶甜茶素浸提率正交试验结果见表2。
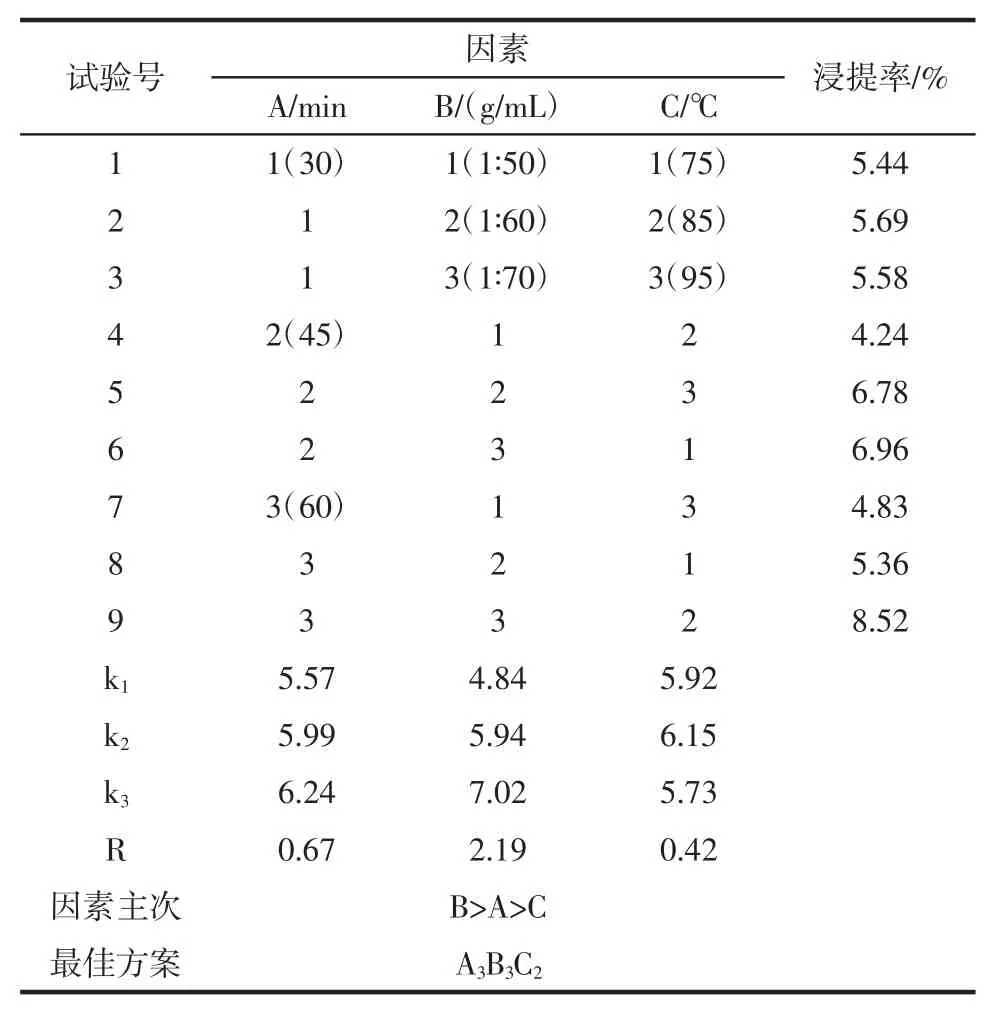
表2 甜茶素浸提率正交试验结果分析表Table 2 The result and analysis table of orthogonal experiment on the extracting rate of rubusoside
根据表2 的正交试验极差分析可知,影响金花甜茶甜茶素的各因素的主次顺序为:料液比>浸提时间>浸提温度。经过正交试验极差分析得出最优配方组合,即A3B3C2。而正交试验浸提率最高的组合也为A3B3C2。因此正交确定的最佳组合为A3B3C2。
金花甜茶多酚浸提率正交试验结果见表3。

表3 茶多酚浸提率正交试验结果分析表Table 3 The result and analysis table of orthogonal experiment on the extracting rate of tea polyphenol

续表3 茶多酚浸提率正交试验结果分析表Continue table 3 The result and analysis table of orthogonal experiment on the extracting rate of tea polyphenol
由表3 可以看出,影响金花甜茶茶多酚的各种因素的主次顺序为:料液比>浸提温度>浸提时间。经过正交试验极差分析已得出最优配方组合,即A2B3C2组合。而正交试验组浸提率最高的因素组合为A3B3C2。通过验证性试验可得,A3B3C2茶多酚浸提率为13.7%,而A2B3C2茶多酚浸提率为13.42%,A3B3C2茶多酚浸提率高于A2B3C2。综合考虑,可以得出正交结果A3B3C2最佳,即浸提时间为 60 min,料液比为 1 ∶70(g/mL),浸提温度为85 ℃最佳。
3 结论与讨论
本研究可得最佳浸提条件为:浸提时间是60 min,料液比是1 ∶70(g/mL),浸提温度是85℃。与向锋等[35]对甜茶中甜茶素和茶多酚浸提条件的研究得出的结果不同,可能是金花菌接种甜茶发酵过程中金花菌分泌的胞外酶的作用使甜茶的理化性质和化学成分发生变化,而这个过程有待深入研究。金花甜茶适合制作成饮料,故金花甜茶茶汤澄清、稳定性和货架期的预测等就成为进一步研究的重点。
