靶向CD93分子探针制备及其生物学实验研究
2020-03-09刘伟伟侯桂华
刘伟伟,梁 婷,张 超,曹 慧,侯桂华
(山东大学 生物医学同位素研究中心,山东 济南 250012)
肺癌是最常见的恶性肿瘤之一,发病隐匿,发病率和死亡率逐年增加,多数患者确诊时已处于晚期,因此早期诊断对于肺癌患者干预治疗和预后至关重要[1]。目前常用诊断手段,除临床症状外,主要包括CT、MR、核医学显像和血清肿瘤标记物检测等,但均缺乏特异性,难以揭示组织特异性病变。分子影像学在尚未发生解剖学改变前即可检出异常,为分子水平疾病的治疗奠定基础,其显像的关键是寻找高特异性和高敏感性的分子探针,因此肺癌早期诊断及靶向治疗的生物标志物成为研究的热点和重点[2]。放射性核素显像可在分子水平实时无创性监测疾病发生发展,可在疾病早期提供功能代谢方面改变的信息,因此临床亟需高特异性肺癌靶向的分子探针,对肺癌疾病进行早期诊断和预测预后,并为个体化靶向治疗提供基础。文献报道,利用肺癌细胞表面表达的分子标志物,如14C5[3],α3β1[4]进行放射性核素标记可以进行肺癌诊断及疗效评价,但特异性不高,靶向性不强,临床潜在应用有局限性。
血管生成参与多种生理病理过程,在实体肿瘤的发生发展中起关键作用[5]。近年来靶向肿瘤新生血管已成为临床肿瘤靶向诊断及治疗的重要手段[6]。研究较多的显像剂有血管内皮生长因子(vascular endothelial growth factor, VEGF)受体显像[7-8]、整合素αvβ3小分子多肽显像[9]、氨肽酶N(CD13)受体显像[10]。目前应用于临床的靶向VEGF药物如贝伐珠单抗已取得明显疗效[11],提示新生血管生成在肺癌发展过程中具有重要作用。然而报道的靶向新生血管的膜分子相关分子探针缺乏高特异性和高选择性。CD93是一种跨膜糖蛋白,主要表达在内皮细胞、血小板、干细胞及骨髓细胞(粒细胞和单核细胞),由细胞外部分组成,包括C型凝集素结构域、5个EGF样重复序列、富含丝氨酸/苏氨酸的粘蛋白结构域、跨膜结构域和含有moesin结合位点的短细胞质结构域。早期研究表明CD93是免疫分子,参与免疫细胞的黏附和穿越。目前文献报道CD93是一种新型血管生成激活剂,主要通过促进内皮细胞粘附促进肿瘤血管再生[12],影响肿瘤的生长。Elise等[13]报道血管CD93高表达与高级别胶质瘤患者的低存活率有关,Renate等[14]报道CD93基因多模态与结肠癌的转移有关,Bao等[15]研究发现CD93高表达促进了鼻咽癌患者血管生成和肿瘤生长。CD93在肿瘤血管的内皮细胞高表达,在非增殖的内皮细胞低表达[16]。CD93作为一种癌症相关蛋白,通过参与血管生成和细胞增殖促进恶性肿瘤的进展,最近研究已将CD93鉴定为人原发性肿瘤血管生成特征的前20个核心基因之一[17],与相对应的正常组织相比,癌组织CD93显著高表达。肺癌肿瘤组织是否表达CD93分子,临床上常规采用免疫组化分析。与免疫组化侵袭性检查相比,分子显像是一种非侵入式的全身动态扫描,更适合用于肺癌组织中CD93表达水平的监测。因此推测CD93有可能作为肿瘤新生血管发生发展过程中的关键分子,有望用于CD93阳性肿瘤的早期靶向诊断。但目前尚未见有关以CD93分子作为分子靶点,进行肿瘤监测及疗效评价的研究报道。
1 仪器与材料
1.1 主要仪器及试剂
Na125I 溶液:美国PerkinElmer 公司产品,由中国同辐有限公司提供;Iodogen(1,3,4,6-四氯-3α,6α-二苯基甘脲):美国Pierce公司产品;RPMI-1640培养液:美国 HyClone 公司;凝胶色谱柱 PD-10:美国GE Healthcare Life Sciences公司;CD93单克隆抗体(bs-10232R):Bioss公司提供;γ计数仪:美国CAPINTEC公司产品;薄层放射层析仪(TLC):美国Bioscan公司产品;Cyclone Plus磷屏扫描系统:美国PerkinElmer公司。
1.2 细胞株
肺癌A549细胞由山东大学生物医学同位素研究中心保存,解冻后置于含10%胎牛血清的RPMI-1640培养液中,并置于体积分数5% CO2、37 ℃、饱和湿度条件的细胞培养箱中传代培养。
1.3 实验动物
BALB/c裸鼠,雌性,体重18~22 g,4~6周龄。由北京维通利华公司提供,实验动物使用许可证号:SCXK(京)2016-0006,动物伦理批准号:ECSBM SSDU2018-2-014。饲养所用材料及物品均经高压灭菌处理。
2 实验方法
2.1 标记物的制备、放化纯度及稳定性鉴定
125I-anti-CD93 mAb(同种型125I-IgG)的制备:按照常规Iodogen 法标记抗CD93单抗(或等量同种型IgG) ,并用PD-10凝胶柱纯化。本次实验使用抗CD93单抗(或同种型IgG)抗体10 μg(1 g/1 L) ,Na125I溶液12 MBq。用γ计数仪测量放射性计数,计算125I-anti-CD93 mAb(125I-IgG) 标记率和比活度。采用纸层析法分析放化纯度。Whatman No.1 滤纸为支持物,0.9%生理盐水和甲醇(1∶2)混合液为展开剂。
体外稳定性分析:采用纸层析法于24、48、72 h测量标记物在生理盐水(NS)、人血清(serum)的稳定性。
2.2 肺癌荷瘤小鼠模型的建立
待培养瓶中细胞长至80%~90%时,0.25%胰酶消化、传代,至细胞扩增至所需数量,收集呈对数生长期细胞,调整细胞悬液浓度为5×107/mL,将细胞悬液接种于BALB/c裸鼠右前肢肩部皮下,0.2 mL/只,建立荷瘤动物模型,共40只。所有操作均在无菌超净台内进行。建模后常规饲养,每天用游标卡尺测量肿瘤最大径,待其最大径达0.8~1.0 cm时进行实验。
2.3 体外细胞结合实验
细胞结合实验:将生长状态良好的A549细胞(2×105/孔)接种于24孔板上,细胞培养箱中培养过夜;按浓度梯度(3~100 nmol/L)加125I-anti-CD93 mAb,于37 ℃孵育2 h,移除上清液,冰PBS洗涤两次,1 mol/L NaOH裂解细胞,用γ计数仪测量裂解液放射性计数。
阻断实验:将生长状态良好的A549细胞(2×105/孔)接种于24孔板上,细胞培养箱中培养过夜;加入125I-anti-CD93 mAb(20 nmol/L)及未标记的抗CD93抗体(0、1.42、14.20、28.40 nmol/L),于37 ℃孵育2 h,移除上清液,冷PBS洗涤两次,1 mol/L NaOH裂解细胞, 用γ计数仪测量裂解液放射性计数。
2.4 荷瘤鼠体内生物学分布
随机选取30只荷瘤鼠,提前 48 h用 3%(w/v)的NaI溶液封闭甲状腺。分别经尾静注射125I-anti-CD93 mAb或125I-IgG, 0.37 MBq/只,注射后24、48、72 h,每组随机选取5只小鼠摘眼球取血,并将小鼠脱椎处死,取骨、肾、脾、甲状腺、肝、肠、心、肺、肿瘤及肿瘤对侧肌肉称重并测定其放射性(cpm)。计算肿瘤(T)与对侧肌肉组织(NT)的放射性计数比值(T/NT)。测定注射标记物标准源的放射性,计算每克组织或器官的放射性占标准源放射性的百分比(%ID/g)。
2.5 荷瘤鼠全身动态磷屏自显影
将10只荷瘤鼠随机分为2组,分别经尾静脉注射125I-anti-CD93 mAb或125I-IgG, 0.37 MBq/只,注射后24、48、72 h用0.6%戊巴比妥钠麻醉,将其腹侧朝上,背侧紧贴磷屏采集板,四肢伸直并用胶带固定,暗处理20 min后,迅速将磷屏放于扫描仪进行图像采集。使用 OptiQuantTM图像分析软件对比分析上述扫描图像:在每张图像的感兴趣区(regions of interest, ROI)选取矩形区域,利用软件测定每个区域中每平方毫米的数字光单位 DLU/mm2(digital light units per mm2),计算肿瘤部位的放射性比活度与其对侧肌肉区域的放射性比活度的比值。
2.6 HE染色及免疫组织化学染色
随机选取磷屏自显影显像后的荷瘤鼠并处死,分离出肿瘤组织,置于4%的多聚甲醛固定24 h,将固定好的组织制成石蜡切片,按试剂盒要求进行HE染色及CD93免疫组织化学染色。将样本片置于光学显微镜下,在200×视野下观察拍照,每张标本片随机选择多个视野,计算CD93染色阳性细胞百分率。
2.7 统计学分析
3 实验结果
3.1 探针制备及稳定性分析
成功制备125I-anti-CD93 mAb和125I-IgG。两种标记物洗脱曲线均可显示其蛋白峰和游离峰。125I-anti-CD93 mAb的标记率为91.37%,放射性比活度为1 096.44 MBq/mg。125I-IgG标记率为90.24%,放射性比活度为1 082.88 MBq/mg。125I-anti-CD93 mAb 和125I-IgG 的放化纯度分别为96.49%、94.82%。两种标记物的标记率、放射性比活度及放化纯度无显著差异,P>0.05。将125I-anti-CD93 mAb和125I-IgG在室温下放置24、48、72 h后,纸层析法测得其稳定性结果示于图1,在生理盐水(NS)和人血清(serum)中两种标记物稳定性好,至 72 h仍维持在 90%以上,且血清及生理盐水组未见明显差异。两种标记物的稳定性无显著差异。
3.2 125I-anti-CD93 mAb结合、阻断分析
细胞结合实验分析结果示于图2a,A549 细胞对125I-anti-CD93 mAb亲和力较好,Kd值为27.09 nmol/L。阻断实验分析示于图2b, CD93抗体对A549细胞与125I-anti-CD93 mAb结合的阻断率分别为24%、49%、60%,抗体的含量与阻断率成正比,显示未标记抗CD93 mAb与A549细胞可以竞争结合标记物125I-anti-CD93 mAb,结果提示125I-anti-CD93 mAb对A549细胞具有靶向性,CD93分子可作为监测A549肺癌的分子靶点。
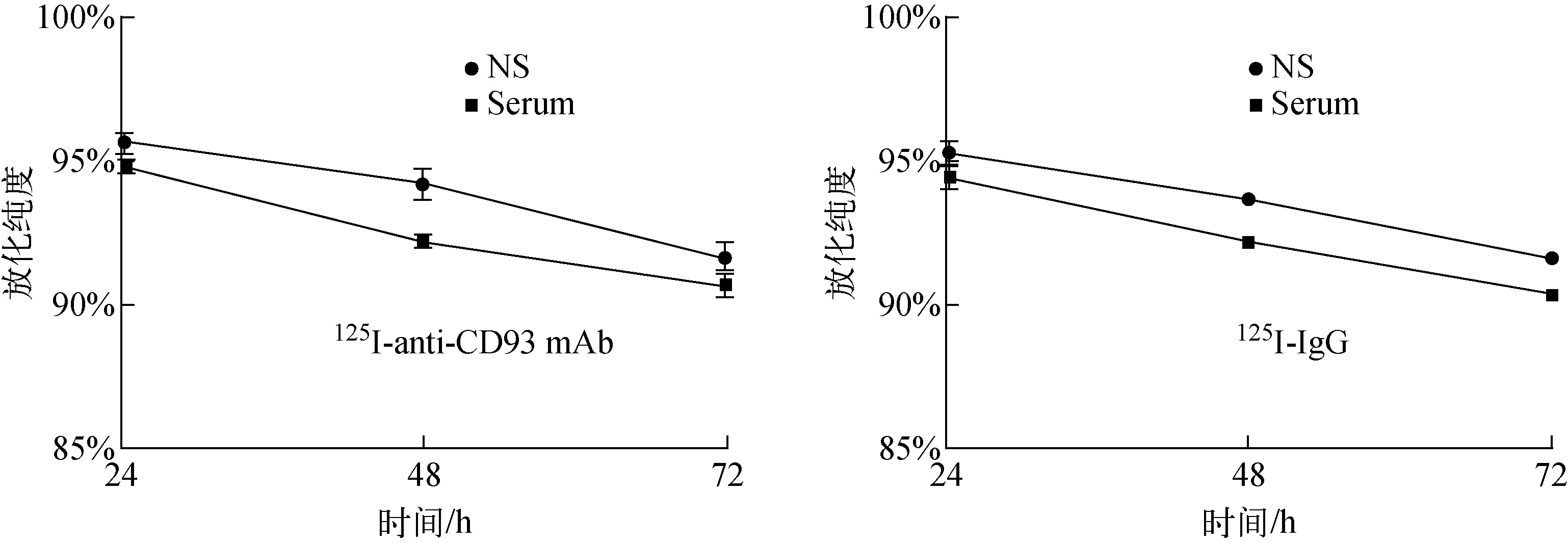
图1 稳定性分析
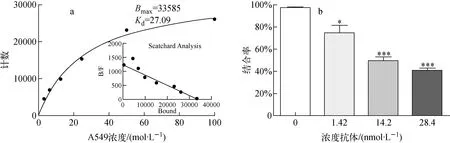
图2 体外结合及阻断分析
3.3 探针在A549肺癌荷瘤鼠模型中生物学分布
经尾静脉给荷瘤鼠分别注射125I-anti-CD93 mAb和125I-IgG ,于24、48、72 h处死小鼠,收集主要器官及组织,称重,并测量其放射性,分析标记物在体内的生物学分布状况。注射后48 h体内生物学分布结果列于表1,可见两标记物生物学分布趋势大致相同,肾、肝、脾放射性计数较高,提示标记物主要经肝肾排泄;肿瘤处放射性计数高,而封闭的甲状腺、骨、肌肉、血放射性计数较低。注射48 h后125I-anti-CD93 mAb和125I-IgG肿瘤放射性摄取分别为(6.42±0.71)%ID/g和(2.45±0.33)%ID/g,前者明显高于后者(P<0.05)。两种标记物在模型鼠体内T/NT(肿瘤/对侧肌肉组织)放射性摄取比示于图3,125I-anti-CD93 mAb和125I-IgG注射后 24、48、72 h T/NT比值分别为(2.42±0.14)/(1.30±0.02),(4.45±0.86)/(1.71±0.24)和(2.69±0.13)/(1.68±0.25),48 h两标记物T/NT比值差异最为明显(P<0.05)。结果表明,与对照组125I-IgG相比,CD93靶向探针注射后肺癌肿瘤放射性浓聚明显高于对照组125I-IgG,且在注射后48 h肿瘤放射性计数最高,同时T/NT比值最高。两标记物注射后模型鼠不同器官与血的放射性摄取比示于图4,125I-anti-CD93 mAb标记物注射后72 h靶/血比值为4.32±0.20,125I-IgG仅为1.10±0.12,表明125I-anti-CD93 mAb在肿瘤部位特异性分布;两标记物肾/血、肝/血、脾/血比值之间无明显差异。
表1 标记物在荷瘤鼠体内生物学分布

图3 标记物注射后不同时间靶与非靶放射性摄取比
3.4 荷瘤鼠动态全身磷屏自显影
125I-anti-CD93 mAb注射组磷屏自显影显像结果示于图5a。注射24 h后,小鼠轮廓清晰可见,但本底较高;48 h时可见肿瘤部位有明显放射性浓聚,而对侧肌肉组织则未见放射性浓聚,两者之间差异明显。72 h时小鼠肿瘤放射性浓聚程度下降,小鼠轮廓仅隐约可见。125I-IgG注射组自显影结果示于图5b,注射显像剂24 h后,小鼠轮廓清晰,无明显特异性浓聚;48 h可见肿瘤放射性浓聚,但较125I-anti-CD93 mAb组低,且对侧肌肉组织亦未见放射性浓聚,肿瘤组织和对侧肌肉间显像差异不明显。72 h小鼠显像接近本底。

图4 标记物注射后不同时间不同器官与血的放射性摄取比
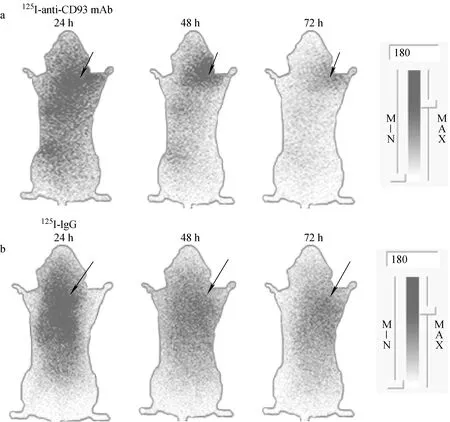
图5 荷瘤鼠磷屏自显影显像
经放射性浓聚半定量分析磷屏自显影显像结果,125I-anti-CD93 mAb注射组48 h肿瘤显像最为清晰,该时间点肿瘤放射性活度值为(76 740±3 430) DLU/mm2,而对侧肌肉组织为(23 020±581.8) DLU/mm2。125I-IgG组肿瘤未见明显的放射性浓聚。125I-anti-CD93 mAb 48 h肿瘤放射性活度比最高3.34±0.18,而24、72 h分别为1.37±0.17和1.67±0.09。125I-IgG注射组24、48、72 h肿瘤放射性活度比分别为1.23±0.02、1.62±0.19、1.17±0.04。
3.5 肿瘤组织HE染色及CD93免疫组织化学染色
荷瘤鼠肿瘤组织HE及CD93免疫组织化学染色结果示于图6。肿瘤组织高表达CD93(棕色),主要在膜上,阳性率为(59.22±0.28)%。免疫组织化学染色结果与磷屏自显影显像中CD93靶向标记物肿瘤放射性高浓聚状况一致。

图6 肿瘤组织HE(a)及CD93免疫组化(b)染色(200×)
4 讨论
肺癌死亡率居全球恶性肿瘤首位,早期阶段症状很少或缺乏,一般确诊时间都为晚期。早期诊断早期治疗是提高生存率的关键。18F-FDG作为一种葡萄糖代谢显像剂,常出现假阳性和假阴性,从而使得对肿瘤的监测缺乏特异性。因此寻找新型分子靶点进行核素分子显像研究,有可能为肺癌的分子诊断和治疗提供新的手段。血管生成是恶性肿瘤发生发展的关键步骤[18],CD93作为在血管内皮中优先表达的高度糖基化跨膜蛋白,参与内皮细胞的增殖、迁移和新生血管生成。因此CD93有望成为早期肺癌监测的分子靶点。
本实验室前期研究表明,A549肺癌细胞系高表达CD93分子。为证实制备的分子探针125I-anti-CD93 mAb对A549肺癌体内体外均具有良好的靶向性,本文设计两个对照:一是体内探针利用同种型125I-IgG,二是体外阻断实验。本研究使用的CD93单抗虽为大分子蛋白,但荷瘤鼠体内生物学分布和放射自显影影像研究结果都证实,在注射碘标记物24 h后,显像剂即可到达肿瘤部位,表明标记物可参与荷瘤鼠体内代谢,可在肿瘤部位浓聚,这使利用CD93作为分子靶点,对肺癌早期监测成为可能。125I-anti-CD93 mAb能够在肺癌聚集,与肺癌高表达CD93直接相关,证实是一种CD93特异性肿瘤靶向分子探针。
本文研究中发现,荷瘤鼠肺、心脏放射性计数较低,接近本底,这对降低本底干扰,更有利于对肺癌的靶向诊断具有重要意义。需要指出的是本文仅研究了125I-anti-CD93 mAb在A549细胞荷瘤模型中的生物学分布和肿瘤靶向性,下一步需要对CD93表达水平不同的多种肺癌细胞系进行深入研究。此外CD93单抗相对分子质量大,放射性碘标记分子在生物体内易解离,下一步将选择新的核素以及抗CD93小分子抗体片段,对CD93靶向分子进行标记和进一步体内靶向研究。
5 小结
本研究成功制备一种新型分子探针125I-anti-CD93 mAb,制备方法简便,标记率及放化纯度均较高,在血清及生理盐水中稳定性较好,并首次研究了该探针对人肺癌A549荷瘤鼠模型肿瘤的靶向监测性,为以CD93为靶点对肺癌进行诊断提供了新的实验依据,因此对于肺癌的诊断可能具有潜在应用价值,并有望用于其他CD93表达阳性的肿瘤显像,值得进一步深入研究。
