5 L发酵罐中粪肠球菌发酵工艺参数优化
2020-03-09郭建军熊大维魏国汶杜建华
郭建军, 熊大维, 曾 静, 魏国汶, 杜建华, 袁 林*
(1.江西省科学院微生物研究所,江西南昌 330096;2.南昌工学院,江西南昌 330108)
粪肠球菌是人和动物肠道的一类重要菌群,可参与机体多种代谢活动 (Ben等,2018;Hwanhlem等,2017),从健康动物肠道分离的有益粪肠球菌可作为动物微生态制剂,替代抗生素调节动物肠道平衡,提高抵抗力,抑制病原菌繁殖,防治动物的一些肠道疾病等 (Amachawadi等,2018;Allameh 等,2017; Chen 等,2017)。 影响菌株生产能力的因素不仅包括菌种本身的生理性能,还有外界的环境条件(胡红伟等,2019;白文妹等,2017)。所以通过优化菌株的培养条件可改进发酵过程。
高密度培养是指在一定的培养条件和体系内,应用一定的培养技术在不影响胞内产物积累的基础上,尽可能多的提高生物量 (刘开放等,2019)。研究表明,影响粪肠球菌增殖的因素有很多,如菌种的活力、培养代数、培养周期、培养液的初始pH、培养温度、培养时间、接种量和增殖因子等 (吴军林等,2018;焦月华等,2016;乔琳等,2015)。乳酸菌要通过高密度培养技术有效的降低代谢产物浓度从而消除反馈抑制、降低发酵液的黏度、增大体系初始溶氧浓度达到理想的高浓度活菌含量,需要优化一系列相关的工艺参数,从而对发酵过程进行严格的控制(刘香英等,2018)。目前已有一些对粪肠球菌益生菌高密度培养研究,但仅限于实验室规模的小试水平,鲜见大规模中试水平的报道。本文在前期摇瓶发酵的基础上研究了5 L机械搅拌罐中的发酵情况,对其中影响粪肠球菌生长的主要因素,如气体环境、搅拌速度、中和剂、发酵恒定pH和碳源添加量等进行了考察,从而优化粪肠球菌在发酵罐中的发酵条件,为后续中试及生产放大提供一定的数据基础。
1 材料与方法
1.1 试验材料 供试菌株:粪肠球菌EXW27由本实验室从健康仔猪肠道黏膜上选育并保藏。
种子和发酵培养基(g/L):葡萄糖20 g、蛋白胨 20 g、酵母粉 9.0 g、柠檬酸氢二铵 3.5 g、K2HPO4·7H2O 3.75 g、NaAc·3H2O 6.25 g、MgSO4·7H2O 1.0 g、MnSO4·H2O 0.45 g、组氨酸 1.4 g、碳酸钙 10 g,pH 7.2,115 ℃灭菌 20 min。
1.2 试验方法
1.2.1 菌体培养 将保存在-20℃的菌种解冻后,接入制备好的种子培养基中,37℃、150 r/min条件下培养18 h即得到种子液。发酵罐初始培养条件:将种子液以3%(V/V)接种于装液量为70%的5 L小罐,搅拌转速100 r/min,不通气,恒定pH 6.2,37℃恒温培养至发酵结束。
活菌含量计数方法采用固体MRS倾注法,将待测发酵液用灭菌的磷酸盐缓冲溶液按10倍梯度稀释,至适宜梯度后取1 mL稀释液加入培养皿中,用MRS琼脂培养基倾注平板,于37℃培养48 h后计菌落总数,每个梯度3个平行值,结果以cfu/mL表示。
1.2.2 分批发酵条件优化 在5 L液体发酵罐中对粪肠球菌分批进行单因素试验,选取影响因素包括气体环境、搅拌速度、中和剂、发酵恒定pH和碳源添加量等进行优化,以最终收获的发酵液中活菌数作为高密度发酵工艺的优化指标。每一步优化的结果都用于下一步的发酵过程中,根据不同条件下菌体的生长情况逐步确定最佳的小试发酵工艺。
在单因素试验的基础上,选取对E.faecalis EXW27生长影响大的三个因素:搅拌转速、发酵恒定pH、碳源添加量,以乳酸菌活菌数为响应值,利用Design Expert 8.0.6软件进行3因素3水平的Box-Behnken Design(BBD)响应面设计,通过试验数据拟合得到二阶响应面模型,最终确定最优试验条件。
1.2.3 补料分批培养 在分批培养最佳条件的基础上,将种子液接种于5.0 L机械搅拌罐中,pH反馈补料分批培养,pH控制与补料关联的参数设置为反向关联,当pH大于设定值时启动补料,在其他条件相同的情况下,以不补加葡萄糖发酵作为对照组。每隔2 h取样,检测发酵液中菌体活菌数。
1.3 数据处理 试验所用到的数据分析软件:Design-Expert(8.0.6b),SPSSStatistics(17.0)。
2 结果分析
2.1 单因素试验结果
2.1.1 不同通气方式对菌体生长的影响 本试验研究不同的通气条件[a.空气(V(N2): V(O2)=79:21),b.氮气,c.混合气体(V(N2):V(H2):V(CO2)=80:10:10)]保压 0.02 Mpa 对菌体生长的影响,以不通气作对照,试验结果见图1。
从图1中可以看出,不同的通气条件对菌株EXW27的生长影响差异不显著。在空气保压的条件下进行发酵培养时的发酵液活菌数最高,氮气保压和混合气体保压对菌体的生长无明显促进作用,活菌数比空气保压时低,这表明发酵培养过程中的溶氧浓度对菌株EXW27的生长有促进作用,故选择通空气保压。
2.1.2 搅拌速度对菌体生长的影响 提高搅拌转速可以增加溶氧量,图2表明,从发酵开始至发酵4 h处,3种转速条件下的菌株生长情况一致,随后,转速为200 r/min菌株的生物量呈现先指数增加后缓慢减小的趋势,转速为100 r/min和300 r/min菌株的生物量上升缓慢。这说明,搅拌转速对菌株E.faecalis EXW27的生长具有显著的影响,过低会造成供氧不足,从而影响菌体生长;转速过高产生的剪切力会对菌体造成一定损伤,使其过早衰亡或自溶。
2.1.3 不同中和剂对菌体生长的影响 本试验比较12.5%氨水、4M NaOH溶液和3M Ca(OH)2溶液等不同的中和剂对试验菌种生长的影响,试验结果如图3所示。
从图3可看出,使用不同的中和剂菌体的生长过程相似,随着碳源的消耗菌体浓度不断升高,稳定期时用12.5%氨水做中和剂,发酵液活菌数达到了21.23×109cfu/mL,显著高于用4M NaOH溶液和3M Ca(OH)2溶液做中和剂时的发酵液活菌数(P<0.05)。以氨水作为中和剂,既可以调节培养液的pH,也可作为氮源被菌体利用,促进菌体的生长,氢氧化钠与氢氧化钙的效果明显不如氨水,可能是在补碱的过程中使培养液中盐离子浓度过高,影响了细胞内外渗透压与细胞内外物质的运输,不利于菌体的生长,因此选用12.5%氨水做中和剂。
2.1.4 不同pH对菌体生长的影响 由图4可知,恒定不同pH对E.faecalis EXW27菌体生长影响差异性显著(P<0.05),pH维持较低水平时发酵时间偏长,且活菌数最低;pH维持较高水平时产酸量大,导致发酵培养的对数期时间较短。当发酵恒定pH为5.8时,E.faecalis EXW27进入对数生长期明显加快,发酵时间适中,且发酵液活菌数最高,达到了22.97×109cfu/mL,综合考虑,确定E.faecalis EXW27发酵恒定pH为5.8。
2.1.5 初始糖浓度对菌体生长的影响 为满足菌体生长繁殖的需要,本试验中将初始糖浓度从20 g/L逐渐增至50 g/L,发酵结果见图5。
结果表明原培养基中的糖浓度无法满足菌体在小试培养条件下的生长需求,提高初始糖浓度发酵至稳定期发酵液活菌数有显著提升 (P<0.05),但当初始糖浓度大于40 g/L发酵液活菌增加不明显,说明较低浓度的糖对于菌体是一种碳源饥饿状态。由于当初始糖浓度为40 g/L时,进入稳定期时间较其他处理最短,因此将培养基初始葡萄糖浓度调为40 g/L。
2.2 响应面试验结果 在单因素试验的基础上,确定主效应因素为搅拌转速、发酵恒定pH、碳源添加量,采用Box-Behnken设计原理,对E.faecalis EXW27培养条件进行了3因素3水平试验,以发酵液活菌数(R)为响应值,试验设计及结果如表1所示。
通过Design-Expert 8.0.6软件对表1中所得数据ANOVA分析,各因素经过拟合得到的二次多项式回归模型方程为R=-93.653+29.061X1+0.658X2+ 0.049X3-0.025X1X2+0.004X1X3-0.001X2X3-2.601X12-0.005X22-0.001X32。
对回归模型进行可信度分析和方差显著性检验分析见表2。二次回归模型的决定系数R2=0.99516,修正后决定系数R2Adj=0.98894,说明有98.89%的差异可用此回归模型来解释;模型的P值为0.0001<0.01,F值为373.53,均可说明此模型显著。且回归方程中失拟项检验不显著(P值为0.8268),说明未知因素对发酵液活菌数干扰性小,方程拟合度好。对于模型回归方程系数的显著性试验表明,一次项系数X1、X2、X3,二次项X12、X22、X32和交互项X2X3对发酵液活菌数影响极显著,交互项X1X2和X1X3可显著影响发酵液活菌数。综合表明该模型与试验值拟合很好,能够较好地反映菌株E.faecalis EXW27发酵活菌数与搅拌转速、发酵恒定pH、碳源添加量之间的关系,因此所得的回归方程能较好地预测E.faecalis EXW27液体高密度培养的活菌数在不同小试工艺条件下的变化规律。

表1 响应面试验设计及结果
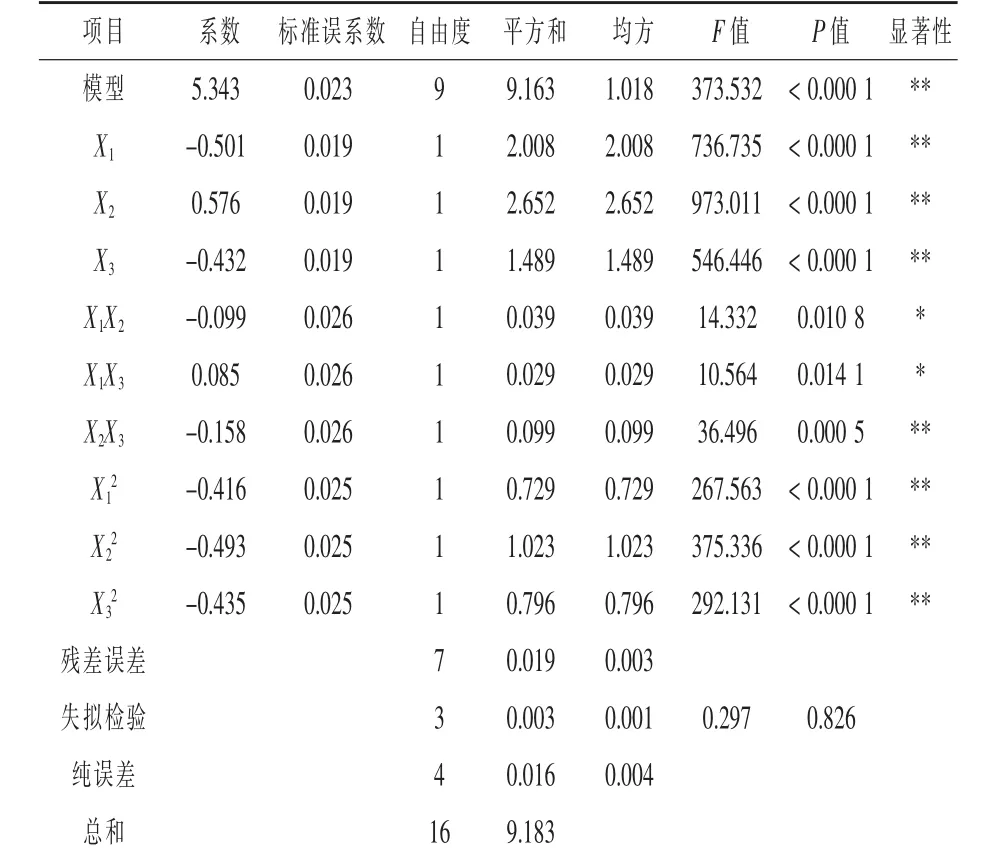
表2 回归方程的方差分析
固定其中的一个因素,做另外两个因素交互作用的曲面图及等高线图,确定搅拌转速、发酵恒定pH、初始糖浓度对菌株发酵培养的活菌数含量的影响。由图6可知,搅拌转速、发酵恒pH、初始糖浓度两两交互作用对乳酸菌数的影响均出现抛物面型关系,所得到的响应面都存在一个极大值点,其中,初始糖浓度和搅拌转速的交互作用极显著,搅拌转速和发酵恒定pH的交互作用较弱。在一定培养时间下,乳酸菌活菌数随着培养初始糖浓度的上升而呈现上升趋势,在48 g/L时达到最高值,之后随着糖浓度升高而呈现下降趋势。在固定初始糖浓度时,随着搅拌转速的增加,乳酸菌数出现先增加后降低的趋势。
经过响应面优化,根据拟合二阶模型公式得到理论上的各因素的最佳培养条件为:发酵恒定pH 5.49、初始糖浓度47.74 g/L、搅拌转速164.42 r/min。为了验证响应面模型的有效性,考虑到实际操作的方便性,将各因素修正为发酵恒定pH 5.5、初始糖浓度48 g/L、搅拌转速165 r/min,在此修正条件下进行3次平行试验,得出发酵液活菌菌数实际值为33.86×109cfu/mL,与预测值34.94×109cfu/mL较为接近,说明采用响应面法得到的该模型结果较为可靠,具有一定实用价值。
2.3 pH反馈补料分批培养 在pH控制与补料相关联的补料分批培养过程中,通过反向关联的方式,以pH为信号来流加葡萄糖液,即当pH大于5.5时启动补料,反之停止补料。补料前的培养过程,通过流加酸碱使pH保持在5.5。流加模式为加2 s,停10 s,补料分批培养过程中,在发酵开始阶段,发酵液的pH降低,蠕动泵自动加入12.5%氨水溶液使发酵过程中的pH维持在5.5,当葡萄糖消耗殆尽之后由于氨基酸的脱氨基作用使pH增加,当pH高于5.5时,补料泵自动加入葡萄糖液。
从图7可看出,补料发酵的条件下,菌体的对数生长期延长至18 h,显著提高了发酵液活菌含量,菌体最终浓度在37.99×109cfu/mL以上,比对照组无补料分批发酵最终活菌浓度提高了11.2%,说明pH反馈流加补料发酵方式优于分批发酵方式。这些结果进一步表明,提高碳源添加量是提高发酵液活菌数的有效方法。
3 讨论
试验通过5 L发酵罐发酵粪肠球菌,初步研究粪肠球菌的液体发酵条件,发现气体环境、搅拌速度、中和剂、发酵恒定pH和初始糖含量等都会不同程度的影响粪肠球菌在发酵罐内的生长。E.faecalis EXW27属于兼性厌氧菌,对溶氧量要求较为严格,因此选择合适的气体环境和搅拌转速对EXW27液体发酵是必要的;乳酸菌培养过程中将培养基的糖类代谢为有机酸,培养后期有机酸大量积累对菌体生长产生抑制作用,为减轻培养过程中高酸环境对菌体生长的抑制,通过流加中和剂使培养液的pH维持在菌体最适生长范围内可以有效缓解这种抑制作用,从而提高菌体的生长密度。针对不同的微生物或不同培养基质,不同的中和剂所能达到的效果也不尽相同。本研究发现用12.5%氨水控制pH稳定在粪肠球菌EXW27最适生长范围,可以促进菌体的生长,提高单位体积内的活菌数,原因可能是氨水能中和发酵过程中过多的有机酸,又能为菌体生长提供氮源,因此,解决乳酸菌菌体浓度低的方法有很多,但必须结合工艺过程的整体特点,全方位考虑才能使菌体浓度达到高密度。本研究分析了气体环境、搅拌速度、中和剂、发酵恒定pH和初始糖含量等对菌体生长的影响,减少代谢产物形成并使菌体以最大生长率达到高密度培养,逐步优化菌体的小试发酵工艺,使得发酵液最终活菌数在37.99×109cfu/mL 以上。
4 结论
本试验结果表明,粪肠球菌EXW27的小试发酵工艺为:将种子液以3%(V/V)接种于装液量为70%的5 L小罐,搅拌转速165 r/min,通空气保压0.02 Mpa,自动流加12.5%的氨水控制pH恒定为5.5,当pH高于5.5流加葡萄糖补料发酵18 h,减少代谢物有机酸形成,减轻酸环境对菌体生长的抑制作用,延长生长期,最终发酵液活菌数为37.99×109cfu/mL。
