Ni-Ti-LDHs纳米片对阿司匹林的负载与缓释
2020-03-08胡丽芳刘柳何杰孙志鹏陈小平
胡丽芳, 刘柳, 何杰, 孙志鹏, 陈小平
Ni-Ti-LDHs纳米片对阿司匹林的负载与缓释
胡丽芳, 刘柳, 何杰, 孙志鹏, 陈小平
(安徽理工大学 化学工程学院, 淮南 232001)
采用插层法和剥离–重组法制备了阿司匹林–双金属氢氧化物复合物(A-LDHs)和阿司匹林-双金属氢氧化物纳米片复合物(A-LDHs-NS)。采用XRD、SEM、TG-DTG和FT-IR对复合物的形貌、载药性能和载药模型进行表征。测定了阿司匹林在不同pH环境中从A-LDHs和A-LDHs-NS上的释放性能。研究发现, 实验制备的LDHs和LDHs-NS均具有明显层状结构。LDHs-NS因具有较大的比表面积(187 m2·g–1)能负载更多的阿司匹林。同时, LDHs-NS与阿司匹林之间有较强的相互作用, 载药量为1.178 mmol·g–1, 释放时间超过1440 min, 与对照组(20 min)相比, 表现出更优异的缓释性能, 且在pH为7.4的磷酸盐缓冲溶液中缓释性能比在pH为4.8中更强。本研究结果可以为二维材料在生物医药中的应用提供参考。
阿司匹林;双金属氢氧化物纳米片;负载;缓释性能;相互作用模型
药物控释对于提高药物疗效、降低药物的毒副作用以及减少给药次数, 以减轻病人的痛苦具有重要意义[1-3]。阿司匹林作为一种传统的非甾体抗炎药, 近年来在高血压、糖尿病以及恶性肿瘤等慢性疾病的预防和治疗方面具有较好的药效[4-6]。不过, 普通的阿司匹林在体内快速水解成水杨酸后对胃肠道粘膜有刺激作用, 长期服药可能导致胃溃疡、胃出血等并发症[7-8]。因此, 使用适当的药物载体实现阿司匹林的控释, 有利于平衡阿司匹林血药浓度、降低用药频率、减弱对胃肠道粘膜的刺激。
层状双金属氢氧化物(LDHs)因其层板可调、层间离子可交换以及记忆效应等特点, 在阿司匹林的负载及缓释方面具有广泛应用[9-13]。Carja等[14]通过共沉淀和重组两种方法将阿司匹林与负载磁性FeO的层状Mg-Al-LDHs复合, 构建了阿司匹林与LDHs复合材料, 为药物负载于LDHs提供了方法。吕凤柱课题组[15]以层状Zn-Al-LDHs为载体, 采用Carja方法构建了与阿司匹林的复合材料, 并发现其在pH=6和pH=8时缓释率分别为98.12%和81.22%, 在pH=8的环境中释放更缓慢。这些研究在探索层状材料用作药物载体及其表征和评价方法方面具有开创意义, 但这些研究均未对阿司匹林的载药量作定量研究。若缓释载体的载药量小、释放快将导致药效时间短;若载药量小、释放慢, 可能导致释放浓度低于药物的有效作用浓度, 达不到预防和治疗效果;而载药量大且释放快, 则容易导致阿司匹林中毒。因此, 提高阿司匹林载药量、降低释放速度、调控载药量与释放速度之间的关系, 是药物控释载体材料需要解决的重要问题。
本研究以生物相容性良好[16]的Ni-Ti-LDHs作为本体材料, 通过剥离组装法构建了阿司匹林与LDHs纳米片的复合物;通过控制纳米片大的比表面积及充分暴露的负载活性位调节载药量与释放速度的关系, 实现了较大的载药量和较好的缓释性能。
1 实验方法
1.1 材料制备
Ni-Ti-LDHs纳米片(Ni-Ti-LDHs-NS)溶胶的制备: 将0.5 g前体Ni-Ti-LDHs加入到100 mL甲酰胺溶液中, 使用超声辅助剥片直至溶液中的固体充分分散, 采用9000 r·min–1离心, 得到绿色胶体溶液, 即为Ni-Ti-LDHs-NS溶胶。胶体溶液中加入200 mL的0.25 mol·L–1的NaOH溶液和800 mL的去离子水, 静置至溶液中出现絮状沉淀, 过滤、干燥即得Ni-Ti-LDHs-NS。Ni-Ti-LDHs的制备过程参见之前文献报道[17]。
1.2 阿司匹林负载实验
按照阿司匹林与Ni-Ti-LDHs(或Ni-Ti-LDHs- NS溶胶)物质的量的比为1 : 1、1 : 2、1 : 5的比例将两者混合。60 ℃搅拌反应2 h, 静置24 h后将下层固体经过滤、水洗及真空60 ℃干燥, 即得复合材料, 分别简记为A-LDHs-1、A-LDHs-2、A-LDHs-5、A- LDHs-NS-1、A-LDHs-NS-2和A-LDHs-NS-5(A指阿司匹林)。
1.3 样品表征
采用DX-2800型X射线衍射仪(丹东方圆仪器有限公司)表征样品的晶型和微结构。Cu靶, K辐射,波长0.15406 nm, 管压40 kV, 管流30 mA。采用TESCAN VEGA 3 SBH型扫描电子显微镜(捷克TESCAN)表征样品的形貌特征, 测试电压30 kV。采用ASAP 2020型全自动物理化学吸附仪(美国麦克)测试样品的比表面积, 用高纯氮气作为吸附气。采用TGA/DSC 3+(梅特勒–托利多/METTOLER TOLEDO)表征样品的热稳定性和载药量, 氮气为载气, 以5 ℃·min–1的速度从25 ℃升温至800 ℃。采用THERMO FISHER IN 10表征样品的骨架结构。用溴化钾压片, 光谱范围: 4000~400 cm–1。
1.4 阿司匹林释放实验
将50 mg复合物置于50 mL pH=4.8(或7.4)的PBS中, 37 ℃缓慢搅拌1440 min, 搅拌过程中取出部分混合组分, 经离心去除下层固体后通过紫外–可见吸收光谱(岛津公司UV-2500型紫外–可见分光光度计)测试阿司匹林浓度, 记录溶液中阿司匹林浓度与时间的变化关系。
2 结果与讨论
2.1 样品结构分析
本实验制备的Ni-Ti-LDHs、Ni-Ti-LDHs-NS及相应复合物的XRD图谱如图1所示。由图1(a)可以看出本实验合成得到的Ni-Ti-LDHs出现了典型的水滑石(003)、(010)特征衍射峰, 表明获得了多晶结构且结构完整[18]。图中位于8.37°、16.52°和24.36°处的衍射峰, 分别对应Ni-Ti-LDHs的(003)、(006)和(009)晶面, 表明Ni-Ti-LDHs具有完整的层状结构, 通过布拉格方程(=2sin)可计算Ni-Ti-LDHs (003)晶面的间距为1.06 nm。
与阿司匹林复合后, A-LDHs-1、A-LDHs-2和A-LDHs-5的XRD图谱与Ni-Ti-LDHs基本一致, 说明复合物仍保存着明显的层状结构。复合后(003)晶面的特征峰向小角度移动, 其层间距增大, 说明阿司匹林成功插入了LDHs层间。随着阿司匹林复合量的增加, 复合物层间距也相应增大。
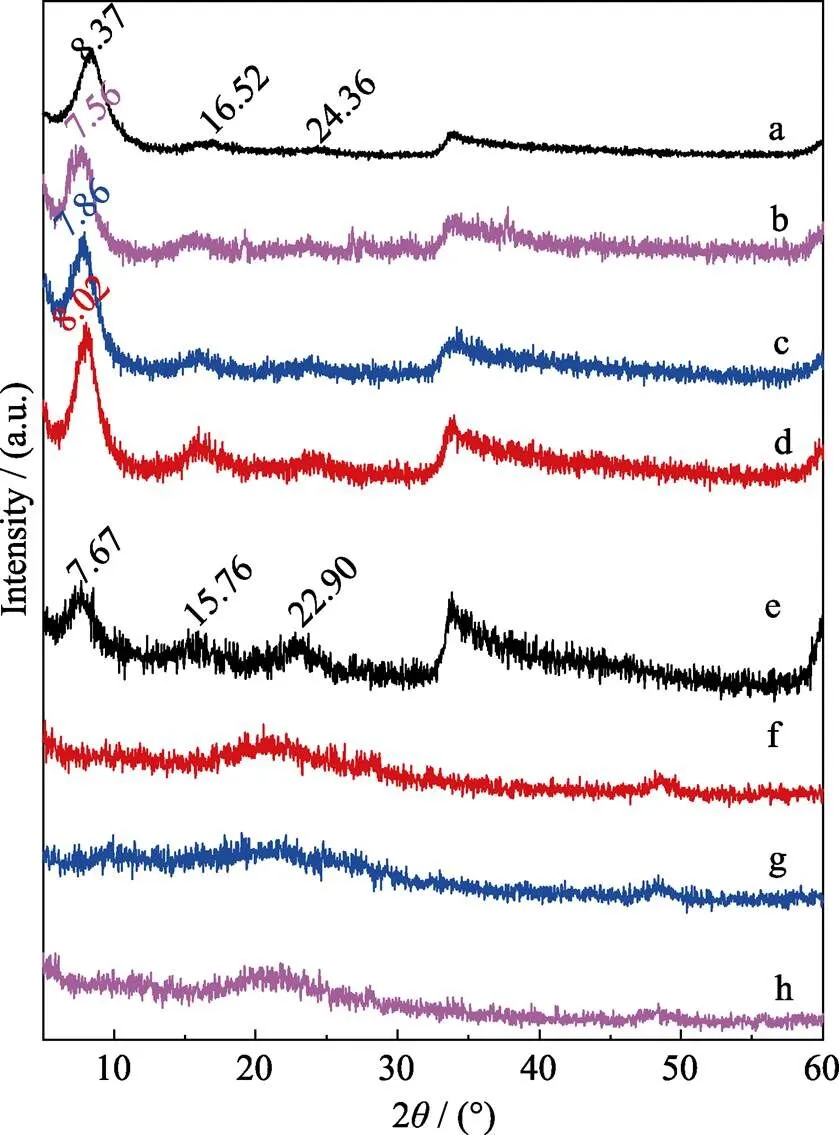
图1 样品的XRD图谱
(a) Ni-Ti-LDHs; (b) A-LDHs-1; (c)A-LDHs-2; (d) A-LDHs-5; (e) Ni-Ti-LDHs-NS; (f) A-LDHs-NS-1; (g) A-LDHs-NS-2; (h) A-LDHs-NS-5
通过超声辅助剥片法制备的Ni-Ti-LDHs-NS的XRD图谱如图1(e)所示。图1(e)显示, 剥片沉积后与Ni-Ti-LDHs相比, 虽样品的结晶度有所下降, 但仍保持了明显的层状结构。层间距由剥片前的1.06 nm增加至1.15 nm, 这可能是由于在组装过程中有大量水分子进入层间。
Ni-Ti-LDHs-NS与阿司匹林复合后, 层状结构不明显, 在20°~30°处出现典型的无定型特征峰, 推测为沉积过程中加入阿司匹林使其包裹了Ni-Ti- LDHs-NS, 因而较难形成层状结构。
为更好地观察实验所制备的样品形貌, 图2展示了其SEM照片。图2(a)显示Ni-Ti-LDHs具有密实的片状堆积结构, 剥离成纳米片后依然保持片状堆积结构, 堆积程度较松弛(图2(c))。Ni-Ti-LDHs和Ni-Ti-LDHs-NS与阿司匹林复合后, 样品表面出现大量絮状物质, 可能是阿司匹林在样品表面吸附的结果(图2(b, d))。两种复合物相比, 尽管A-LDH-1表面被絮状物包裹, 但依然能观察到其片状的堆积结构, 而A-LDHs-NS-1表面被絮状物包裹后较难分辨出片状堆积结构。这些结果与XRD的分析结果一致。
2.2 载药性能分析
载药性能是评价药物载体性能优劣的一个重要因素, 通过热重法计算无机药物载体载药量简便易行[19]。将复合物的热重曲线同复合前的热重曲线相比较, 复合物热重曲线中多出来的失重区域通常被认为是负载药物的失重。实验制备样品的TG-DTG曲线如图3所示。图3(a~d)和图3(f~h)中的DTG曲线上均出现了3个极小值, 分别在40、270和280 ℃左右, 说明几个样品的失重趋势一致。图3(e)中DTG曲线在130和220 ℃处新增两个极值。推测这是因为Ni-Ti-LDHs-NS吸附活性位完全暴露在表面, 能吸附更多物理水及其他物质。根据图3所得结果计算, 扣除Ni-Ti-LDHs和Ni-Ti-LDHs-NS自身的失重区间, A-LDHs-1、A-LDHs-2、A-LDHs-5、A-LDHs- NS-1、A-LDHs-NS-2和A-LDHs-NS-5的失重率(即阿司匹林载药率)分别是5.82%、5.45%、4.93%、17.98%、10.60%和4.99%。

图2 制备样品的SEM照片
(a) Ni-Ti-LDHs; (b) A-LDH-1; (c) Ni-Ti-LDHs-NS; (d)A-LDHs-NS-1
Ni-Ti-LDHs与阿司匹林按照物质的量的比1 : 1、1 : 2和1 : 5复合时能分别可负载阿司匹林0.341、0.312和0.287 mmol·g–1。相比投料量1.475、0.738和0.295 mmol·g–1可以发现, 物质的量的比为1 : 5的复合物由于阿司匹林的比例过小, 阿司匹林几乎全部同Ni-Ti-LDHs结合。另外, 随着阿司匹林比例的增加, 复合物中负载的阿司匹林的量也随之上升。
Ni-Ti-LDHs-NS与阿司匹林按照物质的量的比1 : 1、1 : 2和1 : 5复合时能分别负载阿司匹林1.178、0.651和0.291 mmol·g–1。相比投料量1.475、0.738和0.295 mmol·g–1, 物质的量的比为1 : 5的纳米片复合物中, 由于所占比例小, 阿司匹林几乎全部同Ni-Ti-LDHs-NS结合。同样, 随着阿司匹林所占比例增加, 复合物中负载的阿司匹林的量也随之上升。
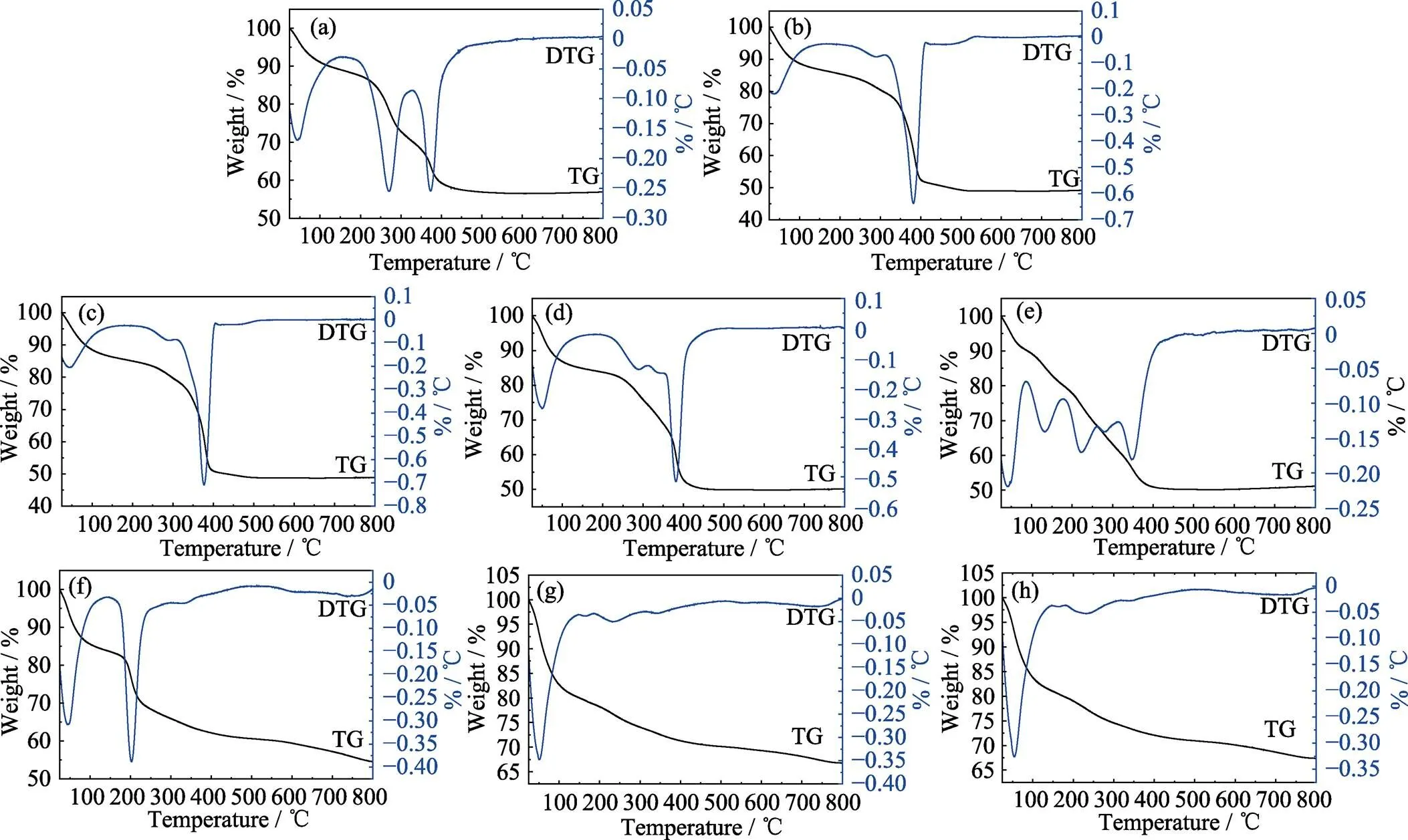
图3 样品的TG-DTG 曲线
(a) Ni-Ti-LDHs; (b) A-LDHs-1; (c)A-LDHs-2; (d) A-LDHs-5; (e) Ni-Ti-LDHs-NS; (f) A-LDHs-NS-1; (g) A-LDHs-NS-2; (h) A-LDHs-NS-5
同Ni-Ti-LDHs相比, Ni-Ti-LDHs-NS能负载更多的阿司匹林, 这可能是因为Ni-Ti-LDHs-NS较Ni-Ti- LDHs有更大的比表面积(图4示), Ni-Ti-LDHs-NS表面活性基团充分暴露, 更容易与阿司匹林结合。
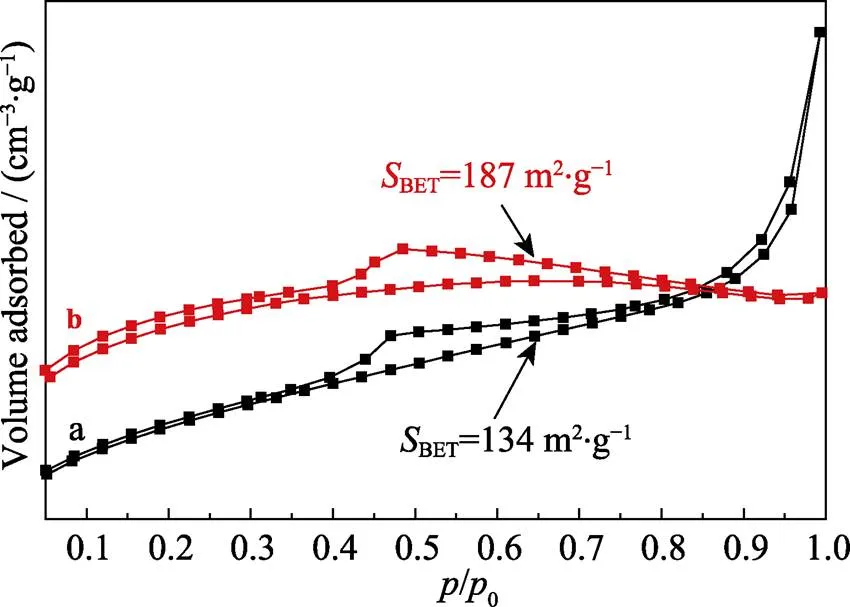
图4 样品的N2吸附–脱附等温线(SBET指比表面积)
(a) Ni-Ti-LDHs; (b) Ni-Ti-LDHs-NS
2.3 载药模式分析
FT-IR对于分析化合物骨架结构及作用模式具有重要意义。实验制备的样品FT-IR如图5所示。图5(b~d)显示, 与Ni-Ti-LDHs的FT-IR曲线(图5(a))相比, A-LDHs-1、A-LDHs-2以及A-LDHs-5的FT-IR曲线中均出现了1608.0、1571.6、1452.5、1251.2和1149.1 cm–1等5处新峰。其中1608.0和1452.5 cm–1为苯环的振动峰[20], 1571.6 cm–1为COOH的伸缩振动峰[21], 1251.2 cm–1为C–O–C的振动峰[22], 1149.1 cm–1为O–H的振动峰。这些峰的出现进一步证明了阿司匹林成功地与Ni-Ti-LDHs复合。另外, 复合后的FT-IR曲线中Ni–OH键特征峰位置几乎不变(452.5 cm–1), 但Ti–OH键的特征峰(625.8 cm–1)有大约10 cm–1的位移, 说明阿司匹林在Ni-Ti-LDHs上的负载主要是通过与Ni-Ti-LDHs中Ti–OH键的相互作用而实现。该结果与之前的报道一致[17]。
图5(f~h)显示, 与Ni-Ti-LDHs-NS的FT-IR曲线(图5(e))相比, A-LDHs-NS-1、A-LDHs-NS-2以及A-LDHs-NS-5的FT-IR曲线中出现了三处新峰, 分别为1458.1、1244.5和1145.5 cm–1。其中1458.1 cm–1为苯环的振动峰, 1244.5 cm–1为C–O–C的振动峰, 1145.5 cm–1为O–H的振动峰。新峰的出现同样证明了阿司匹林成功地与Ni-Ti-LDHs-NS复合。复合后的FT-IR曲线中Ni–OH键和Ti–OH键的特征峰均有较大改变, 说明阿司匹林在Ni-Ti-LDHs-NS上的负载主要是通过与其中Ti–OH键和Ni–OH的相互作用而实现。另外, 与A-LDHs相比, A-LDHs-NS的FT-IR特征峰中没有出现COOH的伸缩振动峰, 这可能是Ni-Ti-LDHs-NS表面活性位充分暴露, 更容易与阿司匹林中的COOH相互作用, 作用能力也更强。图5(h)显示, 位于1145.5 cm–1的特征峰很弱, 这可能是因为A-LDHs-NS-5中投入的阿司匹林较少, 是其中的OH可能完全与Ni-Ti-LDHs-NS表面相互作用的结果, 阿司匹林与Ni-Ti-LDHs及Ni-Ti- LDHs-NS可能的复合模型如图6所示。
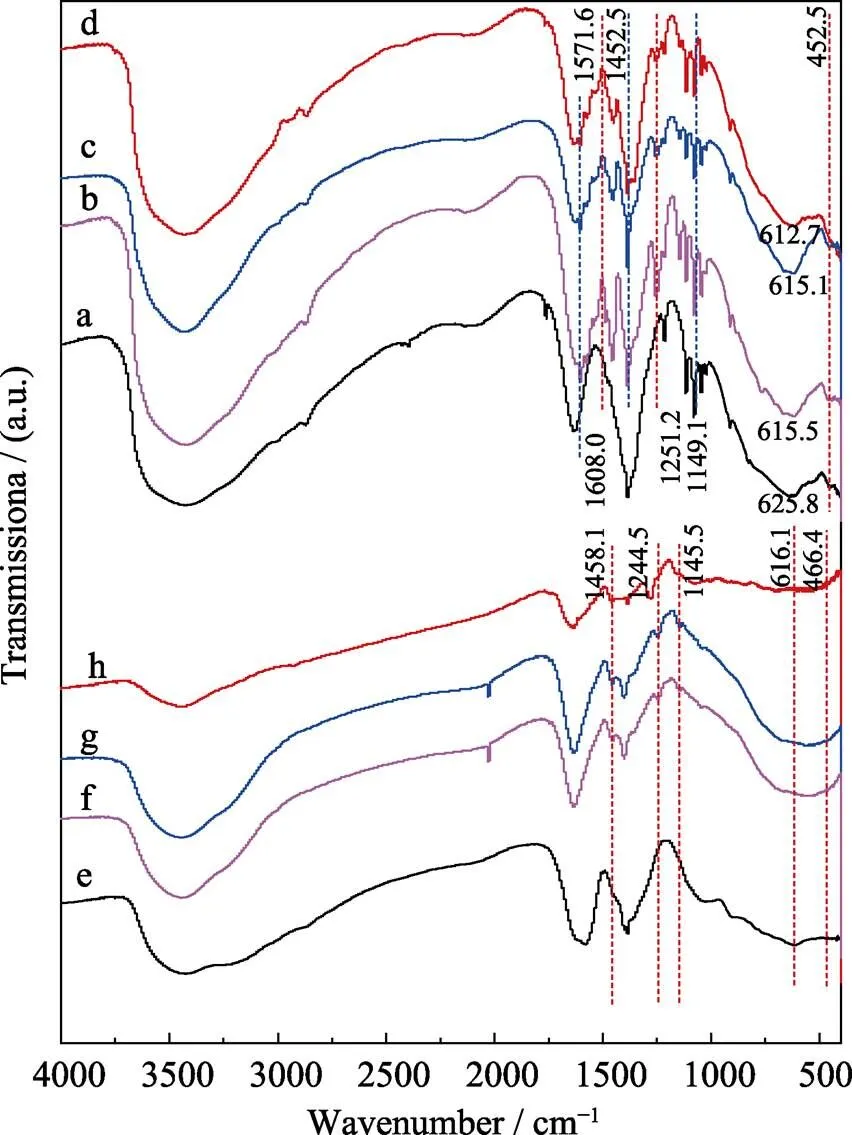
图5 A-LDHs与A-LDHs-NS释放阿司匹林后的FT-IR谱图
(a) Ni-Ti-LDHs; (b) A-LDHs-1; (c) A-LDHs-2; (d) A-LDHs-5; (e) Ni-Ti-LDHs-NS; (f) A-LDHs-NS-1; (g) A-LDHs-NS-2; (h) A-LDHs-NS-5
2.4 缓释性能分析
本研究通过配置pH为4.8和7.4的PBS来模拟人体中弱酸性的肿瘤环境与正常生理环境[23]。
阿司匹林在pH=4.8的PBS中于270 nm左右处有最大吸收值。由图7(a, b)可以看出阿司匹林溶液在270 nm处吸光度值与阿司匹林浓度有良好的线形关系。拟合得出线性方程为:=3.390+0.046 (2= 0.998), 其中为吸光度,为阿司匹林的浓度(g·L–1)。同理, 由图7(a, b)可知, 阿司匹林在pH=7.4的磷酸缓冲液中最大吸收波长处吸光度值与其浓度有很好的线形关系, 拟合得出线性方程为:= 3.431+0.033 (2=0.997)。图中阿司匹林的浓度从高到低别是0.5、0.25、0.125、0.0625、0.03125和0.015625 g·L–1。
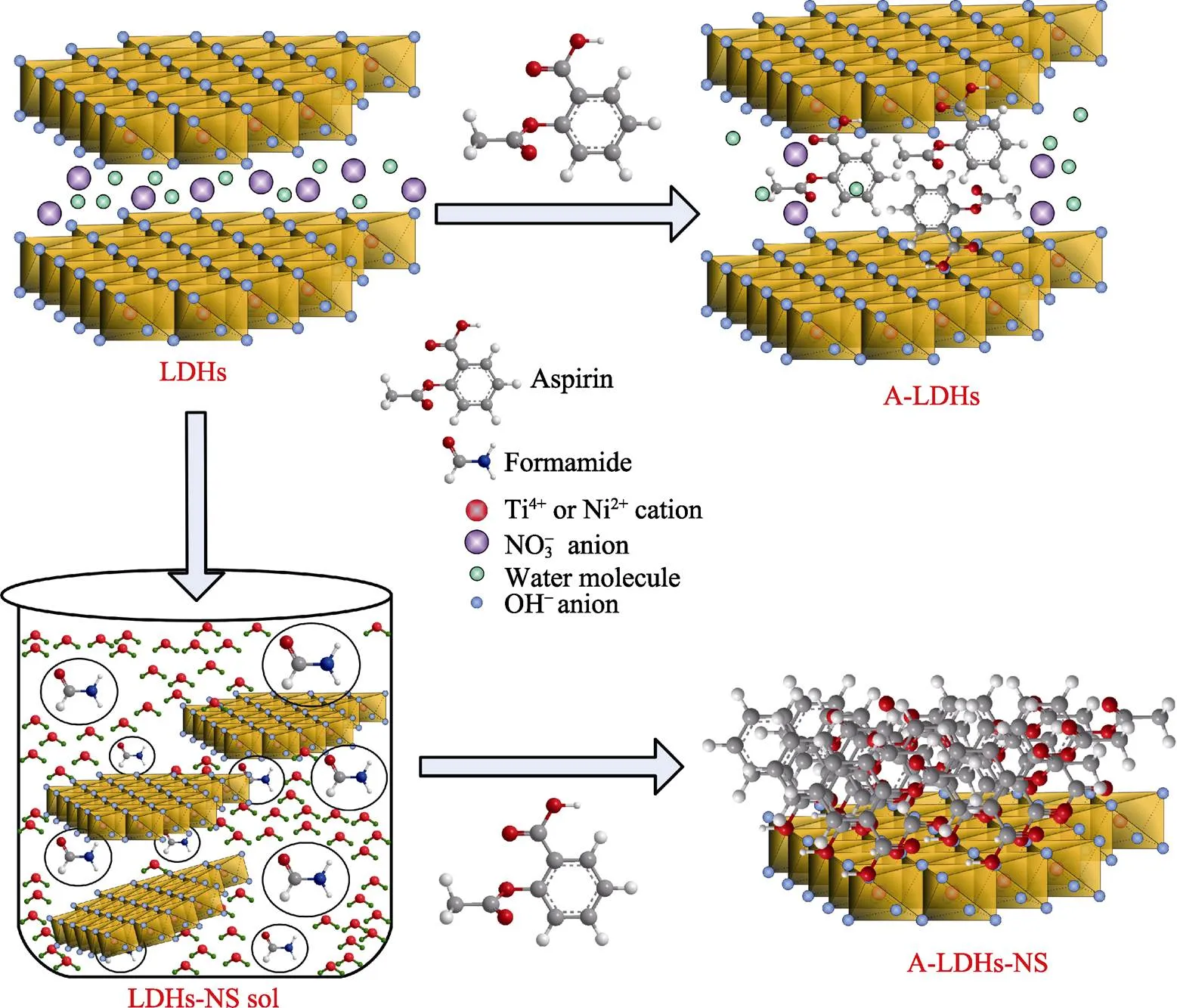
图6 阿司匹林与Ni-Ti-LDHs及Ni-Ti-LDHs-NS可能的复合模型示意图
为了消除Ni-Ti-LDHs及Ni-Ti-LDHs-NS在阿司匹林释放过程中的溶解对释放结果的影响, 将50 mg样品分散在50 mL PBS中, 在相同的释放实验条件下, 搅拌过程中取出部分混合液, 经离心去除固体样品后在紫外–可见吸收光谱中检测, 结果如图8所示。Ni-Ti-LDHs和Ni-Ti-LDHs-NS在pH为4.8和7.4的PBS中均无明显的溶解现象。
阿司匹林在Ni-Ti-LDHs和Ni-Ti-LDHs-NS上的释放结果如图9所示。图9(A(a~c))以及图9(B(a~c))显示, A-LDHs-1、A-LDHs-2和A-LDHs-5中的阿司匹林在pH为4.8和7.4的PBS中释放约20 min后几乎释放完全。这可能是阿司匹林与Ni-Ti-LDHs相互作用不强的原因。图9(A1, B1)显示, pH为4.8和7.4的PBS中, 阿司匹林从复合物A-LDHs中释放量与负载量基本一致。
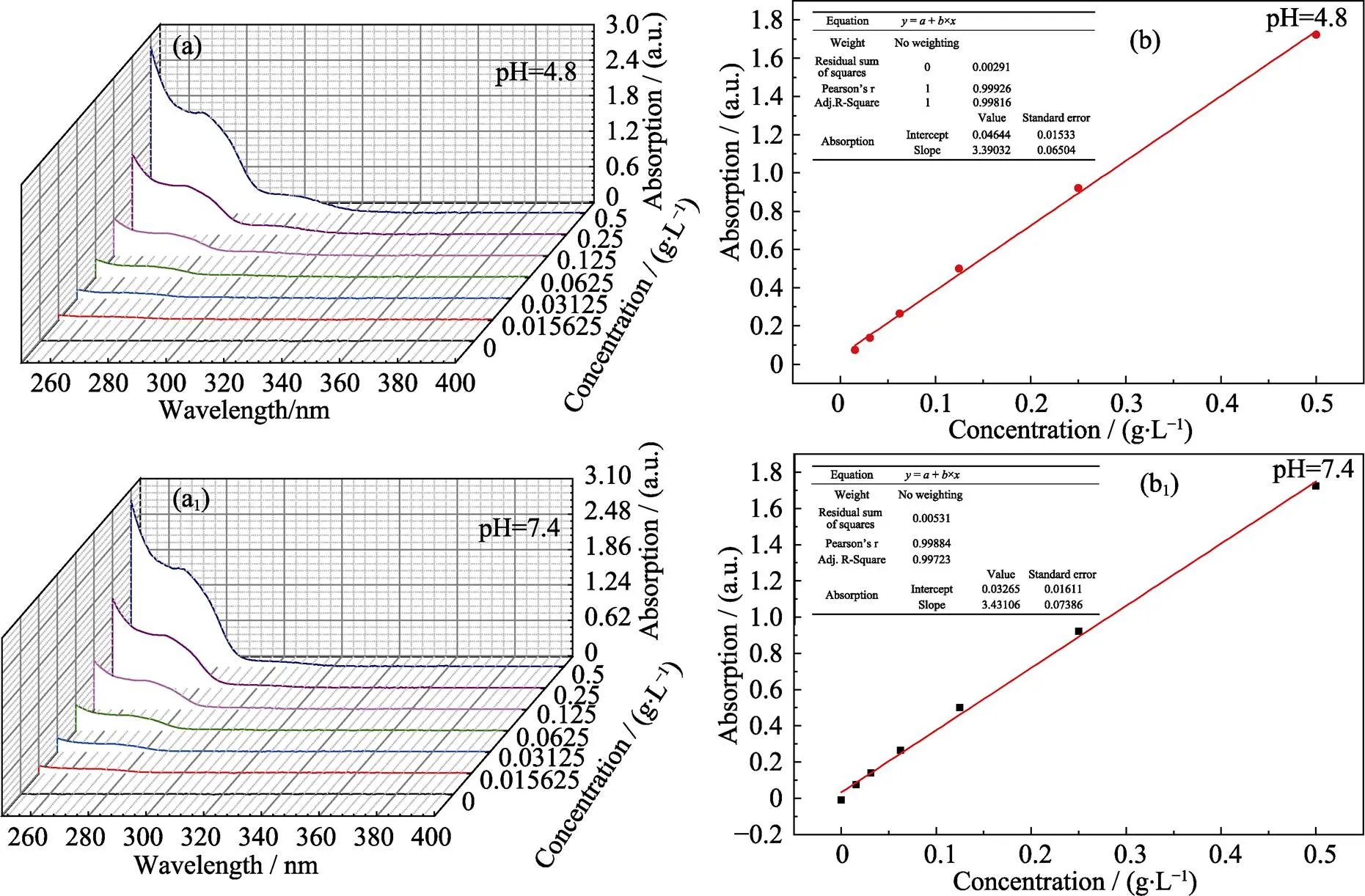
图7 阿司匹林在pH为4.8和7.4的PBS中的紫外–可见吸收光谱(a, a1)和标准工作曲线(b, b1)
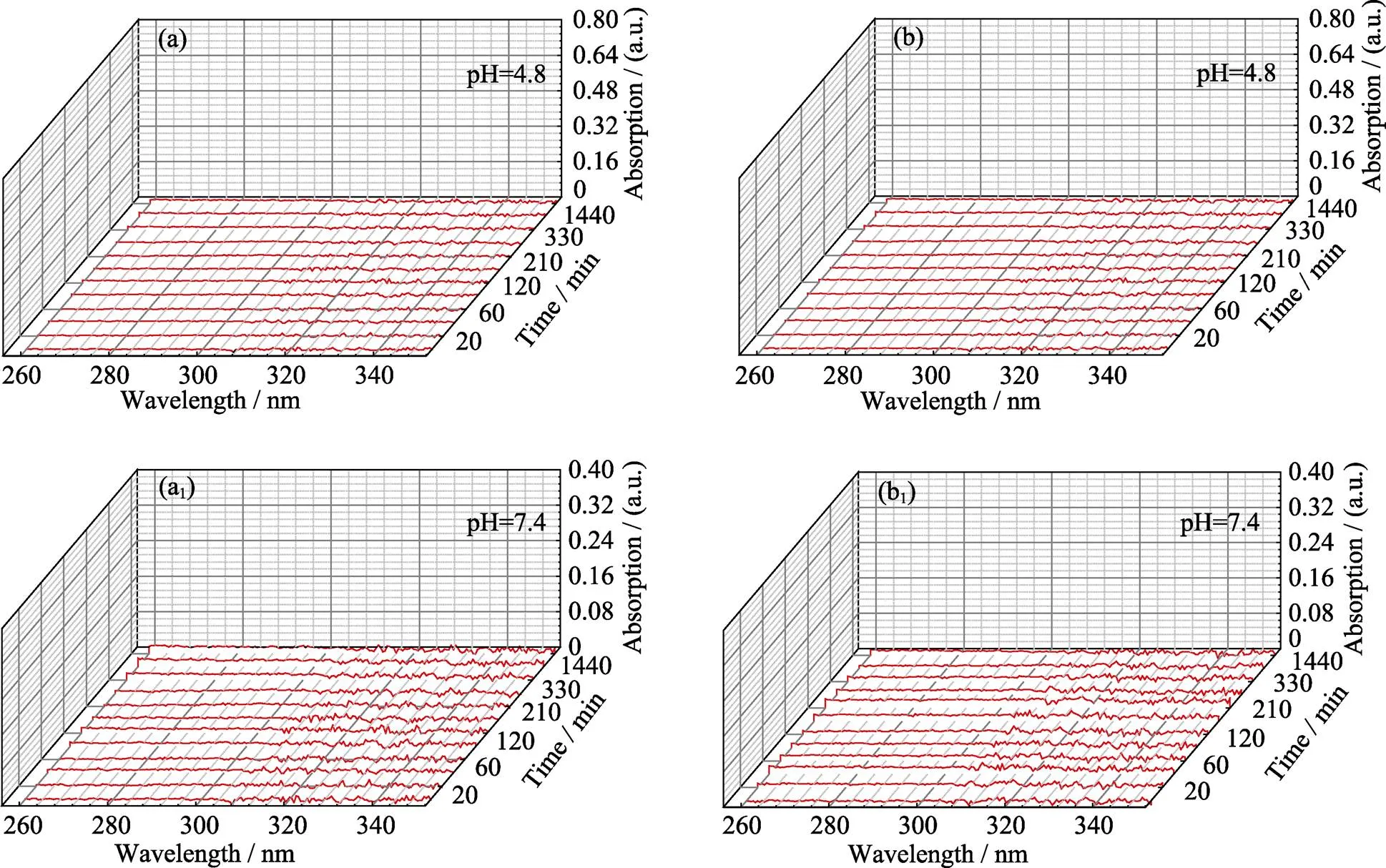
图8 Ni-Ti-LDHs(a, a1)和Ni-Ti-LDHs-NS(b, b1)在pH为4.8和7.4的PBS中不同时间的紫外–可见吸收光谱
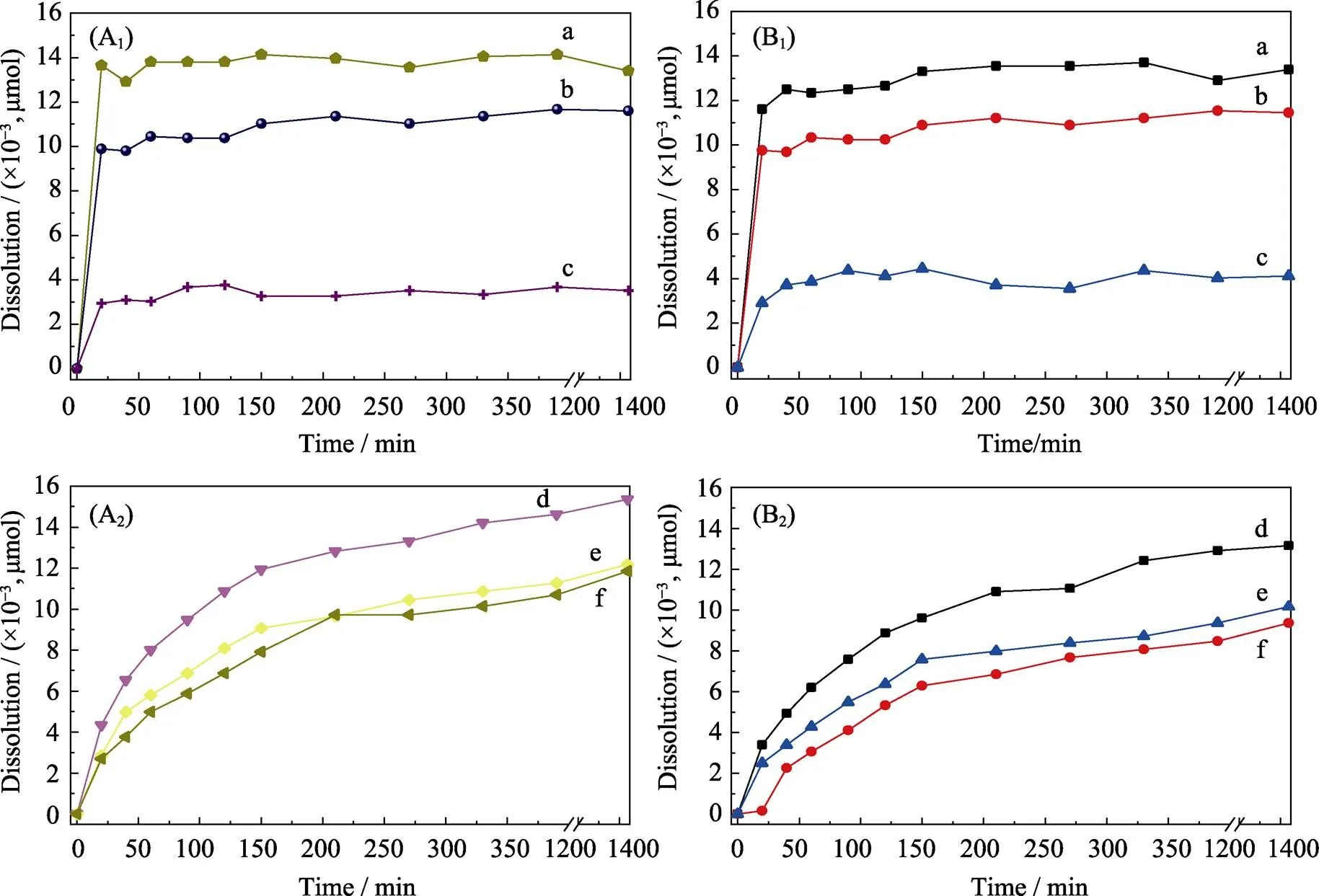
图9 阿司匹林在pH为4.8(A1, A2)和7.4(B1.B2)的PBS中从复合材料中的释放曲线
A-LDHs-1 (a), A-LDHs-2 (b), A-LDHs-5 (c), A-LDHs-NS-1 (d), A-LDHs-NS-2 (e), and A-LDHs-NS-5 (f)
与A-LDHs-1、A-LDHs-2和A-LDHs-5相比, A-LDHs-NS-1、A-LDHs-NS-2和A-LDHs-NS-5中阿司匹林的释放速度明显减慢。在pH=4.8的PBS中释放1440 min, A-LDHs-NS-1中的阿司匹林只释放了15×10–3μmol(图9(A2(d))), 尽管释放量与A-LDHs-1相当, 但由于负载的阿司匹林含量比A-LDHs-1大, 即A-LDHs-NS-1中还有一部分阿司匹林没有释放出来。在相同的pH下, 不同阿司匹林比例的复合物(A-LDHs-NS)中阿司匹林的释放速度趋势与A-LDHs一致(图9(A2(d~f))与图9(A1(a~c))相比)。相同复合物(如A-LDHs-NS-1)在不同pH中阿司匹林的释放速度不同。A-LDHs-NS-1中的阿司匹林在pH=7.4的环境中1440 min的释放量为13×10–3μmol(图9B2(d))。
3 结论
本研究制备了阿司匹林-Ni-Ti-LDHs和阿司匹林-Ni-Ti-LDHs-NS复合物。Ni-Ti-LDHs-NS由于其较大的比表面积以及充分暴露的表面活性位, 能够负载更多的阿司匹林;同时, 阿司匹林中羧酸基团与Ni-Ti-LDHs-NS表面羟基基团之间具有较强的相互作用, 使得负载到其表面的阿司匹林具有较强的缓释性能。根据模拟人体不同组织的pH环境, 阿司匹林既能在弱酸性肿瘤区缓慢释放, 又能在正常近中性组织中释放。
[1] Seidi F, Jenjob R, Crespy D. Designing smart polymer conjugates for controlled release of payloads., 2018, 118(7): 3965−4036.
[2] Kamaly N, Yameen B, Wu J,. Degradable controlled- release polymers and polymeric nanoparticles: mechanisms of controlling drug release., 2016, 116(4): 2602−2663.
[3] Deng W, Chen W, Clement S,Controlled gene and drug release from a liposomal delivery platform triggered by X-ray radiation., 2018, 9(1): 2713.
[4] CHEN Q. Effect of Low-dose aspirin enteric-coated sustained-release tablets on the fibrinolytic activity of senile hypertension patients., 2018,5(68):7–10.
[5] Colwell J A. An appraisal of aspirin therapy in diabetes., 2006, 6(6):409–410.
[6] Hua H, Zhang H Y, Kong Q B,. Complex roles of the old drug aspirin in cancer chemoprevention and therapy., 2018:1–32.
[7] CHEN C M. 1 case acute stomach bleeding caused by Oral aspirin., 2005, 7(1): 55.
[8] LIANG T L. Clinical observation and analysis of stomach ulcers caused by aspirin., 2012, 33(6): 1210–1211.
[9] CHEN H, LINF Q D, ZHANG W G,Luminescent drug- containing hydrotalcite-like compound as a drug carrier., 2012, 185–186: 358–365.
[10] JIAO L. Preparation of DET-LDH-ASP Hydrogel Matrix Sustained-Released Tablets and its Pharmacokinetics. Yinchuan: Ningxia Medical University, Master's thesis, 2011.
[11] GOU G J, DONG L E, BAO F J,. A review on research of the sustained release drug delivery system based on magnesium aluminate layered double hydroxide., 2013, 320: 495–504.
[12] BI X, FAN T, ZHANG H. Novel morphology-controlled hierarchical core@shell structural organo-layered double hydroxides magnetic nanovehicles for drug release., 2014, 6(22): 20498–20509.
[13] WANG Q P, LI H, WANG H Y,. Preparation andreleasing property of aspirin-LDHs-chitosan microspheres., 2018, 41(1): 59–68.
[14] CARJA G, CHIRIAC H, LUPU N. New magnetic organic–inorganic composites based on hydrotalcite-like anionic clays for drug delivery., 2007, 311(1): 26–30.
[15] MENG Z L, LI X W, LÜ F Z,. Structure, molecular simulation, and release of a spirin from intercalated Zn-Al-layered double hydroxides., 2015, 135:339–345.
[16] Ge N J, Wang D H, Peng F,. Polystyrene sulfonate modified Ni-Ti layered double hydroxide film: a smart drug eluting platform., 2016, 8(37): 24491–24501.
[17] Hu L F, Gao W, He J,. Ni-Ti-layered double hydroxide intercalated with β-CD and CM-β-CD: interaction between the interlayer guests and the laminates., 2013, 1041: 151–155.
[18] Shu X, Zhang W H, He J,. Formation of Ni–Ti-layered double hydroxides using homogeneous precipitation method., 2006, 8(6): 634–639.
[19] ZHANG Y, FEI W D, TAO J Y,. Preparation andevaluation of arsenic trioxide-loaded phospholipidcapped mesoporous silica nanoparticles modified with Angiopep-2 as targeting drug delivery system., 2018, 49(6): 1289–1297.
[20] ZHAO J K, XIE Y F, XU J,. Preparation of Mg2Al layered double hydroxide nanosheets from Triton X-100 hexagonal lyotropic liquid crystal and their application as drug carriers., 2015, 31(6): 1199–1206.
[21] Herrero M, Labajos F M, Rives V. Size control and optimisation of intercalated layered double hydroxides., 2009, 42(3/4): 510–518.
[22] WANG W, QIAN P, PTIAN J H,. Research about aspirin inclusion by Raman spectroscopy and infrared spectroscopy., 2012, 32(5): 819–821.
[23] Fu W L, Mohd N M H, Yusof L M,.evaluation of a novel pH sensitive drug delivery system based cockle shell- derived aragonite nanoparticles against osteosarcoma., 2017, 12(1): 166–187.
Aspirin on Ni-Ti-LDHs Nanosheets: Load and Sustained-release
HU Li-Fang, LIU Liu, HE Jie, SUN Zhi-Peng, CHEN Xiao-Ping
(School of Chemical Engineering, Anhui University of Science and Technology, Huainan 232001, China)
Aspirin/layered double hydroxides composite (A-LDHs) and aspirin/layered double hydroxide-nanosheets composite (A-LDHs-NS) were prepared by intercalation and exfoliation-recombination, respectively. Their morphology, drug loading property and drug loading mode of the composites were characterized by XRD, SEM, TG-DTG, and FT-IR. The releasing performances of aspirin from A-LDHs and A-LDHs-NS in the phosphate buffer solutions with different pH conditions were investigated. The results show that the typical lamellar structures are hold in as-prepared LDHs and LDHs-NS. The larger specific surface area (187 m2·g–1) of LDHs-NS, the more aspirins are loaded on its surface, among which the max drug loading is 1.178 mmol·g–1. Its releasing process lasts for more than 1440 min, much longer than 20 min of the control materials, showing excellent sustained-releasing performance. This performance may because of the strong interaction between aspirin and LDHs-NS. Moreover, the sustained releasing performance is stronger at pH 7.4 than that at pH 4.8. All data from this study provides a reference for wider application of this kind of two-dimensional materials in biomedicine.
aspirin; layered double hydroxides nanosheet; drug loading; sustained-release; interaction mode
TQ462
A
1000-324X(2020)02-0165-08
10.15541/jim20190074
2019-02-15;
2019-03-11
国家自然科学基金(21271008);安徽省高校自然科学基金重点项目(KJ2018A0089)
National Natural Science Foundation of China (21271008); Key Project of Collegiate Natural Science Fund of Anhui Province (KJ2018A0089)
胡丽芳(1990–), 男, 博士, 讲师. E-mail: hulf@aust.edu.cn
HU Li-Fang(1990–), male, PhD, lecturer. E-mail: hulf@aust.edu.cn
何杰, 教授. E-mail: jhe@aust.edu.cn
HE Jie, professor. E-mail: jhe@aust.edu.cn
