荷斯坦泌乳牛4 种炎性细胞因子随胎次变化规律的研究
2020-03-08陈紫薇张国兴张海亮董刚辉王雅春
王 凯,陈紫薇,张国兴,常 瑶,张海亮,董刚辉,王雅春*
(1.中国农业大学动物科学技术学院,北京 100193;2.首农畜牧发展有限公司,北京 100176)
北京地区中国荷斯坦牛使用年限较短,被动淘汰比例高,平均利用胎次为2.86 胎[1]。由于年龄增加,高胎次奶牛免疫系统状态发生改变,影响奶牛对疾病的抵抗力,淘汰风险显著升高[2]。炎性细胞因子由促炎细胞因子和抑炎细胞因子组成,与机体固有免疫和炎症反应有关,在免疫系统中发挥着重要调节作用。促炎细胞因子主要包括肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)、白细胞介素-6(Interleukin-6,IL-6)、白细胞介素-1β(Interleukin1-β,IL-1β)等,主要由巨噬细胞分泌[3]。抑炎细胞因子主要包括白细胞介素-10(Interleukin-10,IL-10)、转化生长因子-β(Transforming Growth Factor-β,TGF-β)等[3]。病原体入侵时,促炎细胞因子激活机体的先天和获得性免疫,放大炎症反应,而抑炎细胞因子则主要是在消灭病原体后消除炎症使机体恢复到正常免疫和生理水平[4-5]。促炎细胞因子和抗炎细胞因子是炎症反应中联系机体与损伤因子的枢纽,炎性细胞因子间动态的相互作用和平衡是机体免疫系统的重要组成部分[6]。
目前,关于病理状态下奶牛细胞因子变化的研究已有很多,而鲜有健康奶牛炎性细胞因子随胎次变化规律研究的报道。本研究选取150 头健康的荷斯坦奶牛,分析血液中促炎细胞因子TNF-α、IL-6 和抑炎细胞因子IL-10、TGF-β浓度以及奶牛生产性能,探究生理状态下炎性细胞因子随胎次变化的规律,为免疫预防和治疗提供依据。
1 材料与方法
1.1 试验动物 试验牛来自北京市5 个牧场(F1~F5),每场30 头,共150 头健康的中国荷斯坦泌乳牛,其中1 胎、3 胎、5 胎及以上各50 头。
1.2 样品的采集和处理 使用一次性无菌采血针和非抗凝真空采血管于2017 年7 月至8 月采集试验牛尾根静脉血,同一牛场的血样采集工作在同一天下午完成。采集血样时进行体况评分和直肠温度测定。非抗凝血静置2 h 后,3 000 r/min 离心10 min,取上层清液,储存在-20℃的冰箱,以备测细胞因子。奶牛生产性能测定(Dairy Herd Improvement,DHI)数据来自北京奶牛生产性能测定中心。
1.3 测定指标及方法
1.3.1 炎性细胞因子 血清炎性细胞因子(包括TNF-α、IL-6、IL-10 和TGF-β)是由金海科隅生物科技发展有限公司采用ELISA 酶免法测定,酶标仪是上海科华生物工程有限公司生产的ST-360 型,细胞因子诊断试剂为金海科隅生物科技发展有限公司生产。
1.3.2 体况评分(BCS) 评定时奶牛自然站立,3 名评分人员通过目测和触摸奶牛隐窝、臀角及腰角等部位,独立进行评分。评分采用5 分制评分系统,精确至0.5 分,分析时使用3 名评定人员评分的均值[7]。
1.4 统计分析
1.4.1 数据整理 本研究共测定150 头中国荷斯坦牛的血液炎性细胞因子浓度,匹配距采样日最近3 个月的DHI 记录,计算日产奶量、校正日产奶量、乳脂率、乳蛋白率、乳糖率的3 次测定日均值用于后续分析。剔除分析所用产奶性能指标DHI 记录缺失≥2 次的个体,经数据质控后,共150 头个体数据可用于分析血液炎性细胞因子随胎次的变化规律,137 头个体数据用于分析血液炎性细胞因子对产奶性能的影响。
胎次划分为3 个水平:1 胎、3 胎、5 胎及以上;泌乳天数分为2 个阶段:泌乳天数74~216 d 为泌乳中期,大于216 d 为泌乳后期。研究血液炎性细胞因子对产奶性能的影响时,按中位数将炎性细胞因子分为高含量组和低含量组,作为分类变量进行分析。
1.4.2 炎性细胞因子随胎次的变化规律 使用SAS 9.4软件GLM 过程(Bonferroni t 检验用于多重比较),采用固定模型1 分析TNF-α、IL-6、IL-10 和TGF-β随胎次的变化规律:
式 中,Y表示TNF-α、IL-6、IL-10或TGF-β;μ为 总体平均数;farm为牛场效应(i=1~5);parity为胎次效应(j=1~3);lactation为泌乳阶段效应(k=1~2);α为TNF-α的回归系数,β为IL-6 的 回归系数,γ为IL-10 的回归系数,δ为TGF-β的回归系数;当Y为TNF-α时,α=0,当Y为IL-6 时,β=0,当Y为IL-10 时,γ=0,当Y为TGF-β时,δ=0;eijkl为随机残差。
使用SAS 9.4 软件CORR 过程计算每一胎次内4种炎性细胞因子之间的Pearson 相关系数,分析4 种炎性细胞因子间的相关性。
1.4.3 炎性细胞因子对产奶性能的影响 使用SAS 9.4软件GLM 过程(Bonferroni t 检验用于多重比较),采用固定模型2 分析炎性细胞因子对产奶性能的影响:
式中,Y表示日产奶量、校正日产奶量、乳脂率、乳蛋白率或乳糖率;μ为总体平均数;farm、parity和lactation效应定义同前模型;Gtnf为TNF-α分组效应(l=1~2);Gil6为IL-6分组效应(m=1~2);Gil10为IL-10 分组效应(n=1~2);Gtgf为TGF-β分组效应(o=1~2);BCS 为体况评分,α为BCS 回归系数;eijklmnop为随机残差。
本研究结果以最小二乘均值±标准误表示,P<0.05表示差异显著,P<0.01 表示差异极显著。
2 结果
2.1 炎性细胞因子浓度随胎次变化规律 由表1 可见,不同牛场对于IL-10 和 TGF-β有显著影响,而不同泌乳阶段对IL-10 和TNF-α有显著影响。
总体来说,IL-6、TGF-β随胎次升高降低,TNF-α随胎次升高有先降低后升高趋势,IL-10 随胎次变化不明显。胎次对TNF-α和IL-10 没有显著影响,从平均值来看,5 胎及以上胎次牛TNF-α高于3 胎。IL-6 及TGF-β在不同胎次间差异显著,5 胎及以上胎次牛IL-6及TGF-β显著低于1 胎和3 胎牛,而IL-6 水平在1 胎和3 胎牛之间没有显著差异。
从图1 可以看出,1 胎牛IL-6 和TGF-β显著正相关,IL-10 和TGF-β显著负相关;3 胎牛IL-6 和TGF-β显著正相关;5 胎及以上胎次奶牛各细胞因子间均无显著相关。
2.2 产奶性能影响因素分析 由表2 可知,不同牛场对日产奶量、乳脂率和乳蛋白率影响显著,不同泌乳阶段对日产奶量、校正日产奶量、乳脂率、乳蛋白率影响显著,日产奶量、蛋白率、乳糖率对BCS 回归显著。

表1 各固定效应对炎性细胞因子浓度的影响
总体来说,高胎次奶牛产奶性能下降。5 胎及以上胎次奶牛的日产奶量和乳糖率显著低于1 胎和3 胎;5胎及以上胎次校正日产奶量低于1 胎和3 胎,与3 胎差异显著。胎次对乳蛋白率和乳脂率没有显著影响,从平均值来看,5 胎及以上胎次乳脂率低于3 胎。
TNF-α对日产奶量有显著影响,IL-10 对校正日产奶量和乳脂率有显著影响,IL-6 和TGF-β对生产性能各项指标影响均不显著。高TNF-α组奶牛日产奶量显著低于低TNF-α组,最小二乘均值相差2.08 kg(表2);高IL-10 组奶牛乳脂率和校正日产奶量均显著高于低IL-10组,最小二乘均值相差分别为0.23%和5.85 kg(表2)。
3 讨 论
各种细胞因子的促炎或抑炎活性并不是绝对的[8],促炎细胞因子和抑炎细胞因子之间的相互作用对炎症反应进行调控是一个非常复杂的过程。因此,不能单纯地从炎性细胞因子水平来说明个体健康状况是否良好,研究中应该谨慎解释炎性细胞因子的变化规律。
TNF-α是一类高度促炎症的细胞因子,对肿瘤细胞具有直接抑制增殖和坏死作用,但对正常细胞生长分化及其代谢功能的发挥无影响[9]。此外,TNF-α还可通过活化巨噬细胞,诱导免疫调节介质的产生来介导免疫应答[10]。炎症发生时,TNF-α促进内皮细胞和白细胞的激活以及白细胞在感染部位的募集,参与多种炎症反应[11]。冯士彬等[4]研究表明,奶牛血清中TNF-α水平与乳房炎的严重程度呈正相关,TNF-α能够指示炎症发生程度。在小鼠和人类研究中有报道,衰老的个体处于慢性炎症状态(简称inflame-aging),血液TNF-α含量升高,这种慢性炎症状态很可能是高龄个体容易生病、身体脆弱的主要原因[12-13]。本研究中,奶牛也有类似的状况,5 胎以上奶牛日产奶量显著降低,TNF-α浓度相比3 胎奶牛有所升高,且高TNF-α组奶牛产奶量比低TNF-α组奶牛平均低5%左右,表明日产奶量的下降可能与促炎细胞因子TNF-α的增加有关。
IL-6 由2 型辅助T 淋巴细胞(Type2 Helper Cells,Th2)分泌,作为一种淋巴细胞刺激因子,可以促进B细胞增殖和抗体分泌[14-15],参与调节各种层面的固有免疫和获得性免疫,是炎症细胞因子网络中的重要组成成分,与体内感染性疾病的发生和发展密切相关[16-17]。本研究结果显示,IL-6 随胎次变化的趋势与抗炎因子IL-10、TGF-β相同。IL-6 的促炎活性已得到公认,但相关研究也发现其具有抗炎活性[18]。
IL-10 是介导免疫抑制的细胞因子,由2 型辅助T淋巴细胞分泌,能够促进体液免疫,调节吞噬细胞的活性和其他炎性细胞因子的生成[19]。IL-10 通过抑制单核/巨噬细胞的抗原递呈功能,抑制1 型辅助T 淋巴细胞(Type1 Helper Cells,Th1)生成减少促炎因子的释放,减少淋巴细胞向炎症部位转移,是机体内的主要抗炎因子[20]。本研究中,IL-10 随着胎次升高有降低趋势,且低IL-10 组乳脂率和校正日产奶量显著低于高IL-10 组,表明高胎次奶牛IL-10 的降低可能通过影响炎症反应的平衡进而影响奶牛产奶性能。
TGF-β是一类多功能的细胞因子,广泛参与哺乳类动物的各种病理生理过程,在胚胎发育、创伤愈合、骨骼改建、免疫调节、神经系统发育以及肿瘤防治等过程中发挥重要作用,协同其他细胞因子共同调节子宫内膜功能,维持子宫内膜和组织内环境的稳定[6]。TGF-β主要由活化的T 细胞和单核/巨噬细胞产生,通过抑制淋巴细胞增殖分化以及细胞毒性T 细胞的成熟,并抑制巨噬细胞的激活,表现为抗炎活性[8]。本研究结果显示,TGF-β随胎次升高显著降低,且与IL-10、IL-6 的相关性发生变化,1 胎和3 胎奶牛TGF-β和IL-6、IL-10 存在显著的相关关系,5 胎及以上奶牛各细胞因子间均无显著相关。在机体感染或发生炎症时,循环系统中促炎细胞因子和抗炎细胞因子共同调节免疫细胞,综合应对感染[21]。TGF-β的这种变化可能会影响高胎次奶牛对炎症反应过程的调节能力。
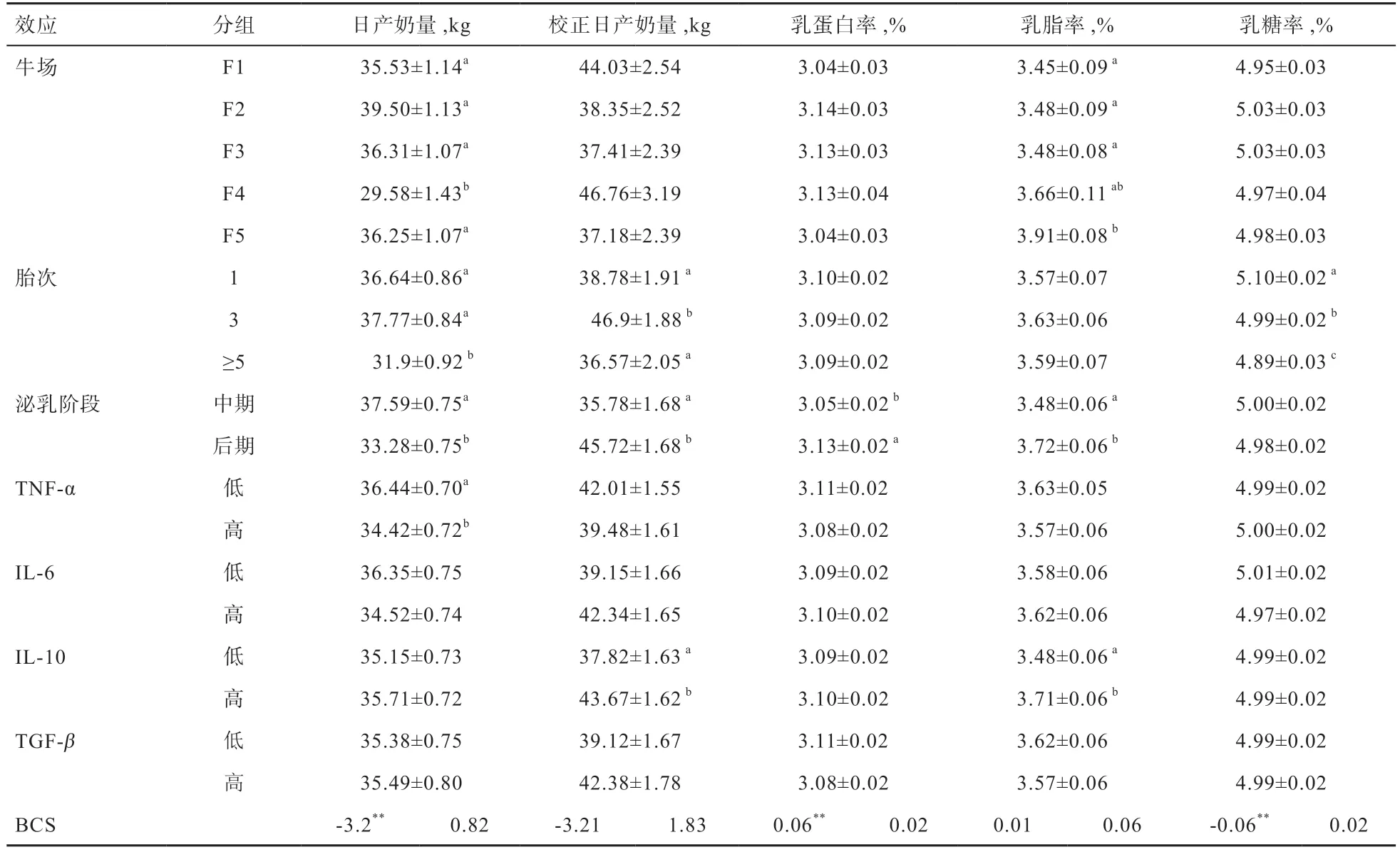
表2 SAS GLM 模型分析各固定效应对产奶性能的影响
4 结 论
本研究通过分析荷斯坦奶牛4 种血液炎性细胞因子随胎次的变化规律,发现1 胎和5 胎以上奶牛TNF-α偏高,IL-6、IL-10、TGF-β随胎次升高有降低趋势;高TNF-α组奶牛产奶量显著低于低TNF-α组,高IL-10 组奶牛乳脂率和校正日产奶量显著高于低IL-10组。结果表明高胎次奶牛炎性细胞因子的变化可能与生产性能的降低有关。
