先天性肠闭锁术后患儿肠功能障碍危险因素分析
2020-03-08康佳苏育敏黄咏欣曾静
康佳,苏育敏,黄咏欣,曾静,
(1 广东药科大学护理学院;2 广东省妇幼保健院,广东广州,510000)
先天性肠闭锁(congenital intestinal atresia,CIA)是新生儿最常见的消化道梗阻畸形之一,发病率高达1/1500~1/1330[1]。手术为CIA 患儿唯一治疗方法,发达国家手术治愈率为90%~96.9%,发展中国家为58.3%~71.5%[2-3]。但部分患儿在术后吻合口通畅并不伴有其他机械性肠梗阻的情况下,仍出现较长时间的肠动力功能障碍。CIA 术后患儿肠功能障碍发生将延长患儿住院时间,增加感染机会[4],术后肠功能的恢复成为CIA 患儿预后的关键[5-6]。相关研究结果显示[7-9],通过预防性的干预可降低CIA 术后患儿肠功能障碍的发生,因此如何预测和管理CIA 术后患儿肠功能障碍对围术期治疗和护理具有重要意义。本研究旨在对CIA 术后患儿发生肠功能障碍危险因素进行调查分析,初步建立预测模型,以期为制定预防CIA 术后患儿发生肠功能障碍措施提供理论依据,现将方法和结果报道如下。
1 资料及方法
1.1 一般资料
采用便利抽样方法,收集2017年6月至2020年6月在广东省某三甲专科医院新生儿外科住院治疗的CIA 患儿367 例。纳入标准:①符合CIA 诊断标准[8]并进行手术治疗患儿;②首次接受治疗、一般状况良好(出生后无窒息史)、可耐受手术治疗患儿;③所有患儿术后均未使用胃肠动力药物。排除标准:①合并腹裂、脐膨出、肝肾功能异常患儿;②患儿转院、转科、放弃治疗、死亡等;③患儿资料缺失或部分缺失者。本研究已通过医院伦理委员会审批。采用每个变量事件数作为标准的方法计算样本量[10]。本研究自变量有7 个,肠功能障碍的发生率为52.3%,则样本量至少为6×10÷52.3%=115 例。本研究共调查367 例符合样本量要求。
1.2 研究方法
1.2.1 研究工具 在参考相关文献关于CIA 术后肠功能障碍危险因素[6,11-12]的研究结果基础上,自行设计CIA 术后患儿发生肠功能障碍危险因素调查表,具体内容如下,①患儿一般资料,包括性别、年龄、胎龄、出生体重(<2500g 视为低出生体重);②疾病因素和肠功能障碍相关危险因素,包括腹腔感染、闭锁位置、闭锁分型、手术方式、术中肠管切除长度、术后恢复经口喂养时间、术后吻合口狭窄/梗阻、术后合并败血症、住院时间等。CIA 病理分型主要为4 类,其中Ⅰ型为膜状闭锁;Ⅱ型为盲端闭锁,且纤维索带相连; Ⅲ型又分为Ⅲa 型和Ⅲb 型,其中Ⅲa 型为盲端闭锁,肠系膜缺如,Ⅲb 型呈苹果皮样闭锁; Ⅳ型为多发闭锁[13],本研究将Ⅲa 型和Ⅲb 型全并为Ⅲ型。术后恢复经口喂养时间按照吴晔明等《新生儿外科学》[13]中CIA 的诊疗常规,患儿术后3d 可恢复喂养进行界定。患儿出现发热、呕吐、腹膜刺激征表现;白细胞计数、中性粒细胞等指标升高; 腹腔穿刺液细菌培养阳性;X 片定位感染源,至少合并上述三项可诊断为腹腔感染[14]。患儿术后出现腹胀、呕吐、喂养不耐受等症状;X 线检查存在肠道扩张、肠间隔增厚、肠壁间积气征; 使用碘海醇造影判断吻合口狭窄/梗阻的范围,依据上述三项可确诊为术后吻合口狭窄/梗阻[15]。患儿出现有黄疸、肝脾大、皮肤黏膜出血、腹胀、呕吐等症状;白细胞计数、中性粒细胞比例、血小板计数等指标增加,C 反应蛋白阳性; 血培养阳性,至少合并上述两项可诊断为败血症[16]。参考《多脏器功能失常综合征病情分期诊断及严重程度评分标准》[17]中肠功能障碍的诊断标准,患儿出现持续腹胀、术后72h(包含72h)未排气排便可判断为术后肠功能障碍。
1.2.2 资料收集方法 调查前组建研究小组,包括2 名主治医师、3 名主管护师及1 名护理研究生共6 名,对所有成员进行规范化培训,采用统一的危险因素调查表和相同判断标准进行资料收集。调查后由专人对收集到的数据核查后进行统计学分析。以患儿术后恢复排便时间作为肠功能障碍判断标准[17],术后72h(包含72h)未排气排便可判断为肠功能障碍。患儿术后恢复排便时间由调查人员查阅医疗及护理电子病历系统填写。
1.3 统计学方法
数据采用SPSS 23.0 软件进行统计学分析。符合正态分布的计量资料采用均数±标准差表示,组间比较采用独立样本t 检验; 计数资料采用频数、百分比(%)表示,组间比较采用χ2检验。单因素分析有统计学意义的变量,纳入Logistic 回归分析,并构建预测模型。采用Logistic 回归模型分析CIA 术后肠功能障碍的危险因素,以P<0.05 为差异有统计学意义。采用受试者操作特征曲线下面积和Hosmer-Lemeshow 检验分析该模型的预测效果。
2 结果
2.1 CIA 术后患儿一般资料
本研究共纳入确诊为CIA 的患儿367 例,根据肠功能障碍判断标准[17],将367 例患儿分为肠功能障碍组192 例(占52.3%)和非肠功能障碍组175 例(占47.7%),两组一般资料比较见表1。从表1可见,两组患儿胎龄、出生体重、闭锁位置、闭锁类型、手术方式、术后恢复喂养时间、术后吻合口狭窄或梗阻等指标比较,差异有统计学意义(均P<0.05)。其余因素组间比较,差异均无统计学意义(均P>0.05)。
表1 患儿一般资料两组间的比较 [±s;n/%]

表1 患儿一般资料两组间的比较 [±s;n/%]
肠功能障碍组(n=192)非肠功能障碍组(n=175)项目 t/χ2 P 项目 χ2 P住院时间(d)年龄(d)<7≥7性别肠功能障碍组(n=192)27.3±17.1非肠功能障碍组(n=175)20.7±15.1 3.8960.058 11.714 0.001 173(90.1)19(9.9)162(92.6)13(7.4)0.700 0.403 148(77.1)44(22.9)106(60.6)69(39.4)6.289 0.012男女115(59.9)77(40.1)95(54.3)83(45.7)1.177 0.278 63(32.8)129(67.2)37(21.1)138(78.9)胎龄早产足月出生体重低体重(<2500g)正常体重(≥2500g)腹腔感染8.020 0.005 58(30.2)134(69.8)76(43.4)99(56.6)6.903 0.009 42(21.9)150(78.1)19(10.9)156(89.1)9.260 0.002 52(27.1)140(72.9)75(42.9)100(57.1)10.066 0.002闭锁类型Ⅰ型/Ⅱ型Ⅲ型/Ⅳ型闭锁位置十二指肠空回肠/结肠手术方式侧侧吻合端端吻合/肠造瘘术术后恢复喂养时间(d)≤3>3术后吻合口狭窄/梗阻30(15.6)162(84.4)10(5.7)165(94.3)4.152 0.042是否40(20.8)152(79.2)31(17.7)144(82.8)0.571 0.450 28(14.6)164(85.4)40(22.9)135(77.1)有无2.287 0.130败血症术中肠管切除长度(cm)≤10 11~20>20 118(61.5)60(31.3)14(7.3)87(49.7)66(37.7)22(12.6)有无15(7.8)177(92.2)22(12.6)153(87.4)5.9770.051
2.2 术后患儿肠功能障碍危险因素Logistic 回归分析
以CIA 术后患儿是否发生肠功能障碍为因变量,单因素分析结果中有统计学意义的因素作为自变量(自变量赋值方式见表2)进行Logistic 回归分析,Logistic 回归分析结果见表3。从表3可见,出生体重(OR=2.005,P=0.010)、闭锁类型(OR=0.536,P=0.018)及术后恢复喂养时间(OR=0.472,P=0.001)为CIA 术后患儿肠功能障碍发生的独立危险因素(P<0.05)。初步建立CIA 术后患儿发生肠功能障碍预测模型:Logit(P|发生肠功能障碍)=0.566+0.695×出生体重的赋值+0.624×闭锁类型的赋值+0.750×术后恢复喂养时间的赋值。

表2 自变量赋值方式
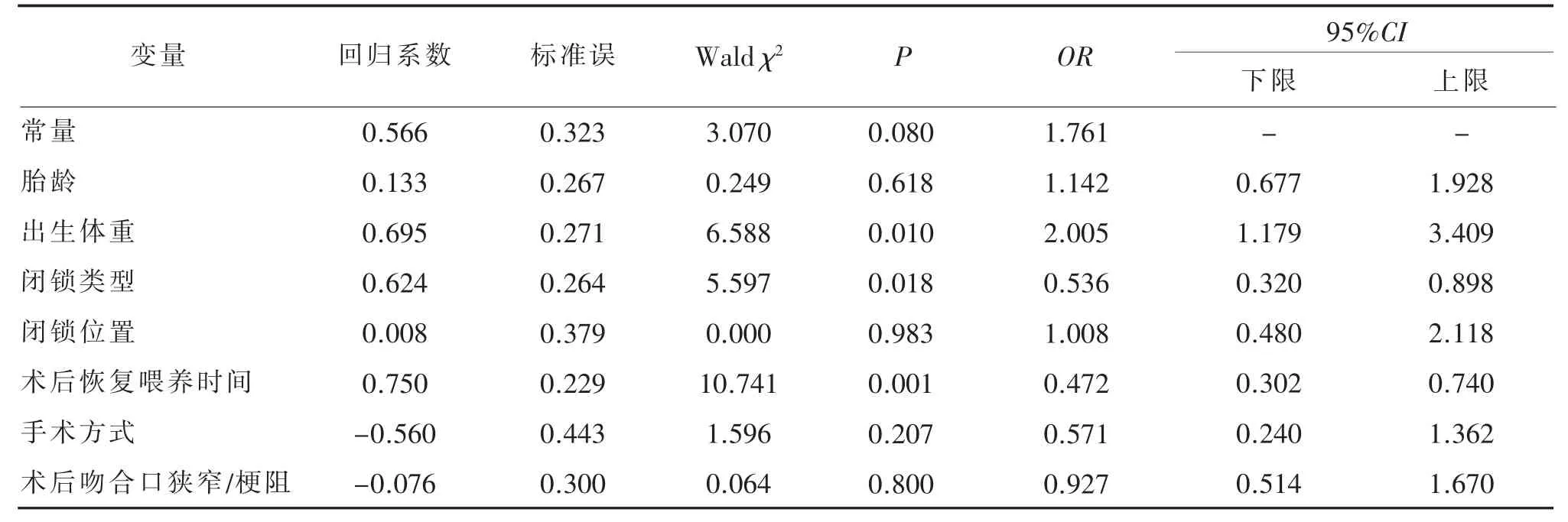
表3 先天性肠闭锁术后患儿肠功能障碍危险因素Logistic 回归分析 (n=367)
2.3 术后患儿发生肠功能障碍模型的预测效果
采用受试者操作特征曲线检验预测模型与CIA 术后患儿肠功能障碍发生的拟合效果,见图1。该预测模型曲线下面积为0.781(95%CI 为0.727~0.835,P<0.001),以最大约登指数(0.879)为最佳临界点,该预测模型敏感度为98.3%,特异度为89.6%,提示模型预测效果较好。Hosmer-Lemeshow检验结果显示,χ2=7.181,P=0.517。
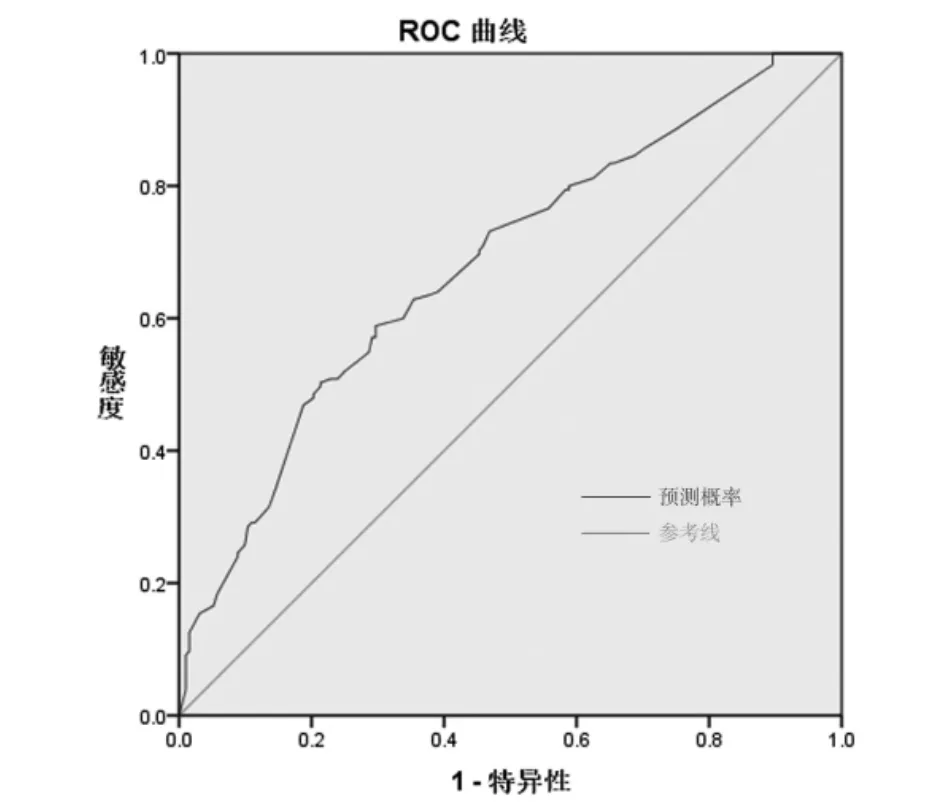
图1 先天性肠闭锁术后患儿发生肠功能障碍风险预测模型的受试者操作特征曲线
3 讨论
3.1 CIA 术后患儿肠功能障碍发生情况
本研究结果显示,52.3%的患儿术后出现不同程度的肠功能障碍。研究显示[17],闭锁近端肠壁肠神经系统发育不完善、Cajal 间质细胞及神经肌肉接头的改变、远端肠壁病变等是导致术后肠动力障碍的关键因素,此外患儿胎龄、出生体重、多发畸形、手术方式的选择、肠管切除范围等原因都对患儿术后肠道功能产生影响。长时间的肠动力障碍增加院内感染的风险,延长住院时间,患儿发生喂养不耐受、感染、吻合口瘘等并发症的几率增加。
3.2 CIA 术后患儿肠功能障碍危险因素分析
3.2.1 低出生体重 出生体重是反映新生儿宫内生长发育的重要指标,本研究结果显示,低出生体重患儿术后发生肠功能障碍的风险较高(OR=2.005,P=0.010),结果与其他学者的研究结果相一致[12,19]。低出生体重患儿胃肠肌肉组织薄弱,消化道结构及肠壁神经丛发育不完善,肠道激素水平及胃肠协调能力弱,加上手术应激反应,小肠自主神经调节能力差,患儿术后更易发生喂养困难及肠消化吸收功能欠佳[20-21]。目前,临床对于病情平稳的早产、低出生体重儿,术后采用“全合一”静脉营养液24h 持续匀速泵入,纠正胎龄29~30 周后对患儿进行口腔功能锻炼[22](包括早期喂养、口腔按摩、吞咽功能锻炼、非营养性吸吮等),每日1 次,每次5~10min,以调节患儿肠神经系统,强化吸吮-吞咽能力,提高患儿血氧饱和度,增加患儿舒适感与安全感。待患儿胃肠减压颜色变清(且量少于1 mL/kg)、可闻及肠鸣音、恢复自主排便时可评估患儿胃肠功能情况后喂养[9],初始量以5%葡萄糖水鼻饲,逐渐过渡至新生儿配方奶粉并根据患儿喂养情况增减奶量,直至患儿经口喂养量达标准日龄喂养量(早产儿标准热量为110~135 kcal/kg/d[23])的70%可予以出院进一步进行家庭疗护。
3.2.2 闭锁类型 本研究结果显示,闭锁类型为CIA 术后患儿肠功能障碍发生的独立危险因素(OR=0.536,P=0.018),Ⅲ/Ⅳ型闭锁患儿术后肠功能障碍发生率高于Ⅰ/Ⅱ型,结果与其他学者[24]的研究基本一致。相关研究发现[25],闭锁类型与肠管病变范围有关,Ⅲ/Ⅳ型闭锁需进行多段切除吻合,术后吻合口张力大,容易出现短肠、吻合口梗阻等并发症,而Ⅰ/Ⅱ型闭锁肠管切除长度短,远端吻合口张力小,术后肠道功能恢复相对较好。此外,CIA患儿术后肠功能恢复过程中,细小肠管短期内被动扩张,尤其高闭锁类型的患儿肠管扩张范围更大,单位面积的神经细胞减少,肠壁肌层变薄,很大程度上影响了肠管的蠕动收缩功能。
3.2.3 术后恢复喂养时间 本研究结果还发现,术后恢复喂养时间为CIA 术后患儿肠功能障碍发生的独立危险因素(OR=0.472,P=0.001),即患儿术后恢复喂养时间越早,发生肠功能障碍发生率越低。研究显示[26],长期静脉营养诱发机体炎症反应,损伤患儿胃肠黏膜屏障功能,术后2~3d 喂养不仅不会增加患儿术后并发症的发生,还可以促使患儿胃肠激素水平变化,增加患儿肠道适应性,术后恢复排便时间提前。术后早期肠内喂养还可提高胃肠道酶活性及血浆胃动素浓度,增加胃肠血流量,有效保护肠道屏障功能,为肠黏膜提供营养底物,触发胃肠运动作出适应性改变,降低术后应激和胰岛素抵抗,从而影响患儿胃肠道功能[27-28]。因此,临床护士应在患儿术后早期评估其胃肠动力,根据胃肠动力情况采用渐进式喂养方式,以提高患儿胃肠耐受能力,早期达到全量经口喂养,以促进患儿早期康复。
3.3 CIA 术后患儿发生肠功能障碍风险预测模型的预测效果较好
一般认为,ROC 曲线下面积在0.5~0.7 之间诊断价值较低,在0.7~0.9 之间诊断价值中等,在0.9以上诊断价值较高[29]。CIA 术后患儿发生肠功能障碍风险预测模型的受试者操作特征曲线下面积为0.781(95%CI 为0.727~0.835,P<0.001),并且该预测模型敏感度为98.3%,特异度为89.6%,提示模型预测效果较好,同时有较好的敏感度和特异度。通过Hosmer-Lemeshow 拟合优度检验来评价预测模型的校准能力,结果提示,模型预测值与实际观测值之间的差异没有统计学意义,说明预测模型有较好的校准能力。
4 结论
本研究构建的CIA 术后患儿发生肠功能障碍风险预测模型,其预测效果和敏感度、特异度较好。CIA 术后患儿发生肠功能障碍发生率为52.3%,出生体重、闭锁类型、术后恢复喂养时间是CIA 术后肠功能障碍的独立危险因素。临床护理人员应针对这些危险因素,积极探索制定个体化护理方案,并开展多学科协作,形成规范合理有效的CIA 术后管理体系,以促进小儿术后肠胃功能尽快恢复。由于研究时间的局限,本研究为单中心回顾性研究,CIA 术后患儿发生肠功能障碍危险因素纳入范围还不够全面,未来将进一步进行全面的探索。
