纳米TiO2制备、表征及光催化降解染料废水的综合设计实验
2020-03-06孔春燕陈玉婷王爱丽商书波王文强张秀玲
孔春燕,陈玉婷,王爱丽,商书波,王文强,张秀玲,王 芳
(德州学院 化学化工学院,山东 德州 253023)
实验教学是培养大学生创新能力和实践能力的重要途径之一,但是各高校实验教学多偏重基本实验和专业实验,对综合实验重视程度不够,综合实验不同于基本实验和专业实验的地方在于注重强化综合能力,要求学生灵活、创造性地应用所学知识,设计出具有科学性的实验方案[1]。近年来,为培养全方位发展的人才,我国不断深化教育改革,本科生实验课程教学改革必须紧跟时代的需求更新实验教学理念,新的实验教学内容应紧密结合学科前沿和社会发展的需求,同时注重知识的系统性、整体性和相互交叉渗透性,通过研究型综合实验培养学生的创新能力[2-4]。结合目前光催化降解环境污染物这一研究热点问题,将科研中成熟的实验移植到教学中,教师给定研究方向和实验题目后,学生通过查阅文献自主设计实验方案,该综合实验可以有效培养大学生自主设计实验、运用所学知识发现问题、解决问题的能力,从而起到培养学生的创新能力和实践能力的良好教学效果。
1 综合实验流程
综合实验流程包括前期准备工作和实验实施阶段两部分,流程图见图1。
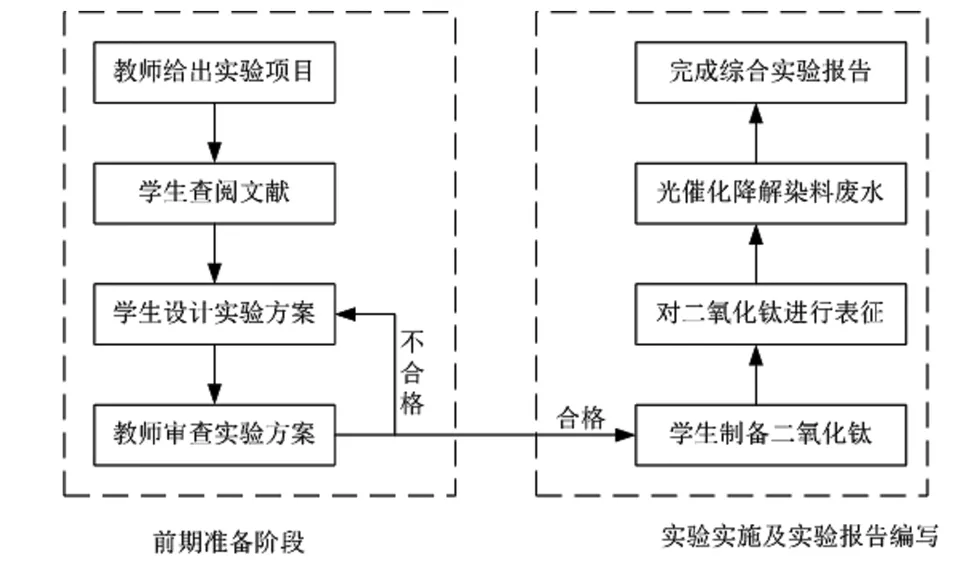
图1 综合实验流程图
1.1 前期准备工作
前期准备工作包括学生查阅文献、设计实验方案、教师审核反馈、最终确定实验方案。具体内容包括:
(1)查阅文献,了解纳米TiO2的制备方法,重点掌握水热合成法制备纳米TiO2,根据文献设计利用水热合成法制备纳米TiO2的实验方案及步骤;
(2)查阅相关文献,了解纳米TiO2的表征方法,选择实验室现有仪器,对催化剂进行表征;
(3)查阅光催化降解染料废水的相关文献,了解对光催化效果产生影响的反应条件,设计光催化降解模拟染料废水的实验步骤;
(4)设计实验方案。
1.2 实验实施阶段
实验实施阶段,学生需要独立制备材料,测试材料性能,利用制备的TiO2作为催化剂,光催化降解模拟染料废水。
1.3 实验报告编写
实验完成后,学生需要将实验数据归纳、整理,并进行分析处理,根据实验数据分析所选择实验方案制备材料的特点,及光催化降解染料废水的效果,写出综合实验报告。
2 实验目的
(1)了解纳米TiO2的不同制备方法,掌握水热合成法制备纳米TiO2的方法;
(2)学习扫描电镜、X射线粉末衍射仪等纳米TiO2的性能表征方法;
(3)掌握光催化降解染料废水的反应机理。
3 实验原理
纳米TiO2是一种新型无机功能材料,具有比表面积大、表面活性高、光吸收性能好、氧化能力强、无毒、成本低等优点,被广泛用作光催化反应的催化剂。TiO2具有三种晶型,分别是板钛矿(Brookite)、锐钛矿(Anatase)和金红石(Rutile)[5]。目前,制备纳米TiO2的方法有溶胶凝胶法、均匀沉淀法、微乳法和水热法等。水热法以其环境友好、低温,产物纯度高、分散性好、均匀、粒度分布窄、无团聚、晶型好、形状可控、易工业化等优点,本实验选择水热合成法作为制备方法[6]。光催化氧化技术处理染料废水的基本原理是当光波辐射半导体光催化剂,获得的能量大于或等于半导体的带隙能时,形成导带光生电子(e-),同时在价带留下光生空穴(h+)。半导体光催化氧化技术主要依赖于高度活性电子-空穴对与吸附在半导体表面的 OH-和 H2O 等发生氧化还原反应,生成羟基自由基 ·OH,可氧化降解有机污染物,对降解物几乎没有选择性。
4 实验内容
4.1 试剂和仪器
葡萄糖(分析纯),硫酸钛(化学纯),尿素(分析纯),氢氧化钠(分析纯),甲基橙(分析纯)。分析天平(梅特勒),分光光度计,磁力加热搅拌器,电动离心机,电热鼓风干燥箱,水热合成反应釜(聚四氟乙烯材质),X射线粉末衍射仪,扫描电子显微镜,光催化反应器。
4.2 实验步骤及结果
4.2.1 纳米TiO2的制备
(1)准确称取3.6 g硫酸钛溶于30 mL蒸馏水中并不断搅拌,再称取1 g 尿素溶于上述溶液中,继续搅拌直到尿素完全溶解为止。
(2)将反应液放入50 mL反应釜中并在180℃下水热处理3 h,反应完成后取出反应釜,冷却至室温,将反应产物倒出,静置沉淀。
(3)将分离的沉淀物用蒸馏水反复洗涤至中性,最后在80℃下真空干燥即得到白色的TiO2粉末。
4.2.2 自制纳米TiO2的表征
(1)采用 X 射线粉末衍射仪(XRD)对产物进行表征,研究所得产物的物相组成和晶体结构。引导学生思考,如何通过 XRD 谱图判断样品组成是否为预想的产物,是否含有杂质。让学生通过查阅相关资料得到结论,从而培养学生解决问题的能力。 表征结果见图2。
表征结果表明,实验中制得的TiO2主要为锐钛矿结构和少量的金红石结构。
(2)利用扫描电子显微镜(SEM)对自制TiO2进行表征,观察制备材料的形貌,粒径大小,启发学生思考制备过程中哪些条件可以影响样品形貌,并引导学生设计一些对比实验进行验证。培养学生创新能力,让学生掌握纳米材料制备的过程与方法。
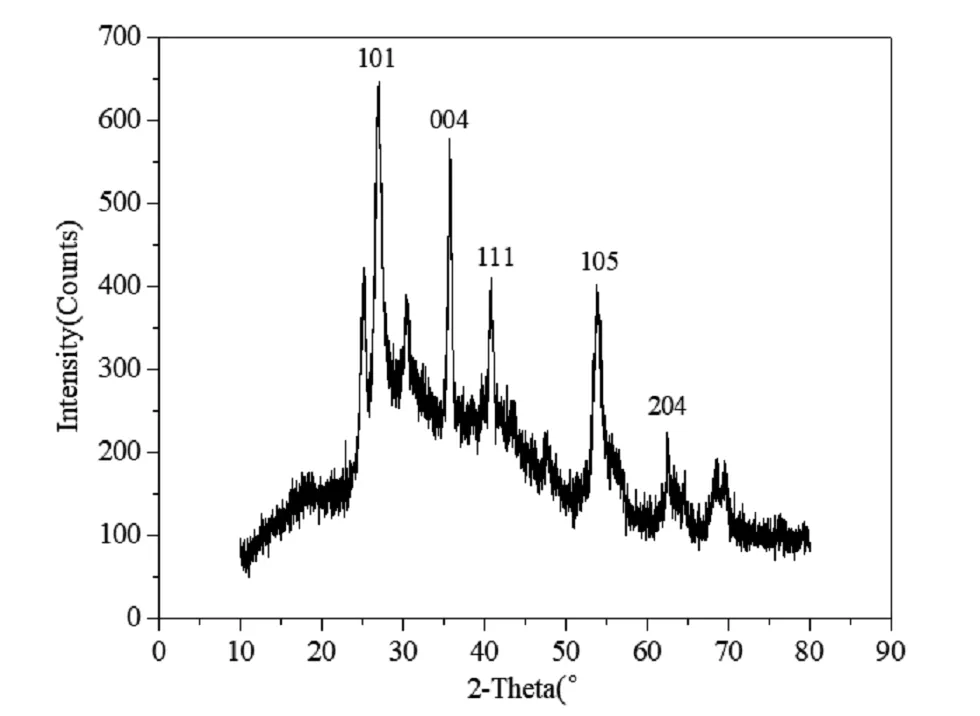
图2 TiO2的XRD谱图

图3 电子显微镜图
从图3可以看出,TiO2粉体的直径在20 nm左右,呈现球状结构,有团聚现象,没有发生破裂,在马弗炉中烧后得到的产物强度较好。
4.2.3 光催化性能测试

图4 甲基橙标准曲线
(1)模拟染料废水的配制。称取1 g 甲基橙放入烧杯中,加入蒸馏水搅拌溶解,倒入1000 mL容量瓶中定容,浓度为1 g/L,作为储备液。取20 mL配制好的1 g/L甲基橙储备液稀释定容到1000 mL,作为模拟染料废水,浓度为20 mg/L。
(2)甲基橙标准曲线的绘制。取9支比色管,分别加入1、5、10、15、20、25、30、40和50 mL浓度为20 mg/L的甲基橙溶液于50 mL比色管中,加入去离子水至50 mL,稀释成浓度为0.4、2、4、6、8、10、12、16和20mg/L的甲基橙溶液。在640 nm波长处,用30 mm的比色皿,以水做参比,测定吸光度,绘制标准曲线,见图4。
(3)取100 mL 甲基橙溶液,加入0.1 g催化剂,于黑暗处磁力搅拌,每隔半小时取样,取样2次,测定TiO2粉末吸附性能。然后磁力搅拌下放入光催化反应器,300 W汞灯光照,每隔30 min取样,离心分离后测定吸光度,测定TiO2粉末光催化性能。
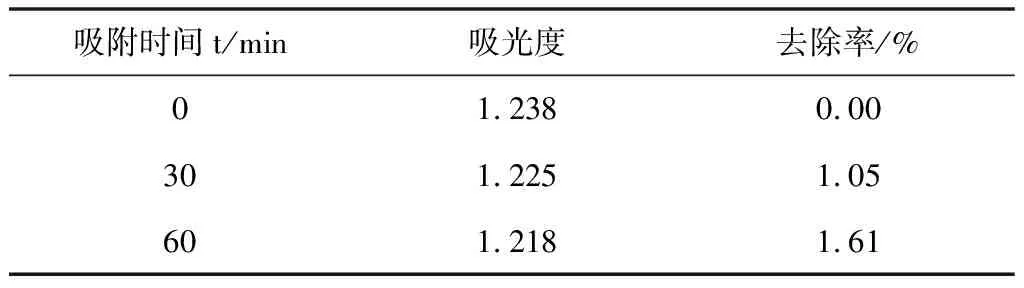
表1 TiO2粉末吸附性能测试数据
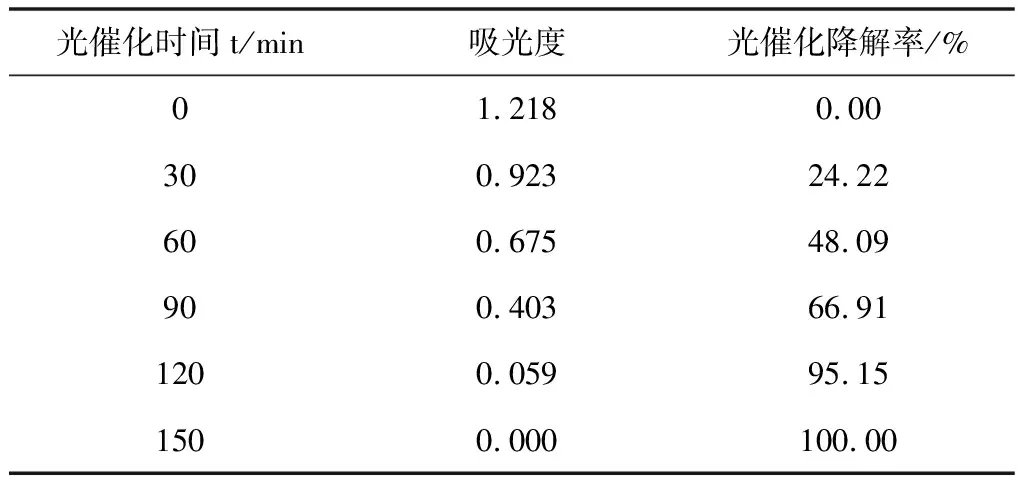
表2 TiO2光催化性能测试数据
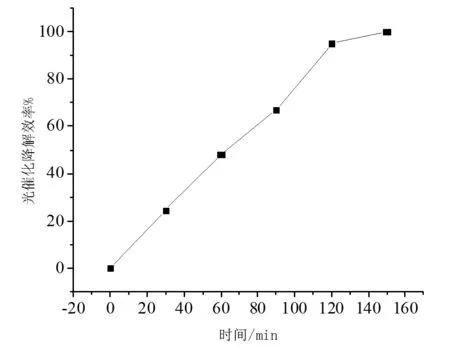
图5 TiO2粉末光催化性能曲线
实验结果表明: 60 min内TiO2对甲基橙的吸附去除率较低,60 min内对甲基橙的吸附去除率大约为1.61%。由表2及图5可知TiO2对甲基橙的光催化降解率随着反应时间的增加而增大,30 min左右甲基橙光催化降解率为24.22%,90 min光催化降解率可达66.91%,150 min时TiO2的光催化降解率为100%,甲基橙溶液基本无色透明。
5 结语
本实验针对目前光催化研究热点,采用水热合成方法制备纳米TiO2,借助仪器对制备产物进行表征与性能测试,并利用自制TiO2催化剂对模拟染料废水进行降解,鼓励学生通过查阅文献,自行设计实验方案,实验设计要求充分考虑学生实验需要制备方法简单易行、原材料廉价且对环境友好,通过实验方案设计培养学生发现问题,解决问题的能力。该实验所涵盖知识点多,是一个跨学科的实验,包括材料制备、仪器分析、环境污染治理等方面的知识,可以充分激发学生对科学试验探索的兴趣,培养学生的科研创新能力。
