高效液相色谱-串联质谱法测定人脑脊液中一线抗结核药浓度Δ
2020-03-06赵冠人王雅薇吴首蓉
西 娜,赵冠人,陈 明,张 策,王雅薇,吴首蓉
(中国人民解放军总医院第八医学中心药剂科,北京 100091)
2017年,世界范围内有1 000万例结核病新发病例,使结核病成为全球第二大致死的传染性疾病,且95%的患者都集中在发展中国家,我国结核病患者数居全球第2位[1]。结核性脑膜炎(tuberculous meningitis,TBM)是由结核分枝杆菌通过淋巴系统或血液系统进入蛛网膜下腔后引起的脑膜和脊髓膜的慢性非化脓性炎症反应[2],占所有结核病相关死因的1.5%~3.2%[3]。即便得到全力救治,仍有>16%的TBM患者最终死亡;而且>27%的痊愈患者可能患有严重的神经系统疾病[4]。目前,关于TBM的研究较少,既没有规范的治疗方案,也没有客观的疗效标准,治疗大多参照肺结核的方案进行[5]。由于存在血-脑脊液屏障,抗结核药在脑脊液中的浓度通常仅为血液中药物浓度的20%~90%[6]。有文献报道,在脑膜正常的情况下,一些药物可以透过血-脑脊液屏障;但在病理状态下,由于脑膜的破坏,血-脑脊液屏障对药物的屏蔽作用有所减弱,进入脑组织的药量将会增加[7]。由于脑膜破坏的程度各异,增加的药量可能不同。一线抗结核药异烟肼(INH)、利福平(REP)、吡嗪酰胺(PZA)及乙胺丁醇(EMB)等属于浓度依赖型抗菌药物,病灶部位药物浓度不足可能导致治疗失败甚至产生耐药,浓度过高则可能出现严重的不良反应。因此,保持脑脊液中适宜的抗结核药浓度对TBM的治疗尤为重要。目前,关于测定脑脊液中抗结核药浓度的文献甚少[8-10]。本研究采用高效液相色谱-串联质谱(high performance liquid chromatography-mass spectrometry/mass spectrometry,HPLC-MS/MS)的方法,建立了可同时测定人脑脊液中一线抗结核药INH、REP、PZA及EMB浓度的高通量检测方法,通过测定人脑脊液中各药物含量,为临床个体化用药提供指导。
1 材料
1.1 仪器
3200 Q TRAP LC/MS/MS系统+电喷雾电离(AB SCIEX公司);5417型台式高速离心机(Eppendorf公司);不同规格的移液器(Eppendorf公司);Milli-Q超纯水仪(默克公司)。
1.2 药品与试剂
INH、REP、PZA、EMB及对乙酰氨基酚(IS)均购于中国药品生物制品检定所,批号依次为100578-201501、130496-201502、100178-201503、100165-201504及100018-201508。甲醇(Fisher)为色谱纯,购自Sigma公司;空白脑脊液由中国人民解放军总医院第八医学中心神经外科提供。
2 方法与结果
2.1 HPLC-MS/MS分析条件
2.1.1 质谱参数:选用Turbo Ion Spray为离子源,离子化电压为5 500 V,离子源温度为450 ℃,源内气体(GS1为40 psi;GS2为45 psi),气帘气为25 psi。采用正离子模式,多反应监测(multiple reaction monitoring,MRM)扫描。其他质谱参数见表1。
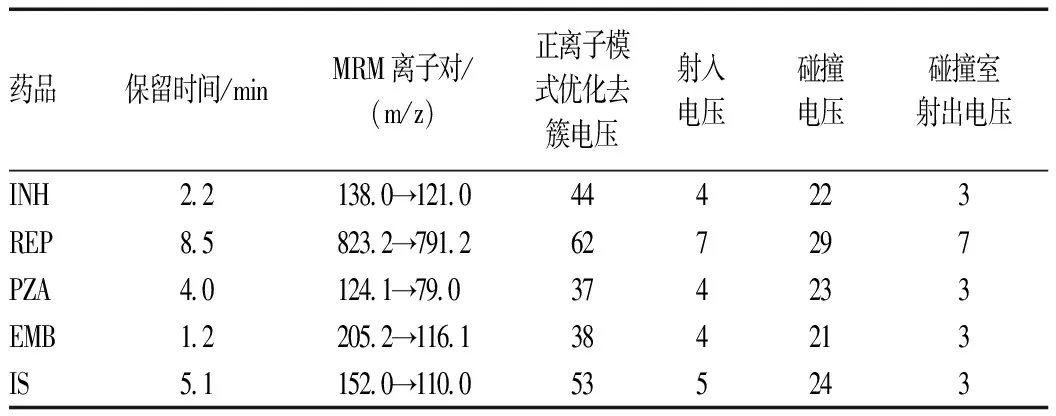
表1 各种抗结核药及内标的质谱参数Tab 1 Mass spectrometry parameters of anti-tuberculosis drugs and internal standards
2.1.2 色谱参数:选用Poroshell 120SB C18柱为色谱柱(Agilent,4.6 mm×50 mm,2.7 μm),甲醇-0.2%醋酸溶液为流动相,室温(25 ℃)条件下进行梯度洗脱,流速0.5 ml/min;进样量5 μl。其中,洗脱条件中有机相甲醇比例如下,0.01 min:5%;2.50 min:18%;5.00 min:36%;6.00 min:70%;6.01 min:80%;9.00 min:90%;9.01 min:5%;12.00 min:5%。
2.2 溶液制备
精确称量INH 9.8 mg、REP 30.0 mg、PZA 50.0 mg和EMB 8.0 mg,置于100 ml容量瓶中,用50%甲醇定容至刻度,得各标准品质量浓度依次为INH 98 μg/ml、REP 300 μg/ml、PZA 500 μg/ml及EMB 80 μg/ml的母液。对上述母液用50%甲醇进行稀释,得到各标准品质量浓度,INH质量浓度依次为1.96、4.9、9.8、19.6、49.0、78.4及98.0 μg/ml,REP质量浓度依次为6.0、15.0、30.0、60.0、150.0、240.0及300.0 μg/ml,PZA质量浓度依次为10.0、25.0、50.0、100.0、250.0、400.0及500.0 μg/ml,EMB质量浓度依次为1.6、4.0、8.0、16.0、40.0、64.0及80.0 μg/ml。精确称量IS 1.61 mg置于100 ml容量瓶中,用50%甲醇定容至刻度,得质量浓度为16.1 μg/ml的内标溶液。上述试药均置于6 ℃冰箱保存。
2.3 样品处理
精确量取100 μl脑脊液,向其中加入10 μl内标溶液,加入300 μl甲醇进行蛋白沉淀,经涡旋离心后,取上清液200 μl,并用400 μl超纯水稀释混匀后,进样分析。
2.4 方法专属性考察
分别取人空白脑脊液、加入标准品和内标的脑脊液和实际服用抗结核药物的脑脊液,依照“2.3”项下方法处理样品,按照“2.1”分析条件进行分析。结果显示,各试样得到良好分离,内源性物质不影响各物质定量分析,见图1。
2.5 线性关系考察
量取90 μl空白脑脊液7份,分别加入系列标准品溶液各10 μl,得到不同质量浓度的标样。其中,INH质量浓度依次为0.196、0.49、0.98、1.96、4.90、7.84及9.8 μg/ml;REP质量浓度依次为0.60、1.5、3.0、6.0、15.0、24.0及30.0 μg/ml;PZA质量浓度依次为1.0、2.5、5.0、10.0、25.0、40.0及50.0 μg/ml;EMB质量浓度依次为0.16、0.4、0.8、1.6、4.0、6.4及8.0 μg/ml。依照“2.3”项下方法处理样品,按照“2.1”项下条件进行分析。各标品峰面积与内标峰面积的比值(U)与浓度(C)进行线性回归,得各自线性方程分别为:UINH=0.397C-0.0145,r=0.999 0,线性范围0.196~9.8 μg/ml;UREF=0.225C-0.042 4,r=0.999 1,线性范围0.60~30.0 μg/ml;UPZA=0.105C-0.005 49,r=0.998 5,线性范围1.0~50.0 μg/ml;UEMB=0.109C+0.009 52,r=0.996 7,线性范围0.16~8.0 μg/ml。
2.6 基质效应考察
首先将空白脑脊液用甲醇按照1∶3的比例进行蛋白沉淀后,量取90 μl上清液3份,分别加入低、中及高3个质量浓度的各药物标准品溶液10 μl,混匀,得低、中及高3个质量浓度INH(0.49、1.96及7.84 μg/ml)、REP(1.5、6.0及24.0 μg/ml)、PZA(2.5、10.0及40.0 μg/ml)和EMB(0.4、1.6及6.4 μg/ml)的脑脊液样品,依照“2.3”项下方法处理样品,按照“2.1”项下条件进行分析并记录峰面积A1。另以50%甲醇溶液为基质,同样配置上述各浓度样品,记录各自峰面积A0,基质效应=A1/A0×100%。各药物在人脑脊液中的基质效应:INH为(97.3±1.56)%,REP为(96.7±1.87)%,PZA为(97.6±1.53)%,EMB为(94.5±1.7)%,该结果表明脑脊液基质不影响各药物的定量分析。
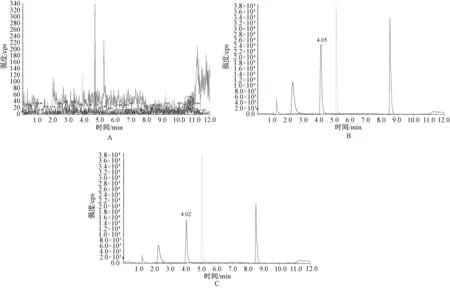
A.空白脑脊液;B.加入标准品和内标的脑脊液;C.服用抗结核药物的脑脊液;质谱峰从左至右依次为:乙胺丁醇、异烟肼、吡嗪酰胺、内标-对乙酰氨基酚、利福平A. blank cerebrospinal fluid; B. cerebrospinal fluid added with standards and internal standards; C. cerebrospinal fluid taken with anti-tuberculosis drugs; the mass spectrum peaks from left to right are: ethambutol, isoniazid, pyrazinamide, internal standard-acetaminophen, rifampin图1 质谱图Fig 1 Mass spectrum
2.7 精密度考察
量取90 μl空白脑脊液3份,分别加入低、中及高3个浓度的各药物标准品溶液10 μl,混匀,得低、中及高3个质量浓度INH(0.49、1.96及7.84 μg/ml)、REP(1.5、6.0及24.0 μg/ml)、PZA(2.5、10.0及40.0 μg/ml)和EMB(0.4、1.6及6.4 μg/ml)的脑脊液样品,依照“2.3”项下方法处理样品,按照“2.1”项下条件进行分析,每个质量浓度日内连续进样5次,连续进样5 d。结果表明,各药物日内及日间精密度的RSD均<10%,见表2。
2.8 提取回收率考察
量取90 μl空白脑脊液3份,分别加入低、中及高3个质量浓度的各药物标准品溶液10 μl,混匀,得低、中及高3个质量浓度INH(0.49、1.96及7.84 μg/ml)、REP(1.5、6.0及24.0 μg/ml)、PZA(2.5、10.0及40.0 μg/ml)和EMB(0.4、1.6及6.4 μg/ml)的脑脊液样品,依照“2.3”项下方法处理样品,按照“2.1”项下条件进行分析并记录峰面积A2。另以已经过甲醇沉淀蛋白的空白脑脊液上清液为基质,同样配制上述各质量浓度,依照“2.3”项下方法处理样品,按照“2.1”项下条件进行分析并记录峰面积A1,提取回收率=A2/A1×100%,结果见表2。可见,按照实验开发的脑脊液处理方法,各药物提取回收率高,损失较小。
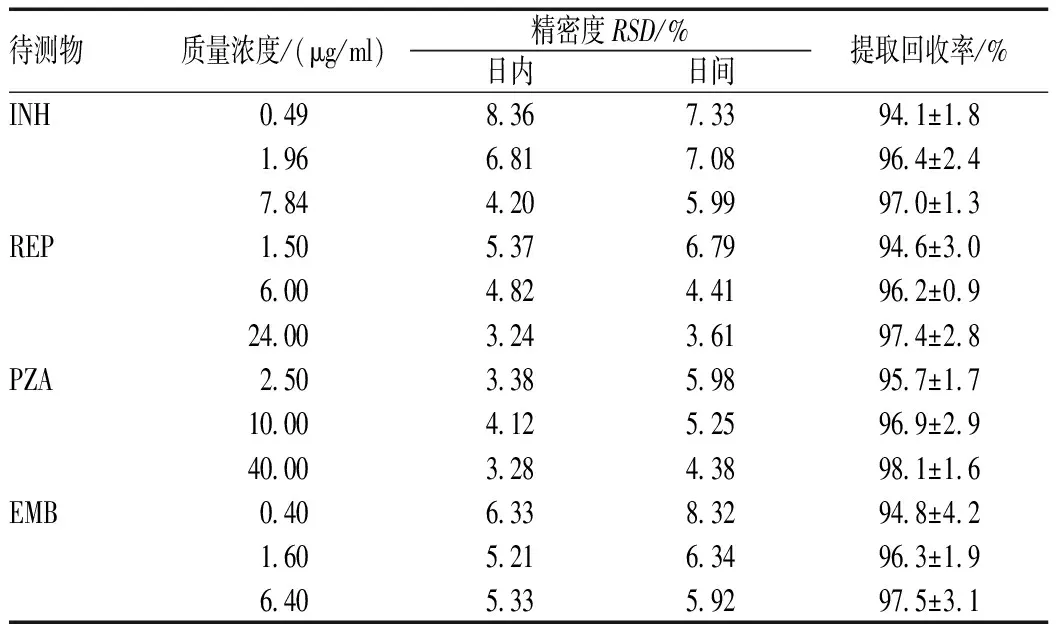
表2 精密度考察及提取回收率结果Tab 2 Precision and recovery results
2.9 稳定性考察
量取90 μl空白脑脊液3份,分别加入低、中及高3个质量浓度的各药物标准品溶液10 μl,混匀,得低、中及高3个质量浓度INH(0.49、1.96及7.84 μg/ml)、REP(1.5、6.0及24.0 μg/ml)、PZA(2.5、10.0及40.0 μg/ml)和EMB(0.4、1.6及6.4 μg/ml)的脑脊液样品,依照“2.3”项下方法处理样品后,分别考察室温放置24 h、经过3次冻融后各药品的稳定性。按照“2.1”项下条件进行分析,测定不同时间点及各状态下各药物浓度并与0时刻比较,变化率均<10%,表明在上述贮存条件下样品较为稳定,不影响本方法对样本的准确测定。
3 讨论
3.1 色谱条件的优化
目前,国内外最常用的药物浓度分析方法有高效液相色谱法、限进性液相色谱法、高效液相色谱-质谱联用法和荧光分光光度法等[11]。每种方法改变其中的条件,所得出的结果也会有所不同,因此,在测定药物的浓度时,不止需要找到合适的检测方法,还需找到测定结果的影响因素,通过改变这些条件来改进方法。4种抗结核药中,EMB没有紫外吸收,对于其测定,大都采用液相色谱串联质谱法[12],测定结果较好,具有特异性,但是灵敏度低。可以根据测定药物的特点,从色谱方法、质谱方法、样品制备方法和避免低浓度样品污染4个方面来联合提高药物检测灵敏度[13]。为了能够同时测定4种药物含量,本研究采用HPLC-MS/MS进行分析。液质联用技术在分析药物及其在各种复杂生物基质中的代谢产物时,由于其选择性强、灵敏度高,不仅可以避免复杂、繁琐且耗时的样品前处理工作,而且能分离鉴定以往难于辨识的痕量药物代谢产物[14]。
同时,由于抗结核药极性差异较大,为了获得满意的分离度及峰形,本研究分别对色谱柱及流动相进行选择优化。色谱柱方面,从柱长及硅胶颗粒大小2个方面进行优化选择,最终以Poroshell 120SB-C18色谱柱(Agilent,4.6 mm×50 mm,2.7 μm)为分析柱,ZORBAX SB C18柱(2.1 mm×12.5 mm,5 μm)为保护柱。流动相方面,考虑到质谱不能使用不能挥发的磷酸盐体系,本研究尝试了甲醇-水体系、甲醇-醋酸水溶液体系、乙腈-水体系及乙腈-醋酸水溶液体系等流动相系统,最终选择以甲醇-0.2%醋酸溶液为流动相进行梯度洗脱,该方法用时较短,分离度良好。本方法流速为0.5 ml/min,流速的大小也直接关系到色谱峰面积的响应值。流速过大,会减少溶质的纵向扩散,不能使药物与限进性填料充分作用,样品不能较多地被保留在柱上,而被流动相冲出,从而降低脑脊液的浓度及响应值,还会造成伸舌峰更加伸舌,拖尾峰更加拖尾的现象;流速过小,会延长药物浓度的分析时间[15]。
3.2 脑脊液处理方法的优化
在脑脊液处理上,本研究尝试了甲醇直接沉淀蛋白法与液-液萃取法两种方法。甲醇直接沉淀蛋白法操作简单,杂质较少,回收率高;而液-液萃取法操作繁琐、杂质较多,且样品损失较大。故本研究采用甲醇直接沉淀蛋白法对脑脊液样品进行处理。REP具有光敏感性,在实验操作中要尤其引起注意,否则会引起药物回收率降低,灵敏度下降[16]。
综上所述,本方法稳定性好,特异性强,测定结果准确,适合临床脑脊液样本的高通量分析。
