姜黄素通过NLRP3/Caspase-1/IL-1β轴对低氧性肺动脉高压的干预作用
2020-03-06蔡学定陈马云李文雅吴佩亮姚丹黄晓颖
蔡学定,陈马云,李文雅,吴佩亮,姚丹,黄晓颖
(温州医科大学附属第一医院 呼吸与危重症医学科,浙江 温州 325015)
肺动脉高压(pulmonary hypertension,PH)是一种以肺血管收缩与结构重塑为特征的慢性进展性疾病,病死率高[1]。肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)的异常增殖是肺血管结构重塑的主要原因,而多种炎症反应参与其中[2-3]。目前已有研究探明姜黄素可通过Nod样受体蛋白3(Nod-like receptor protein 3, NLRP3)炎性体相关通路调节炎症反应[4]。姜黄素是否在低氧性肺动脉高压(hypoxia induced pulmonary hypertension,HPH)疾病模型中通过NLRP3炎性体相关通路抑制炎症反应从而抑制HPH未见报道。本研究通过建立HPH大鼠模型和低氧PASMCs模型,探讨姜黄素通过NLRP3/Caspase-1/IL-1β轴对HPH的作用机制。
1 材料和方法
1.1 材料 SPF级健康雄性SD大鼠,购于上海斯莱克公司,体质量200~300 g,动物模型实验在温州医科大学实验动物中心进行,实验动物许可证号:SYXK(浙)2019-0009。DMEM高糖培养基、0.25% EDTA胰酶、胎牛血清、青/链霉素购于美国Gibco公司。RIPA裂解缓冲液、BCA蛋白定量检测试剂盒、蛋白酶磷酸酶抑制剂、ECL超敏化学发光底物购于美国Thermo Pierce公司。姜黄素单体购于德国Merck公司。兔源性NLRP3抗体、兔源性Caspase-1抗体、兔源性IL-1β抗体购于英国Abcam公司。
1.2 动物分组及造模 将18只SD大鼠随机分为3组(每组6只):常氧组(N)、低氧组(H)、低氧+姜黄素组(HC)。N组大鼠均置于SPF环境中;H组大鼠造模时被放置于密封的低氧舱内,通过动态充入N2使舱内的O2浓度保持在9%~11%,在自动控制器的作用下将湿度维持在55%~65%,CO2控制在2%以下,低氧造模低氧时间为每日8 h,共造模4周。HC组大鼠进入低氧舱造模前,腹腔注射40 mg/kg姜黄素,N组、H组均腹腔注射等体积0.9%氯化钠溶液。每日密切关注SD大鼠活动情况、饮食情况、精神状态[5]。
1.3 细胞分离培养及分组造模 取SD大鼠,消毒及麻醉后在超净台内取得肺组织,分离出肺细小动脉,去除内皮细胞后剪碎,用含有1 mL 0.2%胶原酶I消化,待肺小动脉碎块消化为絮状物后离心,去上层胶原酶后加入培养基放置于37 ℃、5% CO2培养箱内培养。3 d后得到原代PASMCs,将细胞传代至 4~6代时收集细胞用于实验。细胞饥饿12 h使细胞周期同步化,之后进行干预。分为N组、H组、HC组(姜黄素浓度为10 μg/mL)。N组培养条件:37 ℃,5% CO2,21% O2,74% N2;H组培养条件:37 ℃,5% CO2,5% O2,90% N2;HC组培养条件:37 ℃,5% CO2,5% O2,90% N2,姜黄素(10 μg/mL)。3组培养时间均为24 h。
1.4 CCK-8法检测细胞活性 将PASMCs制成单细胞悬液并接种至96孔板中,恒温培养箱培养24 h。分组方式同前,每组6个孔,周边设无细胞的空白组,分别置入相应培养箱进行培养。干预结束后,倒去培养液,每孔中加入培养基和CCK-8试剂,迅速避光放入培养箱中,1~2 h后快速放入酶标仪中进行检测,设置酶标仪检测波长450 nm,测量各孔的吸光度(absorbance,A)。
1.5 肺动脉压力测定及右心肥大指标检测 用20%乌拉坦腹腔注射麻醉SD大鼠,固定大鼠后分离右颈外静脉,测压管插管至肺动脉,生理记录仪测得每只大鼠平均肺动脉压(mean pulmonary artery pressure,mPAP)[6]。大鼠放血处死,取出完整心脏,完整分离右心室(right ventricle,RV)、左心室和室间隔(left ventricle+septum,LV+S),吸干水分后称重,记录并计算右心肥厚指数=[RV/(LV+S)],反映右心肥大情况。
1.6 肺血管结构重塑指标检测 取大鼠右肺上叶放入4%多聚甲醛中固定24 h,肺组织常规石蜡包埋切片,行HE染色。制作好的HE染色切片在普通光学显微镜下观察,随机选取6个不同视野下的肺中小动脉拍照。采用Image-Pro Plus 6.0图像分析软件分析肺中小动脉管壁面积/管总面积(wall area to total area,WA/TA)以反映肺血管结构重塑的程度。
1.7 Western blot检测NLRP3、Caspase-1、IL-1β相关蛋白表达 提取各组大鼠肺组织标本和PASMCs总蛋白,测定总蛋白浓度。取细胞蛋白样品40 μg、组织蛋白样品60 μg分别行凝胶电泳,转膜至PVDF膜后,脱脂牛奶封闭,4 ℃孵育一抗过夜。次日清洗后孵育二抗,漂洗后运行成像仪进行曝光。使用Quantity One测定各条带的灰度值,以GAPDH为内参,各组目的蛋白与对应GAPDH灰度值的比值即为该组蛋白的相对表达量,比较各组蛋白的表达差异。
1.8 统计学处理方法 采用SPSS21.0统计软件进行分析。计数资料用表示,多组间比较用单因素方差分析,组间两两比较用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 3组PASMCs数量比较 与N组(1.079±0.039)比,H组(1.326±0.060)PASMCs数量显著增加,差异 有统计学意义(P<0.05);与H组比,HC组(1.158± 0.050)PASMCs数量显著减少,差异有统计学意义(P< 0.05);与N组比,HC组PASMCs数量差异有统计学意义(P<0.05)。
2.2 3组大鼠mPAP、右心肥大程度比较 与N组比,H组大鼠mPAP显著升高,右心肥大指数明显升高,差异有统计学意义(P<0.05);与H组比,HC组大鼠mPAP明显下降,右心肥大指数明显下降,差异有统计学意义(P<0.05);与N组比,HC组mPAP、右心肥大指数差异均有统计学意义(P<0.05)。见表1。
表1 3组大鼠mPAP和右心肥大程度比较(每组6只,
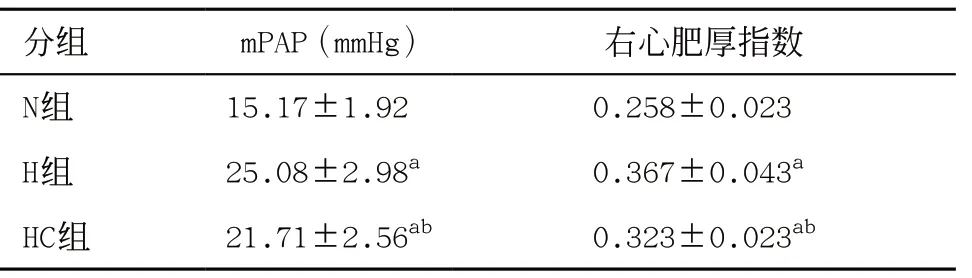
表1 3组大鼠mPAP和右心肥大程度比较(每组6只,
与N组比:aP<0.05;与H组比:bP<0.05
?
2.3 3 组大鼠肺血管重塑程度的比较 与N 组(0.493±0.018)比,H组大鼠WA/TA(0.789±0.042)明显升高,差异有统计学意义(P<0.05);与H组比,HC组大鼠WA/TA(0.652±0.034)明显下降,差异有统计学意义(P<0.05);与N组比,HC组大鼠WA/TA差异有统计学意义(P<0.05)。N组肺动脉平滑肌层未见明显增厚,管壁均匀一致;H组肺动脉肌化明显,管腔明显狭窄,中膜平滑肌细胞明显增生,管壁明显增厚;HC组较H组肺动脉肌化减轻,管壁增厚好转,管腔狭窄不明显,见图1。
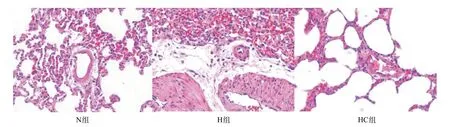
图1 3组大鼠肺血管HE染色图(×400)
2.4 3组PASMCs和肺匀浆NLRP3/Caspase-1/IL-1β轴相关蛋白表达量比较 与N组比,H组PASMCs的NLRP3、Caspase-1、IL-1β表达明显升高,差异有统 计学意义(均P<0.05);与H组比,HC组PASMCs的 NLRP3、Caspase-1、IL-1β表达明显下降,差异有统计学意义(P<0.05);与N组比,HC组NLRP3、Caspase-1、IL-1β表达差异均有统计学意义(P<0.05),见表2 和图2。与N组比,H组大鼠肺匀浆的NLRP3、Caspase-1、IL-1β表达明显升高,差异有统计学意义(均P<0.05);与H组比,HC组大鼠肺匀浆的NLRP3、Caspase-1、IL-1β表达明显下降,差异有统计学意义(P<0.05),见表3和图3。
表2 3组PASMCs NLRP3、Caspase-1、IL-1β蛋白的表达量(每组6只,)
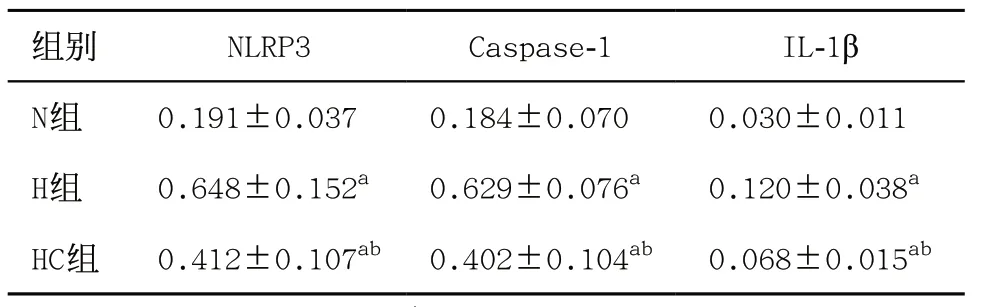
表2 3组PASMCs NLRP3、Caspase-1、IL-1β蛋白的表达量(每组6只,)
与N组比:aP<0.05;与H组比:bP<0.05
组别 NLRP3 Caspase-1 IL-1β N组 0.191±0.037 0.184±0.070 0.030±0.011 H组 0.648±0.152a 0.629±0.076a 0.120±0.038a HC组 0.412±0.107ab 0.402±0.104ab 0.068±0.015ab
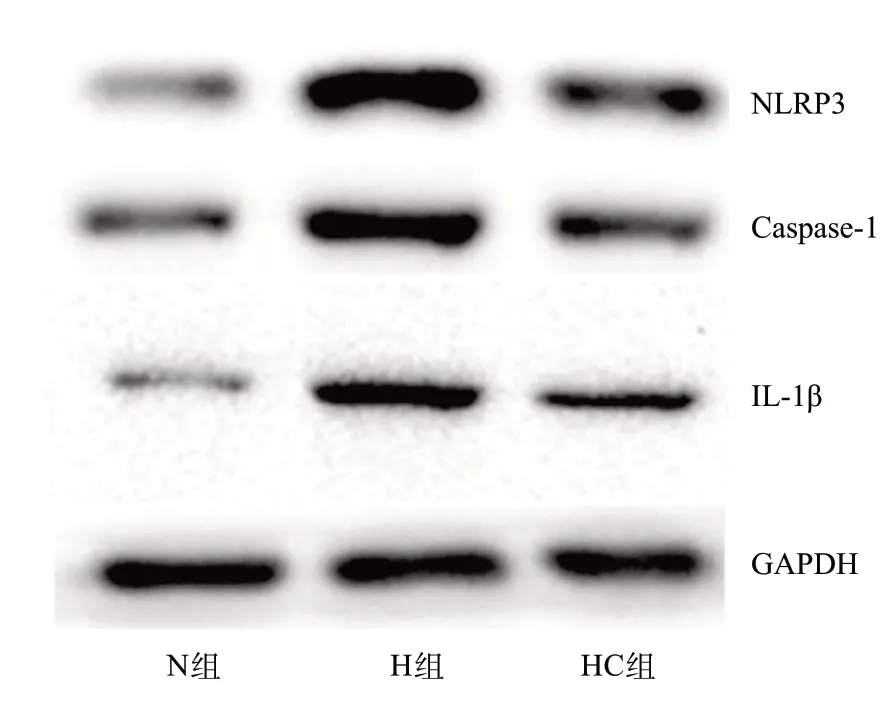
图2 3组PASMCs NLRP3、Caspase-1、IL-1β蛋白Western blot图
3 讨论
PH是一类以肺血管重塑和肺血管阻力增加为特征的进展性疾病,病死率高,预后欠佳。PASMCs的异常增殖是肺血管重塑的重要因素[2,7],肺动脉炎症反应在其中发挥重要作用[3],目前临床上针对PH的治疗措施较为有限。抑制局部肺动脉炎症及PASMCs异常增殖可以缓解甚至逆转肺血管重塑和PH疾病进展,因此寻求该类的新型中药单体,并深入探究其作用机制和有效靶点十分重要。
表3 3组大鼠肺匀浆NLRP3、Caspase-1、IL-1β蛋白的表达量(每组6只,)
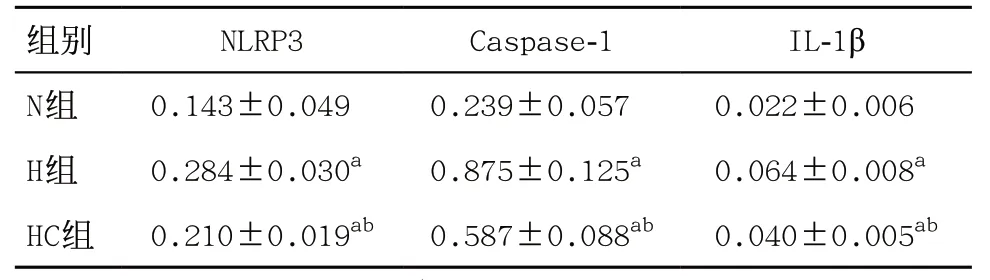
表3 3组大鼠肺匀浆NLRP3、Caspase-1、IL-1β蛋白的表达量(每组6只,)
与N组比:aP<0.05;与H组比:bP<0.05
组别 NLRP3 Caspase-1 IL-1β N组 0.143±0.049 0.239±0.057 0.022±0.006 H组 0.284±0.030a 0.875±0.125a 0.064±0.008a HC组 0.210±0.019ab 0.587±0.088ab 0.040±0.005ab

图3 3组大鼠肺匀浆NLRP3、Caspase-1、IL-1β蛋白Western blot图
姜黄素是从姜黄属植物姜黄根茎中提取的一种植物多酚,有研究报道其具有抗炎[4]、抗肿瘤[8]、抗氧化和心血管保护等作用。NLRP3复合体是一种大分子复合蛋白,由识别蛋白-NLRP3、衔接蛋白-凋亡相关斑点样蛋白(apoptosis-associated specklike protein containing CARD,ASC)和Caspase-1 组成[9]。Nod样受体(nod-like receptor,NLR)感知应激后聚集为NLRP3 寡聚体,通过ASC募集激活Caspase-1,将无活性的前体Caspase-1活化为剪切体Caspase-1(cleaved Caspase-1),cleaved Caspase-1可切割炎症因子IL-1β并使之成熟和释放,参与炎症反应[9-10],在缺血再灌注、遗传性周期性发热综合征等疾病的发生发展中起到关键作用[11]。
至于PH相关研究领域,有报道称Caspase-1可调控炎症因子,参与PH的发生发展[12];IL-1β可介导小鼠肺血管周围的巨噬细胞募集,促进PASMCs异常增殖,造成肺血管重塑,与PH的疾病进展密切相关[13]。YIN等[14]研究报道姜黄素可以通过抑制NLRP3炎性体,进而抑制IL-1β的分泌,起到抗炎的作用。由于炎症反应是低氧损伤的重要病理机制之一[15],姜黄素可能通过抑制NLRP3炎性体,进而抑制Caspase-1的活化,从而减少IL-1β的成熟和释放,减轻炎症所致的PASMCs增殖,改善血管的重塑,最终降低HPH大鼠的肺动脉压力。
本研究发现姜黄素可以有效降低HPH大鼠的肺动脉压力,明显改善右心肥大及肺血管重塑,抑制低氧诱导的PASMCs异常增殖。进一步探究其作用机制和具体靶点,发现姜黄素可降低HPH大鼠肺匀浆以及低氧PASMCs中NLRP3、Caspase-1以及IL-1β的表达。姜黄素可能通过抑制NLRP3/Caspase-1/IL-1β轴减少低氧诱导的炎症反应,从而改善低氧PASMCs异常增殖和HPH大鼠肺血管重塑,从而降低肺动脉压力,对HPH有治疗作用。
