人巨细胞病毒增殖性感染UL111A基因转录本特征及变化
2020-03-06刘欣谢旺凯孙祥威陈治元沈贤薛向阳
刘欣,谢旺凯,孙祥威,陈治元,沈贤,薛向阳
(1.温州医科大学附属第二医院育英儿童医院胃肠外科,浙江温州325027;2.温州医科大学基础医学院微生物学与免疫学教研室,浙江温州325035)
人巨细胞病毒(humancy to megalovirus,HCMV)是一种广泛存在于人群中的病毒,属于β疱疹病毒家亚科,包含236kb的双链DNA基因组,其人群携带率在婴幼儿约为20%,随着年龄的增长在发展中国家可达100%[1]。在免疫功能正常的个体,HCMV感染通常无明显临床症状,而其在免疫功能缺陷的个体,如HIV患者,或者在接受器官移植的患者中会再次激活而导致严重的并发症,甚至危及生命[2]。UL111A基因在HCMV中编码细胞因子,其主要编码cmvIL-10和LAcmvIL-10蛋白,由于它们与hIL-10有一定的同源性,可以通过与IL-10R结合而发挥免疫抑制调节功能[3-6]。目前AD169 UL111A基因在人包皮成纤维细胞(human foreskin fibroblast,HFF)中的转录本的情况还未见报道,本研究旨在探究HCMV增殖性感染不同时间点UL111A基因转录本特征及变化。
1 材料和方法
1.1 材料 HFF和293T细胞购自中国科学院细胞库,AD169 病毒株购自美国ATCC,TRIzol、Lipofectamine 2000 购自美国Invitrogen公司,pcDNA3.1载体为本实验室保存,反转录试剂盒(FSQ301)购自日本TOYOBO公司,HA-Tag兔抗(#3724)和羊抗兔IgG HRP偶联(#7074)二抗购自美国CST公司,高保真酶购自南京诺唯赞生物科技有限公司,PCR反应试剂盒、pEASY-Blunt Zero Cloning Kit购自北京全式金生物有限公司,DNA回收试剂盒购自北京天根公司。
1.2 方法
1.2.1 AD169病毒感染HFF细胞:将1×105个HFF细胞铺于6孔板中,过夜贴壁后换液,然后加入纯DMEM培养基和感染复数MOL=1的AD169病毒液,放入37 ℃含5% CO2的培养箱中孵育2 h,每隔30 min取出摇晃1次,2 h后换成含10% FBS的DMEM培养基,放入培养箱继续培养,此时记为感染开始时间,随后感染12 h,24 h,48 h,72 h,5 d,7 d,9 d后提取RNA用于后续实验。
1.2.2 RNA提取和RT-PCR:根据TRIzol RNA提取试剂说明书,分别提取12 h,24 h,48 h,72 h,5 d, 7 d,9 d不同时间点的感染AD169病毒的HFF细胞的RNA,测浓度后按照ReverTra Ace®qPCR RT Master Mix with gDNA Remover试剂盒说明书,分别取 0.5 μg RNA反转录10 μL体系cDNA,各自取1 μL cDNA模板按照PCR反应试剂说明书行PCR检测(循环数29个),引物为vIL-10AFP,vIL-10ARP,然后再分别取1 μL上述PCR产物稀释50倍后再取1 μL作为模板行PCR检测(循环数35个),引物为vIL-10CFP,vIL-10CRP,vIL-10EFP,vIL-10ERP,vIL-10GFP,vIL-10GRP,vIL-10IFP,vIL-10FRP,引物序列见表1。
1.2.3 UL111A转录本检测和测序鉴定:分别取 12 h,24 h,48 h,72 h,5 d,7 d,9 d不同时间点经反转录cDNA,经高保真酶PCR后行胶回收然后连pEASY-Blunt Zero Cloning载体经Trans1-T1感受态细胞转化后涂平板,37 ℃倒置过夜,挑选单克隆送测序鉴定。PCR引物为vIL-10AFP,vIL-10ARP(见表1),条件为94 ℃完全变性5 min,35个循环的 94 ℃变性30 s,58 ℃退火,72 ℃延伸1 min,最后充分延伸10 min。
1.2.4 真核表达载体pcDNA3.1-cmvIL-10、pcDNA3.1-LAcmvIL-10和pcDNA3.1-unspliced的构建及鉴定:使用带BamHI/EcoRI酶切位点的转录本编码区特异性引物,同时在后向引物C端加入一个HA标签序列,PCR扩增产物与pcDNA3.1载体经过酶切酶连,构建相应的载体,提取质粒通过Lipofectamine 2000质粒试剂转染293T细胞,24 h后用RIPA裂解液裂解提取细胞蛋白,15%的SDS-PAGE胶进行电泳,转膜,5%脱脂牛奶室温封闭1 h,然后使用HA-Tag兔抗(1:1 000)4 ℃孵育过夜,TBST洗膜后,加入羊抗兔二抗(1:5 000)室温孵育1 h,再次洗涤膜后曝光。
2 结果
2.1 HCMV UL111A基因在增殖性感染期存在3 种形式的转录本 以UL111A全长通用引物PCR检测AD169感染HFF细胞24 h的cDNA,结果见图1,PCR产物经测序,结果显示的3个条带分别为未剪切形式,LAcmvIL-10和cmvIL-10转录本序列。为了进一步探究转录本外显子连接位点的碱基序列,图2的测序峰图呈现了结果的可靠性。U111A 3种转录本模式见图3。
2.2 HCMV感染不同时间点UL111A转录本特征及其变化 为探索不同时间点是否存在不同的UL111A转录本特征变化,首先,我们使用UL111A特异性引物(见图4)PCR检测感染AD169 病毒的不同时间点HFF细胞的cDNA,并经测序验证,oLX2-12 以及oLX3-13 特异性引物扩增的产物显示的2 个条带分别为包含第1个内含子和不包含第1个内含子的模式,并且随着时间的增加,剪切第1个内含子模式越来越少。同样的,oLX6-14和oLX6-15特异性引物扩增的产物主要显示包含第2个内含子的模式,在早期12 h或24 h,可见较弱剪切第2内含子条带模式。随后我们以UL111A全长通用引物PCR检测不同时间点感染HFF的cDNA,扩增产物经切胶回收连载体,挑选大量单克隆送测序进一步检测转录本占比的情况,表2显示在感染的各个时间点,未剪切形式转录本皆占比最多,其次为LAcmvIL-10转录本,而cmvIL-10转录本只在感染的早期(24 h)和晚期 (9 d)被检测到。

表1 UL111A相关引物

图1 感染AD169病毒HFF细胞24 h cDNA反转录图
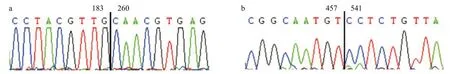
图2 不同转录本剪切位点峰图
2.3 CmvIL-10、LAcmvIL-10 和unspliced 3 种转录本均能在293T细胞中有效表达 分别将3 种转录本编码区序列所构建的真核表达载体pcDNA3.1-cmvIL-10、pcDNA3.1-LAcmvIL-10 和pcDNA3.1- unspliced质粒转染293T细胞,24 h后提取的细胞蛋白经Western blot验证可见目的大小的特异性条带,而转染空载质粒的293T细胞无特异性条带,表明构建的载体能在293T细胞中有效表达,见图5。
3 讨论
HCMV是目前已知的最大的疱疹病毒,其编码大量病毒基因组蛋白包括细胞因子、趋化因子和它们的受体,在机体发挥相应的免疫调节功能,并且与肿瘤等疾病有密切的关联[7-10]。巨细胞病毒AD169株完整序列在1990年首次被研究报道,其编码了超过200多个蛋白质[11]。在我们的研究中首次报道了AD169病毒株感染HFF细胞后,UL111A基因在其增殖性感染的不同时间点转录本特征,通过RT-PCR和挑选单克隆实验检测到了cmvIL-10、LAcmvIL-10和未剪切形式转录本。CmvIL-10蛋白编码UL111A基因3个外显子序列的175个氨基酸,尽管它与hIL-10只有约27%的同源性,但是它可以通过与hIL-10R结合发挥免疫抑制作用,如降低单核细胞主要组织相容性复合物I(major histocompatibility complex I, MHC I)和MHC II的表达,降低内皮细胞基质金属蛋白酶的活性,损伤体外内皮细胞的迁移和细胞滋养层细胞的侵袭性[12-15]。hIL-10是一个多效价的细 胞因子,在机体炎症和免疫功能发挥免疫抑制等作用[16]。LAcmvIL-10蛋白编码包含第2个内含子序列的139 个氨基酸,其终止密码子在第2 个内含子内,其N端127个氨基酸与cmvIL-10蛋白相同,C端12个氨基酸不同,相似的,LAcmvIL-10同样发挥一部分的免疫抑制功能,如抑制人初始骨髓细胞和单核细胞MHC II的表达[17],然而其机制可能不同于cmvIL-10,如LAcmvIL-10不能诱导stat3的磷酸化,并且其下调MHC II不能通过hIL-10R的中和抗体拮抗,提示其可能通过其他途径发挥功能[18]。未剪切形式蛋白编码包含两个内含子序列的78个氨基酸,其终止密码子在第一个内含子内,这与先前的报道的ORF79高度同源,ORF79是HCMV Towne病毒株上的形态改变区域(mtr II),可以发挥致癌作用诱导恶性形成[19]。之前有研究报道[20],在AD169病毒感染的MRC-5细胞中,共发现8种转录本,但是关于各自生物学功能尚未进行深入研究。我们只发现其中3种转录本,可能是由于其他转录本存在极少,因此未能检测到。UL111A基因编码的cmvIL-10蛋白最早是在感染Towne株病毒的MRC-5细胞和感染AD169病毒的HEL299细胞的增殖性感染阶段被发现[4,6],而其编码的LAcmvIL-10蛋白则是在感染Toledo株病毒的人粒-巨噬祖细胞的潜伏感染阶段被发现,随后的研究也证明了LAcmvIL-10蛋白同样存在于感染了Toledo株病毒的HFF细胞的增殖性感染阶段[5,21]。
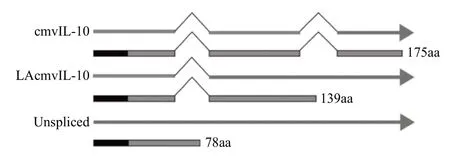
图3 UL111A 3种不同转录本mRNA和氨基酸模式图

图4 感染AD169病毒HFF细胞RT-nest PCR图
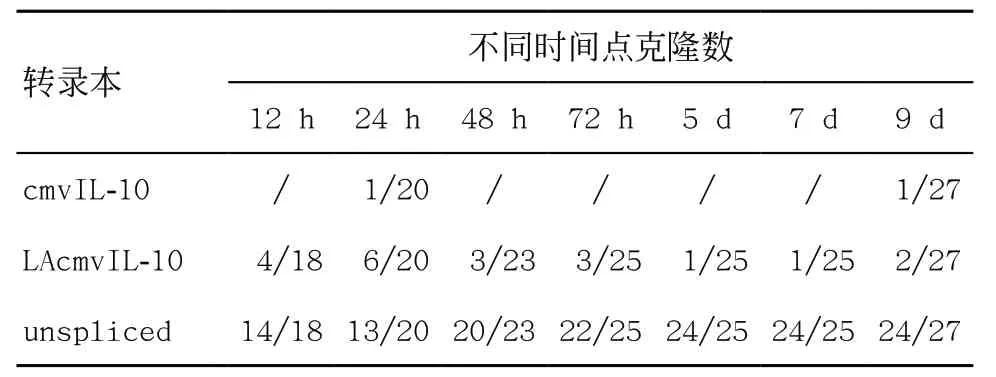
表2 UL111A基因在AD169感染HFF细胞中的转录本情况

图5 UL111A 3种转录本所构建的真核表达载体Western blot验证图
总的来说,我们的研究阐明了感染AD169病毒的HFF在HCMV增殖性感染不同时间点的转录本特征及其变化,但关于其机制还有待进一步研究。
