颅内出血新生儿血清白细胞介素6及肿瘤坏死因子α水平变化及临床意义
2020-03-05
(新疆生产建设兵团第十三师红星医院儿科,新疆 哈密 839000)
颅内出血(intracranial hemorrhage,ICH)系脑血管破裂引起血液外溢至颅腔所致,又称为出血性脑卒中或出血性脑血管病[1]。新生儿颅内出血主要由产伤或缺氧引起,是新生儿常见的一种颅内病变,严重威胁着新生儿的生命安全,对其健康发育造成严重不良影响。颅内出血后一方面血肿压迫脑组织及占位效应导致的脑组织损伤,另一方面各种炎性细胞因子介导的急性炎症反应可导致继发性脑损伤[2-3]。已有大量临床研究[4-5]证实,成人颅内出血患者血清白细胞介素6(interleukin-6,IL-6)及肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)水平与健康人群比较明显增加,是成人急性脑出血的危险因素。目前国内关于颅内出血新生儿血清IL-6及TNF-α水平变化的研究较为罕见。本研究以健康新生儿为对照,分析颅内出血新生儿血清IL-6及TNF-α水平变化情况,并比较不同出血量、不同出血部位、不同预后情况患儿血清IL-6及TNF-α水平的差异,旨在探明新生儿颅内出血血清IL-6及TNF-α水平早期检测的临床价值,以期为临床提供参考。
1 资料和方法
1.1一般资料 选择2017年2月—2019年5月本院收治的新生儿颅内出血86例为观察组。观察组纳入标准:①根据临床表现并结合颅脑CT检查明确诊断,符合第4版《实用新生儿学》[6]中的新生儿颅内出血诊断标准;②患儿家属签署知情同意书。排除标准:①合并心肝肾疾病及自身免疫性疾病者;②伴呼吸窘迫综合征、缺血缺氧性脑病、重度窒息、重症感染者;③预后生存时间≤8 h者;④未完成本研究中所有观察项目者。86例患儿中,男49例,女37例;胎龄36~42周,平均(38.74±2.16)周;出生体重2718~3654 g,平均(3183.86±274.65) g;出生至确诊时间12~68 h,平均(29.85±6.52) h;少量出血(<15 ml)22例,中量出血(15~30 ml)35例,大量出血(>30 ml)29例;出血部位:脑室内9例,硬膜下10例,脑实质24例,蛛网膜下腔43例。另随机抽取同期在本院分娩的健康新生儿43例为对照组,其中男24例,女19例;胎龄35~42周,平均(38.13±2.24)周;出生体重2735~3618 g,平均(3173.24±281.72) g。两组性别、胎龄及出生体重比较差异无统计学意义(P>0.05),具有可比性。
1.2方法 入院后,采用美国GE 64排螺旋CT机进行横断面检查,扫描层厚度为6 mm,层距为6 mm。观察组患者于治疗前及治疗7 d后,对照组于体检时分别于清晨空腹抽取静脉血5 ml,置于室温下保存0.5~1 h后在1000 r/min下离心30 min,吸取血清置于4℃在3000 r/min下离心10 min,然后取上清置于-20℃冰箱保存待测。IL-6及TNF-α水平检测:采用酶联免疫吸附法(Enzyme Linked Immuno Sorbent Assay,ELISA)[7]检测标本血清中IL-6及TNF-α水平,试剂盒均购于上海超研生物科技有限公司,操作严格按照试剂盒说明及其所提供的相应资料说明进行。观察组治疗方法:给予综合治疗措施,包括抗惊厥、给予营养细胞、降低颅内压及止血治疗,如果有必要则待病情稳定后给予高压氧治疗。
1.3观察指标 ①观察组治疗前IL-6、TNF-α水平与对照组比较,评价新生儿颅内出血患儿与健康新生儿IL-6、TNF-α水平的差异。②出血量按照多田氏计算公式进行计算,即V=π/6×A×B×C,A为血肿最大程度,B为同一层面与A垂直的最大宽径,C为血肿层面数。观察组根据出血量的不同分为少量出血组(出血量<15 ml,22例)、中量出血组(出血量为15~30 ml,35例)和大量出血组(出血量>30 ml,29例),比较不同组患儿IL-6、TNF-α水平的差异,评价新生儿颅内出血患儿IL-6、TNF-α水平与出血量的关系。③观察组患儿根据出血部位不同分为脑室内出血组9例、硬膜下出血组10例、脑实质出血组24例、蛛网膜下腔出血组43例,比较不同组患儿IL-6、TNF-α水平的差异,评价新生儿颅内出血患儿IL-6、TNF-α水平与出血部位的关系。④观察组患儿治疗7 d后根据预后情况分为痊愈组(治疗后临床症状及体征全部消失,58例)和未痊愈组(治疗后颅内高压症状明显改善但仍存在各种神经系统症状及体征、颅内高压症状无明显改善或加重或死亡,28例),比较两组患儿治疗前后IL-6、TNF-α水平差异。
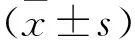
2 结果
2.1观察组患儿IL-6、TNF-α水平与对照组比较 观察组患儿IL-6、TNF-α水平均明显高于对照组,组间比较差异有统计学意义(P<0.001),见表1。

表1 观察组患儿IL-6、TNF-α水平与对照组比较

2.2观察组不同出血量患儿IL-6、TNF-α水平比较 不同出血量组患儿IL-6、TNF-α水平比较差异有统计学意义(P<0.01);中量出血组及大量出血组与少量出血组比较、大量出血组与中量出血组比较,差异有统计学意义(P<0.001)。见表2、图1。

表2 不同出血量组患儿IL-6、TNF-α水平比较


图1 不同出血量组患儿IL-6、TNF-α水平比较
2.3观察组不同出血部位患儿IL-6、TNF-α水平比较 不同出血部位组患儿IL-6、TNF-α水平比较差异无统计学意义(P>0.05),见表3、图2。

表3 不同出血部位患儿IL-6、TNF-α水平比较


图2 观察组不同出血部位患儿IL-6、TNF-α水平比较
2.4不同预后患儿IL-6、TNF-α水平比较 痊愈组患儿IL-6、TNF-α水平低于未痊愈组,组间比较差异有统计学意义(P<0.001),见表4。

表4 不同预后颅内出血新生儿IL-6、TNF-α水平比较

3 讨论
新生儿颅内出血是临床上常见的神经系统疾病,颅内出血后因血肿的占位效应引起微循环障碍,导致病灶周围脑组织损伤,加上水肿等原因极易引起脑缺氧缺血。若患儿出血量较大或诊治不及时,可累及脑干导致脑干功能受损,最终影响运动及感知中枢,遗留不同程度的运动功能及感知功能障碍等神经系统后遗症[8]。因此,在新生儿颅内出血的临床治疗中,早期评估出血后的脑损伤程度及预后情况对治疗决策具有重要的意义。
新生儿在发生颅内出血后在应激状态下血清中的炎性细胞因子水平会出血急剧升高,进而引起颅内出血后继发脑损伤。IL-6在神经系统中主要由神经胶质细胞合成和分泌而来,其参与了机体损伤及防御的过程,是一种具有多重调节功能的细胞因子,可发挥调节神经体液的作用[9]。机体在正常情况下IL-6的含量水平较低,其含量升高通常与肿瘤、炎症反应及机体自身免疫疾病的发生及进展相关[10]。颅内出血发生后数分钟内神经胶质细胞即可被激活,激活后的神经胶质细胞可分泌大量的IL-6;IL-6水平的升高一方面可直接诱导神经细胞凋亡从而加重脑组织损伤程度,另一方面可增加白细胞与内皮细胞的黏附性,引起血管内皮细胞损伤增加了血脑屏障通透性,并释放大量自由基,导致神经细胞的凋亡及加重脑水肿形成[11]。本研究显示:观察组患儿血清IL-6水平明显高于对照组,观察组患儿随出血量的增加IL-6水平明显升高,痊愈患儿治疗前的IL-6水平低于未痊愈患儿,且组间比较差异有统计学意义。这提示:新生儿颅内出血后IL-6水平明显升高,IL-6可能参与了其发病过程,早期检测IL-6水平对新生儿颅内出血病情及预后评估具有重要价值。
TNF-α是一种由单核巨噬细胞产生的具有多效应及广泛生物活性的炎性细胞因子,可促进炎性反应进而在免疫及非免疫系统中发挥重要调节作用[12]。TNF-α在正常情况下具有抗感染及抗肿瘤的作用,但如果机体发生病理损伤,TNF-α持续大量释放并参与疾病炎性反应的进展过程。脑组织中TNF-α主要由胶质细胞合成与分泌而来,颅内出血使血管内皮细胞受到损伤并破坏血脑屏障,引起继发性脑损伤并诱导TNF-α大量分泌,诱导脑细胞凋亡且加重脑缺血性损伤[13]。本研究结果显示:观察组患儿治疗前血清TNF-α水平明显高于对照组,观察组患儿随着出血量的增加TNF-α水平也明显升高,血清TNF-α水平大量出血组>中量出血组>少量出血组,痊愈患儿TNF-α水平低于未痊愈患儿,且组间比较差异均有统计学意义。这提示:新生儿颅内出血后TNF-α水平明显升高,TNF-α可能参与了其发病过程,早期检测TNF-α水平对新生儿颅内出血病情及预后评估具有重要价值。
另外本研究还显示,观察组患儿中,不同出血部位组患儿血清IL-6和TNF-α水平比较差异无统计学意义。提示颅内出血患儿血清IL-6和TNF-α水平与出血部位无关,说明早期检查新生儿颅内出血患儿血清IL-6和TNF-α水平对评估出血部位不具有敏感性。
综上所述,新生儿颅内出血患儿血清IL-6和TNF-α水平较健康新生儿明显升高,出血量越大,血清IL-6和TNF-α水平越高,血清IL-6和TNF-α水平越低,患儿预后越良好,早期检测新生儿血清IL-6和TNF-α水平对新生儿颅内出血患儿病情及预后评估具有重要意义。
