水分和盐胁迫下小麦种子萌发相关性状的QTL定位
2020-03-05王秀华于鸿翔潘香逾李斯深
王秀华,于鸿翔,潘香逾,赵 岩,李斯深
(1.山东农业大学农学院,作物生物学国家重点实验室,山东泰安 271018; 2.山东农业大学资源与环境学院,山东泰安 271018)
小麦(TriticumaestivumL.)是世界第一大粮食作物,占世界农作物种植面积的17%;在我国,小麦有近5 000年的种植历史,是仅次于水稻和玉米的第三大粮食作物,每年消费量高达1.2亿t,关系到国计民生[1]。小麦生长期间,易受到水分和盐碱等非生物因素的影响[2-3]。据统计,世界上约70%的小麦种植于干旱半干旱地区,因水分胁迫导致的小麦减产幅度一般在15%左右,严重时可达80%~100%[4]。同时,全世界盐碱地面积约9.54亿hm2[5]。水分胁迫和土壤盐碱化问题,已经成为世界农业可持续发展的制约因素,因此对小麦节水抗旱和耐盐性进行研究具有重要意义。
小麦的节水抗旱、耐盐性均是由多基因控制的数量性状。前人对小麦节水抗旱和耐盐相关QTL定位做了大量工作。例如,Acuna-Galindo等[6]在水分胁迫下检测到502个与节水抗旱相关的QTL;任永哲等[7]以“小偃54×京411”RIL群体为材料,在盐胁迫条件下检测到25个与小麦最长根长、根系干重、地上部干重和总干重及其相对性状相关的QTL。但截至目前,有关水分和盐胁迫下小麦种子萌发性状的QTL研究较少。
QTL定位频率较高的染色体区域被称为相对高频QTL(relative high frequency QTL,RHF-QTL),由于在高频区域内定位到特定性状QTL的可能性较大,亦被称为QTL热点区域。而某一性状的QTL热点区域可能会与其他性状的QTL热点区域重合,从而形成QTL簇(QTL cluster,QC)[8]。RHF-QTL和QC对小麦的遗传改良有重要意义,前人在对小麦的研究中发现了数目不等的RHF-QTL和QC。例如,Guo等[9]在对小麦营养利用效率的QTL研究中,发现了32个RHF-QTL和26个QC。满君霞等[10]在对小麦苗期抗旱QTL研究中,共发现11个RHF-QTL和1个QC。
萌发期作为小麦生育期的初始阶段,对水分和盐胁迫的响应尤为敏感。提高萌发期节水抗旱、耐盐性,能从植物自身遗传发育上克服水分和盐胁迫对其生长的影响,保证基本苗的数量和质量,为高产稳产奠定基础[11-12]。因此,研究该时期水分和盐胁迫下小麦种子萌发相关性状的QTL定位具有重要的意义。本研究以“泰农18×临麦6号”重组自交系群体(recombinant inbred lines,RIL)为材料,对水分和盐胁迫下小麦种子萌发相关性状进行测定,结合已构建的分子标记遗传图谱进行QTL定位[13-14],以期为小麦节水、耐盐相关基因的克隆以及分子标记辅助选择育种提供参考。
1 材料与方法
1.1 试验材料
试验材料为小麦“泰农18×临麦6号”RIL群体(TL-RIL,包含184个株系)及其亲本。泰农18是本课题组选育的品种,于2008年通过山东省审定。临麦6号是临沂市农科院选育的小麦品系。课题组前期试验发现,在种子萌发期,临麦6号种子萌发和幼苗生长较快,胚芽鞘较长,但泰农18的根系发育较好。
1.2 试验设计和性状调查
试验设置3种处理,分别用20%PEG-6000水溶液、100 mmol·L-1NaCl溶液和去离子水进行水分胁迫处理(D)、盐胁迫处理(S)和正常处理(C)。试验进行2次,第1、2次试验及其平均值分别用D1、S1、C1,D2、S2、C2和DA、SA、CA表示。每次设置3个重复。将50粒种子放入铺有双层滤纸的发芽盒(18.5 cm×13.5 cm×7.5 cm)中,加入25 mL的胁迫溶液或蒸馏水,在光照培养箱中培养(25 ℃,光照强度1 000 lx,12 h; 20 ℃,12 h),分别在第2、4、6、8天统计发芽数(根长≥种长,芽长≥1/2种长时为发芽),第8天随机取10株幼苗对小麦萌发相关性状进行测定。
测定的小麦萌发相关性状包括发芽势、发芽率、萌发指数、萌发抗旱系数、萌发耐盐系数、根长、苗长、胚芽鞘长、根干重和苗干重。发芽势、发芽率采用陈蕾太等[15]的方法,萌发指数、萌发抗旱系数和萌发耐盐系数采用李国瑞等[16]的方法。主要计算公式如下:
发芽势=第4天的发芽数/供试种子数×100%
发芽率=第8天的发芽数/供试种子数×100%
萌发指数=(1.00)n2+(0.75)n4+(0.50)n6+(0.25)n8,其中,n2、n4、n6、n8分别为第2、4、6、8天的发芽率
萌发抗旱系数=(水分胁迫下的萌发指数/对照萌发指数)×100
萌发耐盐系数=(盐胁迫下的萌发指数/对照萌发指数)×100
1.3 数据分析

利用张桂芝等[13]和Zhang等[14]构建的“泰农18×临麦6号”分子标记遗传图谱进行QTL定位。应用QTL IciMapping软件中QTL完备区间作图(ICIM-ADD)法进行QTL分析[19],设置步长为0.5 cM,LOD阈值为2.5。采用本课题组编写的MS Excel(2003) VBA脚本进行QTL作图。
QTL命名方式为“QTL+性状缩写+染色体+同一性状QTL在同一染色体上的出现次数”[20]。定义在D1、D2、DA(或S1、S2、SA,CK1、CK2、CKA)中的两个或两个处理以上的环境中检测到的QTL为RHF-QTL。定义在同一染色体置信区间重叠涉及到2个以上性状的RHF-QTL为QC[21]。
2 结果与分析
2.1 种子萌发性状的表型变异及相关分析
TL-RIL群体在不同处理下各性状变异较大,均表现超亲分离现象(表1)。水分胁迫下各性状变异系数范围为13.20%~27.77%,盐胁迫下为8.20%~17.31%,正常处理下为6.32%~14.24%。各性状的遗传力最大值为58.69%,最小值为15.14%,水分和盐胁迫下的遗传力均低于对照。方差分析表明,各性状的基因型和环境间的变异,除根干重只达到0.01的显著水平外,其余性状均达到了0.001的显著水平,可以进行下一步的QTL定位。
相关分析(表2)表明,3种处理下,苗长、胚芽鞘长和根长3个形态指标间均呈极显著正相关,说明不论在胁迫或非胁迫环境下,小麦萌发期苗、根和胚芽鞘的生长均具有高度的协调一致性;萌发指标间,发芽率、发芽势和萌发指数均与萌发抗旱系数、萌发耐盐系数呈极显著正相关,说明发芽率、发芽势和萌发指数可以作为抗旱、耐盐性的鉴定指标。但萌发抗旱系数和萌发耐盐系数相关性不显著,说明抗旱和耐盐可能是两个独立遗传的性状。大部分形态指标和萌发指标间也呈显著或极显著正相关,说明无论在胁迫或非胁迫条件下,萌发较快的品系生长也都较快。胚芽鞘长与萌发抗旱系数呈极显著正相关,说明胚芽鞘长可以作为抗旱性的鉴定指标。
2.2 种子萌发相关性状的QTL位点
QTL分析表明,共检测到103个与萌发性状相关的QTL,位于除2D、6D外的19条染色体上,单一QTL可解释2.30%~18.79%的表型变异,LOD最大值为15.20(发芽率)。其中,38个QTL为正值,其增加效应来自母本泰农18;65个QTL为负值,其增加效应来自父本临麦6号。QTL的贡献率在10%以上的有43个(占 41.75%),为主效QTL。
103个QTL中有17个RHF-QTL,分布在1A、3A、3B、4A、7A、7B和7D染色体上(表3,图1),对表型变异的平均贡献率为7.55%~ 15.97%。其中,8个RHF-QTL(QGi-1A,QGstc-3A,QGf-3A.2,QGi-3A,QGf-7B.1,QGp-7B,QGp-7D,QGi-7D.2)的增加效应来自父本临麦6号,9个RHF-QTL(QShl-3B.4,QGi-4A,QSdw-7A.1,QGf-7A.1,QGi-7A.1,QSl-7B.1,QGi-7D.1,QGdrc-7D.1,QGf-7D.1)的增加效应来自母本泰农18。对17个RHF-QTL进行分类,第一类为仅在正常处理下表达的RHF-QTL,仅检测到1个(QShl-3B.4);第二类为仅在胁迫处理下表达的RHF-QTL,其中,仅在水分胁迫处理下检测到的RHF-QTL有8个(QGi-1A,QGf-7B.1,QGp-7B,QGi-7D.1,QGdrc-7D.1,QGf-7D.1,QGp-7D和QGi-7D.2),仅在盐胁迫处理下检测到的RHF-QTL有7个(QGstc-3A,QGf-3A.2,QGi-3A,QGi-4A,QGf-7A.1,QGi-7A.1和QSl-7B.1),没有检测到在水分和盐胁迫下均表达的QTL;第三类为在胁迫处理(水、盐胁迫一种或两种处理)和正常处理下均表达的RHF-QTL,仅检测到1个(QSdw-7A.1),它在正常和盐胁迫两种处理下均能检测到,说明其受环境影响较小。
17个RHF-QTL中贡献率大于10%的有11个,占总数的64.7%(表3),为主效RHF-QTL,分别为QGi-1A、QGstc-3A、QSdw-7A.1、QGf-7A.1、QGf-7B.1、QGp-7B、QGi-7D.1、QGdrc-7D.1、QGf-7D.1、QGp-7D和QGi-7D.2。其中,QGi-1A(15.70%)、QGi-7D.1(15.97%)和QGi-7D.2(15.66%)贡献率较大。

表1 TL-RIL群体及其亲本的种子萌发性状分析
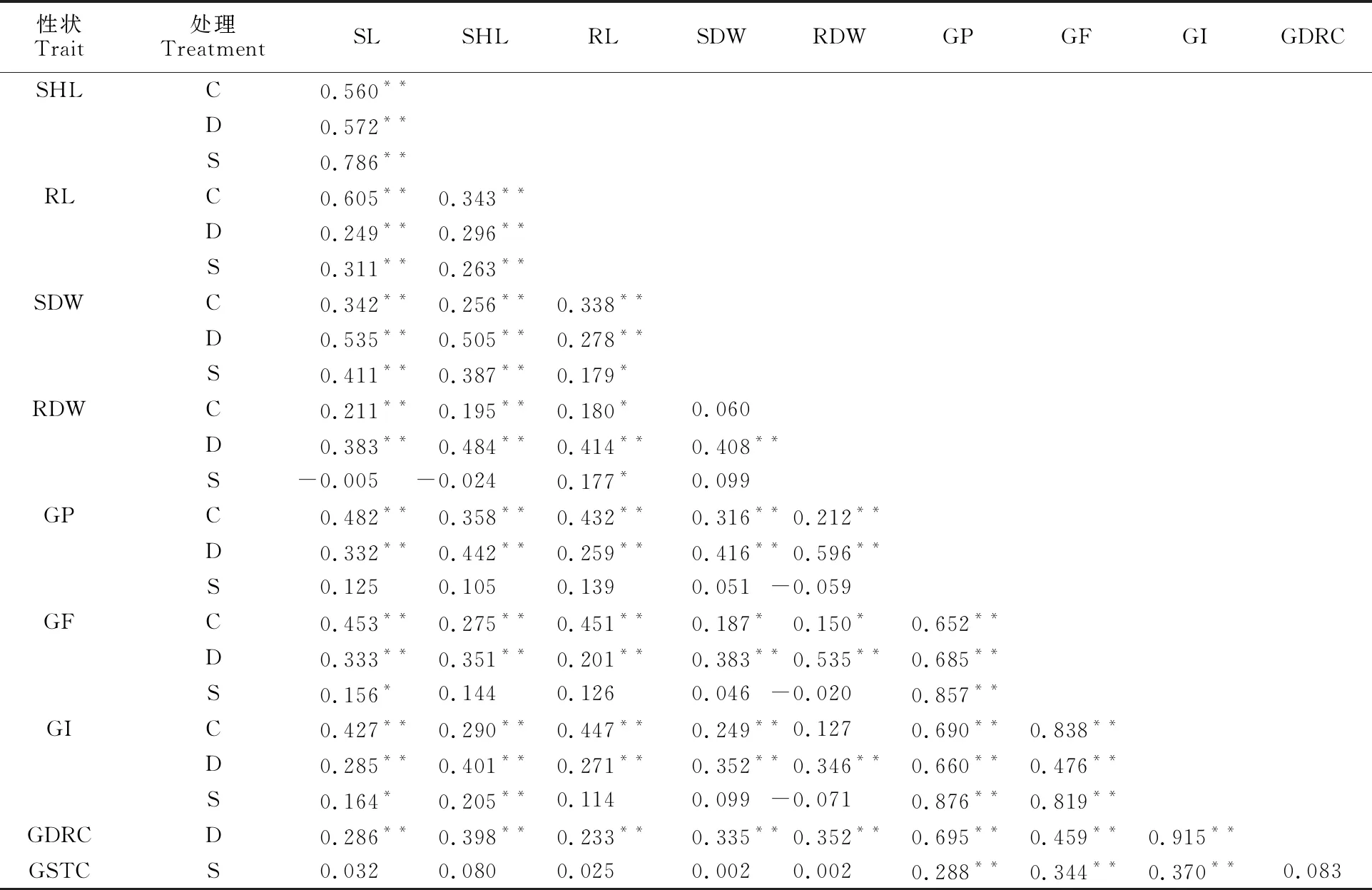
表2 萌发性状间的相关系数

表3 正常、干旱和盐胁迫3种处理下的RHF-QTLs

图1 RHF-QTLs和QCs在遗传图谱上的位置
2.3 种子萌发相关性状的QTL簇
17个RHF-QTL中有9个(52.94%)形成了4个QTL簇(QC1~QC4),分布在3A、7A和7D染色体上(表4,图1)。QC1位于3A染色体上,包括控制发芽势的QGf-3A.2和控制萌发指数的QGi-3A,平均贡献率分别为9.00%和8.55%。QC2位于7A染色体上,包括控制苗干重的QSdw-7A.1、控制发芽势的QGf-7A.1和控制萌发指数的QGi-7A.1,平均贡献率为9.48%~ 10.47%。QC3位于7D染色体上,包括控制萌发指数的QGi-7D.1和控制萌发抗旱系数的QGdrc-7D.1,平均贡献率为15.97%和14.84%。QC4位于7D染色体上,包括控制发芽率的QGp-7D和控制萌发指数的QGi-7D.2,平均贡献率分别为14.46%和15.66%。QC1和QC4簇各QTL的增加效应均来自父本临麦6号,QC2 和QC3簇各QTL的增加效应均来自母本泰农18。

表4 小麦萌发期抗旱耐盐相关性状QTL簇
3 讨 论
小麦生长始于萌发期,此时期易受水分胁迫和盐胁迫等外界环境的影响[22]。小麦萌发期节水抗旱性、耐盐性的鉴定指标很多,通常选用根长、苗长、胚芽鞘长和干鲜重等鉴定指标[23-25]。由于小麦抗旱耐盐机制的复杂性,本研究选用萌发期的3个形态指标、2个生物量指标和5个萌发指标共10个指标对小麦的抗旱和耐盐性进行评价,结果发现,在水分和盐胁迫下变异系数均大于10%的指标有6个,分别为苗干重、根干重、发芽率、萌发指数、萌发抗旱系数和萌发耐盐系数。这6个指标在水分和盐胁迫下群体间的表型变异丰富,是评价小麦抗旱耐盐性的重要指标。相关分析表明,在水分胁迫和盐胁迫下根长与苗长呈极显著正相关,这与Batool等[26]的研究结果一致;在盐胁迫下根干重与苗干重呈极显著正相关,这与任永哲等[7]的研究结果一致,说明小麦根系与幼苗存在着相互协调的关系;萌发抗旱系数和萌发耐盐系数相关性不显著,而且本研究也没有检测到在水分和盐胁迫下同时表达的RHF-QTL,说明抗旱和耐盐可能两个是相对独立遗传的性状,这与杨 帆等[27]认为植物对盐和水分胁迫拥有不同的响应机制的研究结果一致。
由于分析群体和遗传图谱标记类型的不同,本研究中的大多数RHF-QTL定位在新的标记区间。本研究中位于7A染色体上控制苗干重的QSdw-7A.1和控制发芽势的QGf-7A.1均在3个环境条件下检测到,受环境影响较小。前人在7A染色体上也曾检测到控制苗干重和发芽势的QTL,如Hao等[28]在水分胁迫下检测到控制发芽势的QTL,Zhang等[24]在水分胁迫下检测到控制苗干重的QTL。本研究中位于7D染色体上控制发芽率的QGp-7D在3个水分胁迫环境条件(D1,D2,DA)下均能稳定表达,Landjeva等[29]在7D染色体上也检测到控制发芽率的QTL。
多个QTL定位在染色体相同置信区间而形成QTL簇。本研究发现的QTL簇QC2位于7A染色体上,包括3个RHF-QTL(QSdw-7A.1、QGf-7A.1、QGi-7A.1),且这3个RHF-QTL大部分是在盐胁迫处理条件下检测到的,主要与小麦的耐盐性相关。前人在小麦QTL研究中也发现了许多的QC[9,30]。Zhang等[14]在小麦氮素利用效率相关性状的QTL研究中,在7A染色体上定位到一个控制根冠比的QTL,与本文的QC2有相同的分子标记wPt-2780和wPt-9207;Guo等[9]在小麦氮、磷、钾利用效率相关性状的QTL研究中,在7A染色体上发现了控制地上部干重和总干重等14个性状的QC,与本文的QC2有1个相同的分子标记wPt-7034,说明QC2区段可能存在一类基因,通过提高小麦萌发期的氮、磷、钾利用效率,从而提高耐盐能力。本研究发现的QC3位于7D染色体上,包括2个RHF-QTL (QGi-7D.1、QGdrc-7D.1),且这2个RHF-QTL是在干旱环境条件下检测到的,主要与小麦的节水抗旱性相关。Zhang等[14]在小麦氮素利用效率相关性状的QTL研究中,在7D染色体上定位到控制籽粒氮累积量和地上部氮累积量的QTL,与本文中的QC3有1个共同的标记D-1230051,说明QC3可能存在一类基因,通过提高小麦萌发期的氮利用效率,从而提高抗旱能力。上述分析表明,QC2和QC3不但分别与小麦的耐盐性和节水抗旱性相关,且与小麦的营养元素利用效率相关,可作为小麦萌发期节水抗旱和耐盐分子标记辅助选择的重要位点加以利用。
