海藻糖的生产及分析方法的国内研究进展
2020-03-04邓丹丹凌婉阳
邓丹丹,李 美,凌婉阳
0 引言
1832年Wiggers从黑麦的麦角菌中提取到海藻糖,这是人们第一次发现了海藻糖的存在,随后相继在许多动植物和微生物中也发现了海藻糖,如人们日常生活中食用的蘑菇类、海藻类、豆类、虾、面包、啤酒及酵母发酵食品中都有含量较高的海藻糖。由于海藻糖的结构明显不同于其他低聚糖类,赋予了它独特的理化性质与生物学特性,学术界对海藻糖的作用机理进行了广泛的研究,继而对海藻糖的生产方法也进行了不断的探索和开发。随着生产技术的研究不断深入,使得生产成本也不断降低,越来越多的人们开始认识和利用海藻糖的各种性质,将其应用在各种领域,应用价值得到了不断的提升[1]。本文对海藻糖的化学结构以及生物学功能进行了简介,对国内海藻糖的生产方法以及定性定量分析方法的研究进展进行了概述,通过对海藻糖的论述希望能进一步推动我国海藻糖的应用技术开发。
1 海藻糖的结构和功能
1.1 化学结构
海藻糖是一种安全、可靠的天然糖类,Bredereek在1930年采用化学方法对海藻糖的结构进行了论证,它是由2个吡喃型葡萄糖单体组成的非还原性糖,以 α, α-1,1-糖苷键连结而成,分子式为 C12H22O11·2H2O,分子结构的 Haworth式如图 1所示。
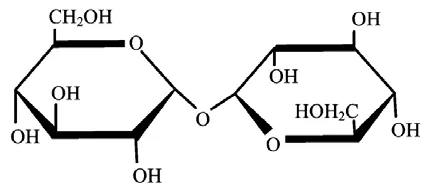
图1 海藻糖分子的Haworth式
通过核磁共振技术对海藻糖分子进行化学结构分析,研究发现,海藻糖分子存在一种简单的双折轴向对称结构,在水溶液中,2个椅式构象的葡萄糖分子通过糖苷键的氧原子形成对称的空间结构(图2),在固体状态对称结构发生改变。
由图1和图2可知,海藻糖分子结构呈现对称性,也没有半缩醛基的存在,海藻糖既没有还原性也没有变旋光性现象。海藻糖的 α, α-1,1-糖苷键具有远低于其他糖苷键的能量,如另一种非还原性双糖蔗糖的糖苷键具有27 kcal/mol的能量,而海藻糖的α, α-1,1-糖苷键仅具有1 kcal/mol能量,因此海藻糖不易被水解。研究发现,海藻糖在pH 3.5、温度100℃的环境下加热时间24 h,其保存率仍可达99%以上,表明海藻糖分子的稳定性极强,是天然二糖中最稳定的分子,这种特殊的分子结构赋予了海藻糖奇异的生物学功能[2]。
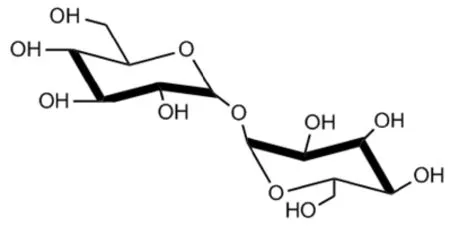
图2 海藻糖结构式
1.2 生物学功能
海藻糖的存在形式多种多样,既可以以游离糖的形式存在生物体内,也可以作为海藻糖脂的组成部分存在生物体内,不同的存在形式相应表现出海藻糖不同的生物学功能。其生物学功能主要有3个方面:①在生物体内可以作为海藻糖脂的基本组分,海藻糖脂有几种不同的结构,它广泛存在于棒状杆菌属、分枝杆菌属、诺卡菌属等菌中,是构成上述各细菌细胞壁的主要成分之一;②用于提供能量,海藻糖在生物体内的含量随着生物的生长状态、营养状况和环境条件的变化而变化,外界压力会引起海藻糖的合成与积累,如干燥会导致海藻糖的快速积累,吸收水分后在生物体内又会迅速发生代谢,通过海藻糖酶将海藻糖催化分解成 2个葡萄糖分子,作为能量来源和新陈代谢中间产物,提供的热值和其他化合物相当,扮演着贮存碳水化合物的角色;③是许多生物的应激代谢物,具有保护生物细胞和生物活性物质在脱水、干旱、高温、冷冻、高渗透压及有毒化合物等不良环境条件下活性免遭破坏的功能,作为一种天然的非特异性生物保护物质而存在[2]。
2 海藻糖的生产方法
2.1 微生物提取法
微生物提取法的提取源可以是乳酸菌、酵母、霉菌及其它一些含海藻糖的菌体,目前生产工艺所用的原料主要是酵母菌,其工艺流程为:先改变菌体的生长环境如干燥、改变渗透压等,使菌体在逆性环境下合成更多的海藻糖,继而通过有机溶剂如乙醇、三氯乙酸等采用适当的方法提取、精制菌体内的海藻糖,以获得较高纯度的海藻糖晶体[3]。
赵玉巧等为了有效地提取酵母中的海藻糖,分别研究了3种提取溶剂即乙醇水溶液、三氯乙酸和超声波辅助的水溶液的提取海藻糖的效果;以湿酵母为原料用三氯乙酸作为提取溶剂提取3次,海藻糖的得率总共达 96.2%;以湿酵母为原料用超声波辅助的水溶液作为提取溶剂,第1次提取海藻糖的得率为95.1%,提取3次的得率总共达99.1%;以湿酵母为原料用9 mL 55%的乙醇溶液作为提取溶剂,当提取时间90 min时2次提取率合计81.9%;而以1 g干酵母为原料,采用12 mL水溶液提取海藻糖,在提取时间75 min、温度90℃的条件下,2次提取率合计86.6%[4]。宋晓丽等以三氯乙酸为浸提溶剂从安琪葡萄酒高活性干酵母中提取海藻糖,通过微波法灭酶对海藻糖得率的影响得出:微波灭酶最适功率119 W、最适时间45 s;通过Box-Behnken响应面设计对提取工艺进行优化,即在三氯乙酸用量41.95 mL、三氯乙酸浓度 0.43 mol/L、时间 88.75 min、温度34.19℃的提取条件下,1 g干酵母中海藻糖得率为251.86 mg,回归模型的预测值与实测值的相对误差<1%[5]。王宜磊等采用微波破壁法、高温处理破壁、煮沸提取法 3种提取方法从啤酒废酵母中提取海藻糖,以海藻糖得率以及工艺的效益性为指标研究了海藻糖的最佳提取条件,研究发现煮沸提取法的效果较好,即在煮沸80 min的条件下,以1 g干酵母为原料可得海藻糖含量8.147 mg[6]。何钢等采用超声波辅助的乙醇-水溶液提取海藻糖,研究了啤酒酵母、葡萄酒酵母、高活性酵母、酿酒高活性酵母4株菌体的海藻糖含量大小;在料液质量体积比1∶15、温度80℃、时间70 min、乙醇浓度50%的条件下,酵母菌细胞海藻糖得率达(68.10±0.7)mg/g;研究结果显示,4株菌体中酿酒高活性酵母的海藻糖含量最高,其次是高活性酵母,第三是葡萄酒酵母,而啤酒酵母的海藻糖相对最少[7]。洪厚胜等通过微波-浸提法提取活性干酵母胞内的海藻糖,通过单因素及正交试验得出:在1.5 g活性干酵母的基础上,微波最佳功率231 W、微波最佳时间40 s、三氯乙酸最佳浓度0.7 mol/L、三氯乙酸最佳用量40 mL、浸提最佳时间150 min、浸提最佳温度55℃,得到的海藻糖含量为280.15 mg/g;另外,研究发现从现有面包酵母菌种中筛选出的高产海藻糖菌株在添加营养源的条件下进行流加发酵后,最大酵母湿质量浓度可从198.34 g/L提高到264.82 g/L,提高了 33.52%,而 0.7%~1.0%的乙醇溶液可有效提高酵母湿质量浓度,发酵力在650 mL/h以上[8]。
2.2 微生物发酵法
利用微生物发酵法培养的微生物对象有节杆菌属、棒杆菌属、短杆菌属、诺卡氏菌属、丝核菌属、微球菌属等,在符合菌株生长条件的高浓度培养基质上通过诱变、细胞融合或基因重组等技术手段选育出高产海藻糖的菌株,经高渗发酵后从发酵液中提取、精制海藻糖[9]。
宿玲恰等对前期获得的一种嗜热栖热菌来源的海藻糖合酶通过定点突变技术进行分子改造,得到突变体P251L,并在E. coli中重组表达,研究发现重组菌的发酵酶活可达6.9 U/mL;在初始pH 7.5、温度50℃、0.3 g/mL麦芽糖的条件下,利用重组菌体发酵制备海藻糖,当每克麦芽糖加酶量为 20 U时,海藻糖的转化率可达到 62.0%,比天然海藻糖合酶提升了 13.0%[10]。段莹莹等从土壤中分离筛选得到一株能合成海藻糖的菌株,在海藻糖合酶的催化下以麦芽糖为底物对其进行摇瓶发酵,通过对发酵条件的研究得到:最适菌株发酵的培养基质成分为2%麦芽糖、0.5%酵母粉和1%蛋白胨,调节初始pH 7.0、发酵温度35℃,菌株接种量4%,经过48 h的发酵时间后,海藻糖含量最高为 15.1%,即转化率为 49.8%[11]。张晓元等以产朊假丝酵母为发酵微生物,预处理去除麦芽糖浆中葡萄糖,通过单因素及正交试验结果可知,预处理较佳工艺条件为:培养基质的菌液接种量4%,底物浓度为40%的麦芽糖浆,在温度32℃、pH 5.5、发酵时间6 h的条件下,葡萄糖的去除率可达 99.4%,海藻糖得率由 29.8%提高至 58.4%,提高了 96.0%[12]。段莹莹等在重组大肠杆菌发酵生产海藻糖合成酶过程中,采用DO-stat流加培养控制,研究了溶氧浓度分别为20%、30%、35%和40%时的发酵效果,当发酵罐中溶氧浓度为30%时,发酵时间40 h,菌体干质量可达53.9 g/L,海藻糖转化率达到80.9%[13]。晏星辰等采用自诱导表达系统对含有海藻糖合成酶的大肠杆菌BL21(DE3)进行三阶段温度控制发酵,在37℃培养2.5 h,25℃培养10.5 h,30℃培养至发酵终点,研究发现,与自诱导恒温控制发酵获得的海藻糖合成酶酶活相比,经过三阶段控温发酵酶活最高可达1.42×104U/mL,提高了57.4%;在5 L反应器中利用大肠杆菌连续发酵40 h,细胞去除水分后的净重浓度达到15.32 g/L,与摇瓶发酵相比,在5 L反应器中获得的海藻糖合成酶酶活最高可达 1.81×104U/mL,提高了28.6%;以5%甲苯处理45 min,40 mmol/L PBS缓冲液配制的pH 7.5的350 g/L麦芽糖溶液为底物,反应温度30℃,全细胞催化反应的海藻糖得率达到74%以上,10批次后,麦芽糖仍保留64.1%的转化率[14]。
2.3 基因工程法
基因工程法生产海藻糖主要包括构建转基因植物法和构建基因工程菌2种方法,其中构建转基因植物法利用能够合成海藻糖的基因引入到果蔬植物中,促使转基因植物在体内合成海藻糖,获得其所需的生物学功能;构建基因工程菌则是利用酶工程技术将海藻糖合酶基因转入新的微生物宿主中高效表达获得高产海藻糖菌体,或利用工程微生物能够高效表达海藻糖合酶的特点,在体外将葡萄糖、麦芽糖、淀粉等底物转化为海藻糖[15]。
高超等以哈氏噬纤维菌Cytophaga hutchinsonii为研究对象,利用PCR技术以及克隆技术获得菌体的海藻糖双功能合成酶基因(tpsp),以大肠杆菌 E.coli p Tac-HisA为表达载体,将葡萄糖催化合成海藻糖;结果表明C. hutchinsonii海藻糖合成酶基因(tpsp)在E. coli胞内催化反应,并将其转运到胞外,海藻糖的产量可达1.2 g/L,相对转化率为21%;在发酵罐中利用重组大肠杆菌菌株催化葡萄糖转化,其合成的海藻糖产量可达 13.3 g/L,相对转化率为48.6%[16]。宿玲恰等以 Thermus thermophilus ATCC33923为研究对象,通过PCR扩增技术获得了该菌体的海藻糖合酶基因 treS,构建了基因工程菌E. coli BL21 (DE3)/pET-24a (+)-TreS;利用该基因工程菌在摇瓶中连续发酵28 h,获得的胞内海藻糖合酶酶活最高可达6.4 U/mL;而以海藻糖得率为指标的最佳工艺参数为:麦芽糖的浓度为10%,每克麦芽糖添加海藻糖合酶酶量15 U,调节初始pH 7.5、温度40℃,在转速150 r/min下连续反应24 h,海藻糖的转化率达到最高,为 49.0%;当麦芽糖浓度提高至20%~40%时,转化率为45.4%~46.2%[17]。王珊瑛等通过来源于古细菌嗜酸硫化叶菌的麦芽寡糖基海藻糖合成酶(MTSase)和麦芽寡糖基海藻糖水解酶(MTHase)的联合作用以淀粉为底物合成海藻糖;通过构建 6种基因工程菌(枯草芽孢杆菌-大肠杆菌)为表达载体,优化MTSase和MTHase编码基因,在木糖异构酶基因的启动子及其阻遏蛋白介导下,使枯草芽孢杆菌中的MTSase和MTHase能够高效表达;培养基中添加5 g/L甘油、24 g/L蛋白胨,8 h后加入6 g/L木糖,在发酵温度37℃、时间16 h的条件下,诱导重组基因工程菌中的 MTSase和MTHase产生联合作用催化淀粉转化,海藻糖转化率达到 33.57%[18]。徐燕杉等以谷氨酸棒杆菌ATCC14067为研究对象,利用克隆技术获得海藻糖合酶基因(treS),将其插入表达质粒 pET-22b,以大肠杆菌E. coli BL21(DE3)为宿主诱导其表达,利用镍柱亲和层析进一步纯化重组海藻糖合酶;以麦芽糖为底物,在30℃,pH 7.5条件下,Km值约为29.2 mmol/L,海藻糖的得率可达60%~70%[19]。吴傲等以天蓝色链霉菌为对象,通过克隆技术得到海藻糖合酶基因,将其转入大肠杆菌菌体进行表达,获得高产海藻糖的大肠杆菌 Escherichia coli BL21(DE3);该酶最适温度35℃;最适pH 7.0,海藻糖转化率最高为65%;通过同源建模和序列比对分析,对该基因进行定点突变,利用突变株BL21/pET28a-K246A在 5 L发酵罐催化合成海藻糖,在麦芽糖浓度300 g/L、温度35℃和pH 7.0的条件下,海藻糖转化率为71.3%,产量为213.93 g/L;将麦芽糖浓度提高至700 g/L,其他试验条件保持不变,海藻糖的转化率可达 66%,其产量为 465.98 g/L[20]。李新等以施氏假单胞菌 A1501为对象,经过克隆技术得到 otsA/otsB基因,将其导入Escherichia coli BL21(DE3)宿主中,催化葡萄糖转化合成海藻糖,通过表达E. coli本身的galU基因增加海藻糖合成前体物质尿苷二磷酸-葡萄糖的含量,使海藻糖产量提高了3倍;过表达来自天然纤维素分解细菌 Saccharophagus degradans的纤维二糖磷酸化酶基因cepA,以20 g/L纤维二糖为底物,添加0.05 mmol/L的井冈霉素抑制海藻糖降解,反应48 h后海藻糖含量可达 1.3 g/L[21]。杜立合成了源自Arabidopsis thaliana、Archaeoglobus fulgidus和Corynebacterium glutamicum的3种4-α-糖基转移酶(4αGTase)基因,并以大肠杆菌为E. coli BL21(DE3)为表达宿主;以Bacillus circulans的环糊精葡萄糖基转移酶(BcCGT)为催化剂,将浓度 150 g/L、DE值16的麦芽糊精催化合成海藻糖,海藻糖转化率为74.1%,与对照相比提高了24.0%;设计和构建了以提高 BcCGT对麦芽糖受体亲和力为目的的高通量筛选体系,获得了一株突变体 M234I,以麦芽糖为受体的Km降低至野生型的54.4%,海藻糖转化率提高至 77.2%;将突变体 M234I基因插入表达质粒pHY300PLK-bccgtM234I,将其转入枯草芽孢杆菌中,获得枯草芽孢杆菌重组菌 B. subtilis WS11/pHY300PLK-bccgtM234I,以葡萄糖为碳源、7∶1的隆科特玉米浆与大豆蛋白胨为氮源,碳氮比为3∶1时,在3 L发酵罐中的最高酶活达到1423.2 U/mL[22]。
2.4 酶转化法
酶转化法是采用各类碳水化合物如葡萄糖、麦芽糖、淀粉等为底物,在海藻糖合成酶类的催化下,将其转化合成海藻糖。
张曰辉等以麦芽糖为底物利用海藻糖转化酶粗酶液转化海藻糖,通过单因素和正交试验结果得知:温度53℃,转化pH 7.8,时间20 h,摇床转速150 r/min时,海藻糖的转化率为59.8%[23]。崔怀言等选取生物表面活性剂硫酸粘杆菌素,采用可视化优化方法对其进行通透性处理,重组大肠杆菌 BL21生产海藻糖合成酶;提高海藻糖合酶酶活的最佳处理工艺为:将1.40 g/L的硫酸粘杆菌素在35℃下渗透处理72 min,其酶活是传统超声破碎法的2.09倍;利用该海藻糖合酶催化30%麦芽糖进行转化反应,海藻糖得率为70%,以反应时间12 h为一批次试验,重复使用该催化剂16批后,海藻糖得率仍然维持在65%以上[24]。刘念等通过对比无水乙醇、氯仿、EDTA和硫酸粘杆菌素4种透性试剂对表达海藻糖合成酶的大肠杆菌工程菌的处理效果,发现使用硫酸粘杆菌素透性化处理后海藻糖合成酶的催化转化率高达64.6%,是传统超声破碎的 2.63倍;为得到较高的海藻糖合成酶活性,以1.5 g/L的硫酸粘杆菌素为渗透剂,在 30℃下渗透处理 60 min,其酶活为 5209 U/mL;以 25%的麦芽糖为底物、pH 7.5、温度 30℃进行全细胞催化反应,海藻糖的转化率为65.6%,反复催化20批次之后,转化率仍维持在62.5%[25]。娄倩芳等以聚丙烯腈膜(PAN)为载体,在pH 7.6、温度30℃、加酶量0.1 mg/cm2条件下震荡吸附3 h制备固定化海藻糖合成酶粗酶液,其热稳定性比游离酶提高10℃,酸碱稳定性由pH 6.6~7.4扩展至pH 5.4~8.0;利用固定化酶催化反应生成海藻糖的最佳工艺参数为:初始麦芽糖底物浓度200 g/L、pH 7.4、温度40℃,反应达到平衡时较游离酶降低6个百分点,海藻糖含量为 50.9%,副产物葡萄糖含量为9.1%;将固定化酶重复使用72 h后,与初始酶活为对照,其酶活保留了 64.4%[26]。封金云等以大米淀粉为底物多酶复配制备海藻糖,研究了多酶复配生产海藻糖的最佳工艺参数:以质量体积分数15%的大米淀粉为底物,在温度45℃、pH 6.0、DE值16、α/β-CGTase加量为1.4 U/mL的条件下,催化 28 h后糖化处理12 h,海藻糖转化率达到73%,与普通双酶法相比,转化率提高了23个百分点;在底物浓度为25%时,海藻糖产量最高达到182.5 g/L[27]。
3 海藻糖的分析方法
海藻糖要进行生产及应用研究,则分析方法是关键,目前用于海藻糖定量分析的方法有蒽酮比色法、纸层析法、薄层层析法、DNS比色法、高效液相色谱法等,不同的分析方法各有其不同的特点与性能,可以根据分析样品中含有的各种糖成分的复杂程度和含量多寡,选择合适的定量分析方法。由于海藻糖主要是从酵母等含量丰富的微生物中提取,以及利用酶法由淀粉或淀粉水解物转化而制备,生产过程的中间产物和制成品中除了海藻糖以外,还含有不同含量的其他糖类,如麦芽糖、葡萄糖、寡糖等,海藻糖的定量分析往往是分离和分析过程的结合。
3.1 蒽酮比色法
蒽酮比色法是一个快速而简便的定糖方法,糖类(包括多糖)遇浓硫酸脱水生成糠醛及其衍生物,蒽酮与糠醛及其衍生物经脱水缩合,反应后溶液呈现蓝绿色,颜色的深浅即可作为海藻糖定量的依据。
谭海刚等采用蒽酮比色法测定酵母中海藻糖的含量,在0.2%蒽酮-硫酸溶液(料液比1∶4)的条件下加热2 min,显色后于波长590 nm处测定,样品需在30 min内测完;然后在冰水浴中加入0.5 mol/L三氯乙酸溶液15 mL,研究发现,以活性干酵母为提取对象,每30 min提取1次,共提取海藻糖8次,可获得149.42 mg海藻糖,即155.05 mg/g酵母(干基)[28]。李艳玲等探讨了蒽酮浓硫酸法、硫酸水合加热法、蒽酮稀硫酸法3种蒽酮比色测定海藻糖含量;当硫酸浓度98%,蒽酮浓硫酸试剂4.0 mL,海藻糖标准溶液2.0 mL,煮沸加热5 min或室温3 min时,得到蒽酮浓硫酸法和硫酸水合加热法于波长625 nm处的吸光度值最大;当硫酸浓度为85%,蒽酮硫酸试剂3.0 mL,海藻糖标准溶液1.0 mL,煮沸加热10 min时,得到蒽酮稀硫酸法于波长625 nm处的吸光度值最大;采用蒽酮浓硫酸法、硫酸水合加热法、蒽酮稀硫酸法在 60 min内吸光值的 SD分别为0.0041、0.0065、0.0067,3种方法的 RSD 分别为0.49%、0.84%、0.99%,在 10~100 μg/mL范围内呈线性关系,相关系数分别为 0.9996、0.9989、0.9988[29]。
3.2 纸层析法
纸层析法是用纸作为载体的一种色谱法,是一种古老的分析手段,目前仍广泛应用在生物化学特别是糖类的分析中,使用合适的展开剂很容易将海藻糖和其它糖类分开。纸层析法依据极性相似相溶原理,是以滤纸纤维的结合水为固定相,而以有机溶剂作为流动相,由于样品中各物质分配系数不同,因而扩散速度不同,从而达到分离的目的。
王兰等用纸层析分离洗脱法测定胞内及发酵液内海藻糖,展开剂为正丁醇∶丙酮∶水∶醋酸=10∶3∶6∶2,显色剂由 A液(AgNO3的水-丙酮饱和液)和B液(NaOH的乙醇水溶液)组成,采用0.1 mol/L HCl作为洗脱剂洗脱16 h;当点样量为40~120 μg时,定量测定的吸光度与海藻糖含量呈线性关系,得到的线性回归方程为Y=0.0021X+0.002,其相关系数R2=0.9985[30]。李仁茂等采用纸层析法和蒽酮比色法对含水量为85%的湿平菇和干燥平菇中的海藻糖进行定性定量分析;采用的展层剂为正丁醇∶丙酮∶水∶醋酸=10∶6∶6∶2,其中 AgNO3的水-丙酮饱和液(水∶丙酮=1∶20)为 A 液显色剂,NaOH的乙醇水溶液(乙醇:水=1∶1)为B液显色剂,试验测得的海藻糖Rf值约为0.29;研究结果发现,湿平菇和干平菇中的海藻糖含量分别为 2.06%、13.7%[31]。
3.3 薄层层析法
薄层层析法是一种用来分离混合物的技术,其原理是以涂布于支持板上的支持物作为固定相,以合适的溶剂为流动相,对混合样品进行分离、鉴定和定量的一种层析分离技术。利用薄层层析法可对菌种筛选、培养及提取过程中的大量海藻糖进行快速的定性定量分析。
谭海刚利用薄层层析法定性分析海藻糖合酶酶反应终产物,应用于筛选产海藻糖合酶菌株;反应条件为:3 g硅胶G+4 mL 0.05% CMC-Na+4 mL 0.1 mol/L NaH2PO4制备薄板(8 cm×18 cm),正丁醇∶吡啶∶水=6∶4∶1或正丁醇∶吡啶∶2%脲水=3∶2∶1为展开剂,30%硫酸甲醇溶液为显色剂,其检出灵敏度可达0.2 μg;薄层层析Rf值的重现性较好,对海藻糖与麦芽糖、海藻糖与葡萄糖的分离效果很好;以山东邹平的采集土样为对象,利用薄层层析法可筛选出5株产海藻糖合酶菌株[32]。刘德海等采用硅胶板GF254薄层层析法定性分析葡萄糖、麦芽糖、海藻糖,确定了最佳展开剂为乙醇∶乙醇乙酯∶水=10∶3∶1,最佳显色剂为浓硫酸∶蒸馏水=10∶90;试验结果显示,薄层层析法能较好地将葡萄糖、麦芽糖、海藻糖分离开,显色后糖的斑点清晰,灵敏度高;用蒽酮-硫酸法对分离的海藻糖进行定量分析,根据海藻糖产量筛选出高产海藻糖的菌株[33]。
3.4 DNS比色法
在酶法转化淀粉生产海藻糖时,经α-淀粉酶和糖化酶处理的海藻糖中间样品,其主要成分仅为海藻糖和葡萄糖,因此可运用还原糖测定方法-DNS即3,5-二硝基水杨酸法在碱性条件下分别测出其中还原糖和总糖的量,再计算出非还原糖即海藻糖的含量。该方法操作简单、成本低廉,可用于酶法海藻糖生产过程中中间产物的检测。
王兰等确定了以酶-DNS比色法定量测定胞内及发酵液内海藻糖,其中胞内海藻糖需在温度95℃下处理20 min,发酵液海藻糖测定过程中应进行适当的稀释;在37℃下反应4 h,利用酶-DNS比色法测定海藻糖浓度,实际所加酶量为理论所需酶活的9倍以上[34]。王蕾等建立了DNS法定量测定海藻糖,其标准曲线回归方程为y=1.722x-0.009,通过对浓度在0~22.8 mg/mL范围内的各海藻糖对照品溶液的测定,得出其相对偏差≤3.9%,平均相对偏差为1.4%[35]。王青云等建立了酶解法测定含多种糖的混合体系中海藻糖含量的测定方法,即利用海藻糖水解酶水解海藻糖为葡萄糖,再采用DNS法测定酶解前后样品中还原糖含量并计算其差值,折算出样品中海藻糖含量;结果表明,样品回收率为91.12%~105.92%,相对标准偏差为 2.22%~3.43%,检出限为 70 μg/mL[36]。
3.5 高效液相色谱法
在海藻糖的生产过程中,发酵液、酶反应液中除了主要成分海藻糖外,还会有少量的麦芽糖、葡萄糖、寡糖、多糖等,因此,只有将这几种糖类完全分离,才能得到准确的测定结果。高效液相色谱法(HPLC)在定量分析海藻糖的方法中,准确度和重现性都非常好。HPLC法是利用同一时刻进入色谱柱的各组分,由于在流动相和固定相之间溶解、吸附、渗透或离子交换等作用的不同,随流动相在色谱柱两相之间反复多次的分配,由于各组分在色谱柱中的移动速度不同,经过一定长度的色谱柱后,彼此分离开来,按顺序流出色谱柱,进入信号检测器,在记录仪上或数据处理装置上显示出各组分的谱峰数值,根据保留时间用归一化法或外标法定量。
周帅等为了测定17种食用菌中海藻糖、甘露醇和阿糖醇含量,采用了高效阴离子色谱-脉冲安培检测法对其进行定量分析,研究显示:阿糖醇、海藻糖和甘露醇的检出限分别为0.41、0.04、2.11 μg/mL,定量限分别为1.14、0.10、5.79 μg/mL,线性范围分别为 239.62~1.25、59.41~0.15、148.29~5.00 μg/mL,线性系数分别为 0.9990、0.9994、0.9989[37]。刘艳芳等以蛹虫草子实体为材料,采用高效液相色谱法分析食用菌中海藻糖的含量,1 g子实体粉中加入 100 mL 90%乙醇热回流提取 1 h,然后采用SUGAR SP0810柱(300 mm×8 mm),超纯水洗脱,流速0.5 mL/min,柱温70℃,示差折光检测器检测,进样量10 µL等色谱条件进行测定,研究结果显示该方法准确度高,稳定性、精密度、重现性好[38]。许丽等建立了一种高效阴离子交换-脉冲安培检测(HPAE-PAD)测定化妆品中海藻糖的方法,采用METROSEP CARB 1分离柱(150 mm×4.0 mm)进行分离,以200.0 mmol/L的NaOH溶液为淋洗液,1.0 mL/min的流速,7 min内测定样品;海藻糖在1.0~40.0 mg/L内线性关系良好,相关系数为0.99995,检出限为 0.02 mg/L,峰面积的相对标准偏差为0.17%,保留时间的相对标准偏差为0.28%,平均回收率为95.2%~99.2%[39]。何秀全等利用高效液相色谱-蒸发光散射检测法(HPLC-ELSD)分析木薯叶片中海藻糖含量,样品由水抽提,采用 Xbridge-NH2色谱柱,流动相乙腈∶水体积比为70∶30,水中含0.1% NH4OH;该方法在1~20 μg范围内线性关系良好(R2=0.9952),精密度为 3.1%,平均回收率为100.7%,稳定性试验的RSD为3.1%[40]。刘海燕等用高效阴离子交换色谱-脉冲安培检测食用菌中7种单糖和海藻糖,其中单糖提取的最佳工艺为:食用菌鲜样需进行高速均质处理2 min,食用菌干样需在温度 60℃下进行超声处理 60 min;采用 CarboPac MA1色谱柱,流动相为去离子水∶600 mM NaOH溶液=20∶80等离子色谱检测条件测定 7种单糖和海藻糖,研究发现,最低检出限为5.5~63.6 μg/L,食用菌鲜样和干样的定量限分别为 0.37~4.24 mg/kg、3.68~42.39 mg/kg,方法加标回收率为76.1%~127.1%,相对标准偏差为1.44%~8.43%[41]。赵伟等建立了用 Xbridge-NH2色谱柱检测葡萄糖、麦芽糖和海藻糖混合溶液中海藻糖的高效液相色谱方法,葡萄糖、麦芽糖、海藻糖的质量浓度在0.1~4.0 g/100 mL时与峰面积呈良好线性关系,相关系数为0.9998~0.9999,相对标准偏差为1.60%,回收率为98.2%~99.4%[42]。唐远谋等利用高效液相色谱法测定卷柏全草中海藻糖的含量,采用 Sugar-D色谱柱(4.6 mm×250 mm×5 μm)示差检测器,流动相为乙腈∶水=78∶22,流速为 1 mL/min;研究发现海藻糖在 0.3125~5 mL/min范围内线性关系良好(R2=0.9999),精密度为1.59%,稳定性为3.05%,重复性为 3.99%,平均回收率为 104.9%,RSD为0.991%[43]。徐颖等建立了高效阴离子交换色谱-脉冲安培电化学检测法测定海藻糖、葡萄糖和麦芽糖的分析方法,该方法可在15 min内快速定量分析3种糖,其海藻糖、葡萄糖和麦芽糖峰面积与质量浓度的线性关系良好,相关系数分别为0.9998、0.9998、0.9999,检出限为0.010~0.100 mg/L,加标回收率为 89.4%~103.2%,检测到海藻糖浓度为 101.084 g/L,转化率达到了 50.5%[44]。张曰辉等建立了以Xbridge-NH2色谱柱检测奶糖中海藻糖、葡萄糖、蔗糖和麦芽糖的高效液相色谱方法(HPLC);葡萄糖、蔗糖、麦芽糖和海藻糖的精密度分别为1.6%、1.7%、1%、2.1%;在0~4 g/100 mL范围内线性关系良好,其相关系数在 0.9997~0.9999之间,回收率在98.4%~99.9%之间;通过高效液相色谱法检测结果可知,海藻糖、葡萄糖、蔗糖、麦芽糖的含量分别为2.64%、1.0%、23.0%、15.1%[45]。宋金松等以土壤中筛选的产海藻糖合酶菌株发酵制得的粗酶液反应制取的转化液为对象,加入糖化酶水解转化液中剩余的麦芽糖,经煮沸灭酶活后,采用以Sugar-PakTMⅠ为色谱柱的高效液相色谱法测定其海藻糖的含量,该方法所测的海藻糖含量与DNS比色法结果一致,均为1.5 g/100 mL[46]。
除了蒽酮比色法、纸层析法、薄层层析法、DNS比色法、高效液相色谱法定量分析海藻糖以外,研究发现还有其他检测方法也可对海藻糖的含量进行测定。如胡磊等为了测定植物组织中海藻糖等糖类物质的含量,采用气相色谱分离、质谱鉴定的分析方法对其进行乙酰化衍生化处理,其中溶剂和催化剂选用1-甲基咪唑,肟化和乙酰化试剂选用盐酸羟胺和乙酸酐;以核糖醇为内标,根据最佳衍生化条件下海藻糖所出峰高和样品浓度、进样量和分流比计算出海藻糖的最低检测量为8.17×10-11g,适于植物样品中微量海藻糖的分析测定[47]。陈晖等为了检测药用辅料的海藻糖含量,采取了离子色谱高效阴离子交换层析分离与高灵敏度、高选择性的脉冲安培检测器联用技术对其进行定量分析;以30 mmol/L的NaOH溶液进行等度淋洗,海藻糖与杂质的色谱分离度 R>1.5;检测限为 2 μg/L,定量限为 10 μg/L,精密度为0.42%,回收率为98.09%~100.0%,RSD为 0.58%[48]。苗佳等利用特异性海藻糖酶水解海藻糖生成葡萄糖,以固定化酶微电极为基础的葡萄糖生物传感分析仪对海藻糖水解产物进行快速定量检测;该方法对海藻糖的检测限为 0.019 mg/mL,定量限为0.1 mg/mL,在0.1~150.0 mg/mL范围内,样品海藻糖含量与所得葡萄糖含量具有良好线性关系,相关系数为 0.9998,回收率范围为 98.80%~101.33%[49]。
4 海藻糖的应用前景
随着海藻糖生产的不断发展,海藻糖的优良特性不断地被人们发现,海藻糖的优良品质和性能使其成为近年来的研究热点,在生物医药、化妆品、农业、食品等方面的应用日趋广泛,应用前景非常广阔。利用海藻糖对干燥脱水、高温、冷冻、高渗等逆性环境优良的抗逆保护作用,海藻糖可作为生物和医学领域的活性大分子的优良保护剂,作为疫苗、蛋白质药物、活菌制剂、血液制品、淋巴细胞、活体组织等生物活性物质的稳定剂。此外,海藻糖还可用于保存皮肤、血液、生殖细胞和活体器官等,其对骨质疏松症、亨廷顿舞蹈症等也有一定的治疗作用。海藻糖显示的细胞保护能力、保湿性、抗辐射特性以及稳定活性成分的作用,也使海藻糖和它的衍生物成为化妆品的重要原料之一。利用海藻糖对低温、高温、盐碱、干旱等逆境条件下的抗性,可把海藻糖合成相关的酶基因导入作物并使其在作物体内表达,以培育出能抗旱、抗寒、抗冻、耐盐的作物新品种。海藻糖对酸和热的稳定性以及非还原性,在食品的加工稳定性中也有广泛的用途,利用海藻糖与水分子极易结合即水合性高这一特点,能够抑制年糕、米饭、面制品等由于淀粉的老化产生的硬化等问题,显著地延长含淀粉食品的货架期[2]。
随着海藻糖应用领域的快速拓展,目前国际市场对海藻糖的需求量很大,国内过去所用的海藻糖基本都是从日本进口,用酶转化法以及基因工程法生产海藻糖产品的市场空间很大,因此开发海藻糖制备新工艺,替代进口产品,对提高我国海藻糖制备技术的自主创新能力,满足国内外市场需求,具有重大意义。由于国内现有的功能性糖生产设备和工艺可改造并用于海藻糖的生产,因此加快对海藻糖工业化生产的核心技术研究和应用开发,必将推动我国功能性糖行业产品的结构调整和质量提升,同时也给我国食品工业及相关行业新产品的开发带来新的机遇。
5 展望
目前在实验室和生产上制备海藻糖主要有4种方法:一是从生物细胞中提取;二是采用微生物发酵生产;三是以碳水化合物为底物采用海藻糖合成酶催化合成;四是利用工程微生物或构建具有抗逆性的转基因植物生产。随着生物技术的快速发展,对于海藻糖的研究也需更加深入,笔者建议可以从以下几个方面加强研究:①对于海藻糖相关生产菌株需进一步探索,可以应用分子生物学方法如基因重排技术改良工程菌培育出产量较高的生产菌株;②应用定点突变技术对酶分子进行定向改造来尝试增加海藻糖产物的得率,在基因组水平研究海藻糖合酶的结构特性,分析相关酶类代谢机制以及酶三维结构,并通过各种组学手段延长海藻糖合酶的使用周期,减少酶的失活机率;③通过宏基因组学提取环境中全部微生物的总基因组,克隆到合适的可培养微生物宿主中来筛选目的基因,拓展海藻糖合成相关基因的来源。
