基于溶解度法的纳米镉、铅、银硫化物的热力学性质研究
2020-03-04
(广西民族大学化学化工学院, 广西南宁530006)
硫化镉(CdS)、硫化铅(PbS)、硫化银(Ag2S)半导体纳米晶随着尺寸的减小和形貌的变化,其带隙宽度发生明显改变,体现出比普通粒状材料更优异的光电性质,因此在光催化、光电转换、光致发光、太阳能电池等领域具有极好的应用前景[1-5]。如Zhang等[6]合成了用于稳定析氢和高活性的光催化剂CdS纳米球@MoS2纳米薄层,在优化实验条件下,使用Na2S-Na2SO3作为牺牲剂(λ≥420 nm),其最大的产氢速率为17 203.7 μmol/(g·h),比普通硫化镉高出约47.3倍。Tang等[7]利用PbS量子尺寸效应,通过利用卤素离子作为PbS的表面修饰剂制备的耗尽异质结型电池(depleted heterojunction cel)的效率可以达到6%。 徐骏[8]通过微波法合成粒径为5.4 nm的超微油相Ag2S纳米颗粒, 在激发光源下能够发射出极强的近红外二区荧光(波长为1 200 nm), 对其进行表面修饰,接上癌细胞靶向肽(RGD)和抗癌药阿霉素(DOX)后,具有较好的靶向性和生物相容性,在纳米荧光探针和药物运输领域中表现出了良好的发展前景。尽管纳米镉、铅、银硫化物的合成和应用已经取得了很大发展,但是对其表面热力学性质的研究还未见报道。
当材料颗粒减小后,其表面原子所占比例和比表面积急剧增大,表面层原子朝向外面的键能没有得到补偿而产生悬挂键,使得表面质点比体内质点具有额外的势能,被称为表面能。表面能是表面原子、电子、形貌、几何等结构综合构效体现,纳米材料表面的特殊结构使其具有极高的表面活性,产生了奇异的表面物理化学效应,成为影响溶解、催化、吸附、反应热力学和动力学、电化学特性的主要原因。采用何种科学的原理和实验方法获取纳米材料的表面热力学性质并发展其理论,是当今纳米材料科学、表面科学、纳米热力学和表面物理化学领域亟待解决的科学问题。目前,固体表面能的估算方法包括劈裂功法[9]、 熔融外推法[10]、 颗粒沉淀法[11]、 薄膜浮选法[12]、 接触角法[13]、 量热法[14 -17]、 杨氏模量法[18-19]等。 其中基于杨氏方程的接触角法和理论计算法,在固体表面吉布斯自由能的测定方法中运用最为广泛, 但是这2种方法也都存在缺陷和不足。 譬如在使用接触角法进行表面能的测量时, 模型关系的差异以及杨氏方程固有的不足导致该法在现实界面的条件下是否成立尚存在很大学术分歧, 而其他方法对测定纳米镉、 铅、 银硫化物等难溶物的表面热力学性质测定, 也存在不足之处。 本文中基于溶解热力学原理,采用操作简单、灵敏度高的溶解度法测定硫化镉、 硫化铅和硫化银的电导率, 获取其溶解平衡常数和溶解热力学函数,并通过对纳米材料与普通粒状材料相关参数的对比, 进一步获取纳米级硫化镉、硫化铅和硫化银的偏摩尔表面热力学函数、 摩尔表面热力学函数及生成热力学函数, 旨在对纳米半导体材料的合成、 溶解、 催化等应用提供重要借鉴。
1 实验
1.1 试剂与仪器
实验用试剂包括:醋酸镉、硫化镉、聚乙烯吡咯烷酮K30,上海阿拉丁生化科技股份有限公司;硫脲、硫粉、硫化钠,国药集团化学试剂有限公司;乙二醇、无水乙醇,成都科龙化学试剂有限公司;醋酸铅,广州市新港化工有限责任公司;乙二胺,天津博迪化工有限责任公司;硝酸银,上海旭达精细化工厂有限责任公司;硫化铅,成都艾科试剂公司;硫化银,Alfa Aesar化学公司。以上试剂均为分析纯。
实验用仪器主要包括:电导率仪(DDS-308型),上海佑科仪器公司;场发射扫描电子显微镜(SUPRA 55 Sapphire型),德国卡尔蔡司公司;X射线粉末多晶衍射仪(X′Pert PRO型),荷兰帕纳科公司。
1.2 实验过程
1)纳米硫化镉制备。分别配制100 mL浓度为0.1 mol/L的醋酸镉的乙二醇溶液和100 mL浓度为0.1 mol/L的硫代乙酰胺水溶液, 在不断搅拌条件下, 将二者以物质的量比1 ∶1混合后持续搅拌30 min, 避光密封静置陈化24 h,完成后用无水乙醇和去离子水依次对样品进行多次洗涤,再将产物放入真空干燥箱,在室温下烘干后待用。
2)纳米硫化铅制备。 分别配制100 mL浓度为0.1 mol/L的醋酸铅水溶液和100 mL浓度为0.1 mol/L的硫化钠水溶液, 在磁力搅拌条件下, 将二者以物质的量比1 ∶1混合,超声分散1 h。反应完毕后分别用去离子水和无水乙醇多次洗涤样品,再放入恒温鼓风干燥箱中在60 ℃烘干备用。
3)纳米硫化银制备。①A液配制。称取0.5 g聚乙烯吡咯烷酮溶解于25 mL去离子水后,再称取0.85 g硝酸银加到该溶液中,磁力搅拌至溶液澄清。②B液配制。磁力搅拌下称量0.063 8 g硫粉溶解于10 mL乙二胺中, 然后量取90 mL去离子水逐滴加入该溶液中, 溶液颜色从绿黑色变成亮黄色。 磁力搅拌下将溶液A和15 mL溶液B混合, 继续磁力搅拌24 h。 采用离心分离得到沉淀物,用无水乙醇和去离子水洗涤沉淀物,将产物在60 ℃烘干备用。
4)样品表征。 使用X射线粉末多晶衍射仪(铜靶, Kα射线,波长为0.154 060 nm, 管电压为40 kV, 管电流为40 mA, 扫描范围为10°~90°, 步长为0.026°)分析样品晶体结构; 采用场发射扫描电子显微镜观测样品的形貌;利用电导率仪分别测定样品饱和水溶液在328.15、 318.15、 308.15、 298.15、 288.15 K时的电导率,平行测定3次,取平均值。
2 结果与讨论
2.1 样品的表征结果
粒状和纳米硫化镉、 硫化铅、 硫化银的场发射扫描电镜图像分别如图1、 2所示。 由图可看出, 各个样品的粒径比较均匀, 分散性较好。 纳米硫化镉、 硫化铅、 硫化银的粒径分别为17~30、 20~35、 35~90 nm。 图3为纳米硫化镉、 硫化铅、 硫化银的X射线衍射谱图。 结果显示, 所制备的纳米硫化镉与粉末衍射标准联合委员会(JCPDS)标准卡片编号10-0454相对应,属立方晶系;纳米硫化铅与JCPDS卡片编号05-0592相对应,属面心立方晶系;纳米硫化银与JCPDS卡片编号14-0072相对应,属单斜晶系。各产物衍射峰较为尖锐,表明结晶度较高,所制备的纳米晶较纯。

图1 粒状硫化镉、 硫化铅和硫化银的场发射扫描电子显微镜图像

图2 纳米硫化镉、 硫化铅和硫化银的场发射扫描电子显微镜图像
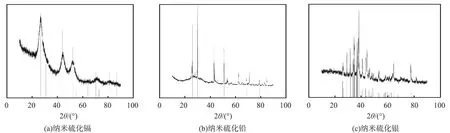
图3 纳米硫化镉、 硫化铅和硫化银的X射线衍射谱图
2.2 溶解平衡常数和热力学函数
将金属硫化物的溶解看作一种反应,可通过公式计算溶解平衡常数[20]。
k=kr-kH2O,
(1)
(2)
式中:k为硫化物的电导率, S/m;kr为溶液的电导率, S/m;kH2O为去离子水的电导率, S/m;λm为硫化物的摩尔电导率,S·m2/mol;c为溶解于去离子水中硫化物的浓度,mol/m3。
硫化镉、 硫化铅、 硫化银是难溶盐,在水中的溶解度小,溶液极稀,因此摩尔电导率计算公式为
(3)
(4)
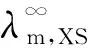
由于硫化镉、硫化铅、硫化银的饱和水溶液是极稀溶液和强电解质,因此溶解平衡时会有如下关系,
cX2+=cS2-=cXS,X=Cd,Pb,
(5)
cX+=2cS2-=2cXS,X=Ag2,
(6)
(7)
式中:ksp为标准溶解平衡常数;αX2+/X+和αS2-分别为Cd2+、Pb2+、Ag+与S2-的活度,mol/kg; 如X是Cd2+、Pb2+,n=1; 如X是Ag+,n=2;cθ为标准摩尔浓度;γ±为平均活度因子,可由Debye-Hückel公式计算,即
(8)
式中:I为离子强度, mol/kg;A、B为常数, 取值分别为0.511 5 (mol/kg)-1/2、 0.329 1×1010(mol/kg)-1/2·m-1;d为离子的平均有效直径,取值为3.5×10-10m;z+和z-分别为溶液中正、 负离子所带电荷数[21]。 离子强度I为溶液中每种离子i的质量摩尔浓度mi乘以该离子的价数zi的平方所得的诸项之和的1/2[21], 即
(9)
分别将在热力学温度328.15、 318.15、 308.15、 298.15、 288.15 K时测得的纳米和粒状硫化镉、 硫化铅和硫化银饱和水溶液的电导率代入以上公式,分别求算其溶解平衡常数ksp,结果见表1。
根据溶解平衡常数,可计算摩尔溶解吉布斯自由能,
ΔGm=-RTlnksp,
(10)
式中:ΔGm为标准摩尔溶解吉布斯自由能,kJ/mol;R为气体常数,8.314J/(mol·K);T为热力学温度,K。
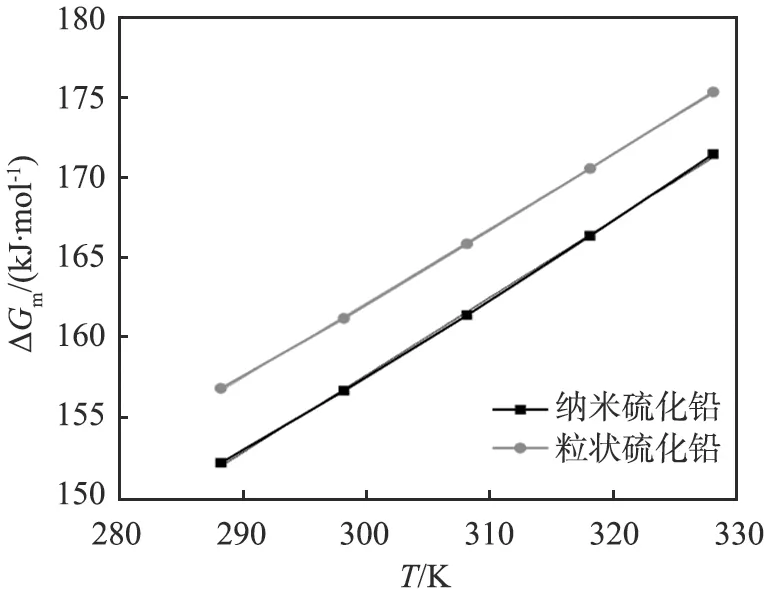
纳米硫化镉、 硫化铅和硫化银和对应粒状材料的摩尔溶解吉布斯自由能数据如表2所示。 由表中数据可知, 纳米硫化物的ΔGm均小于对应的粒状硫化物, 符合Kelvin公式, 即粒度越小, 化学键越容易断裂解离, 物质的溶解度越大, 所需要的ΔGm越低。
(11)
式中:s1、s2为颗粒1、 2的溶解度, kg/m3;R1和R2是颗粒1、 2的半径, m;M为颗粒平均摩尔质量, kg/mol;ρ为颗粒密度,kg/m3;γ为颗粒与其饱和溶液间的界面张力,即为吉布斯自由能[21],kJ/mol。
以ΔGm对热力学温度T作图(见图4),可知纳米硫化物和对应粒状硫化物的ΔGm均随着温度升高而增大,且线性关系较好,在变化不大的温度范围内,溶解焓ΔHm取该温度范围内的平均值,因此结合式(12)可获得纳米和粒状硫化物的摩尔溶解焓ΔHm和摩尔溶解熵ΔSm,结果见表3。
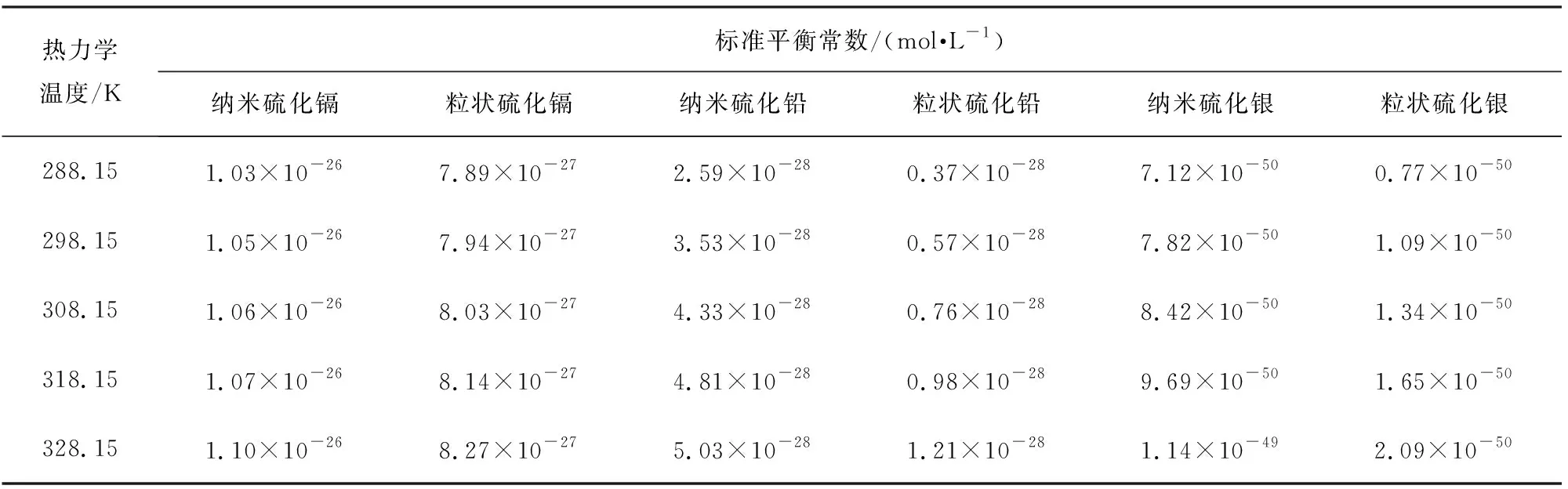
表1 硫化镉、硫化铅和硫化银的标准溶解平衡常数

表2 硫化镉、硫化铅和硫化银的标准摩尔溶解吉布斯自由能
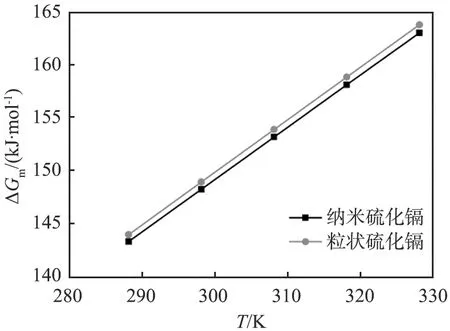
(a)硫化镉
(b)硫化铅
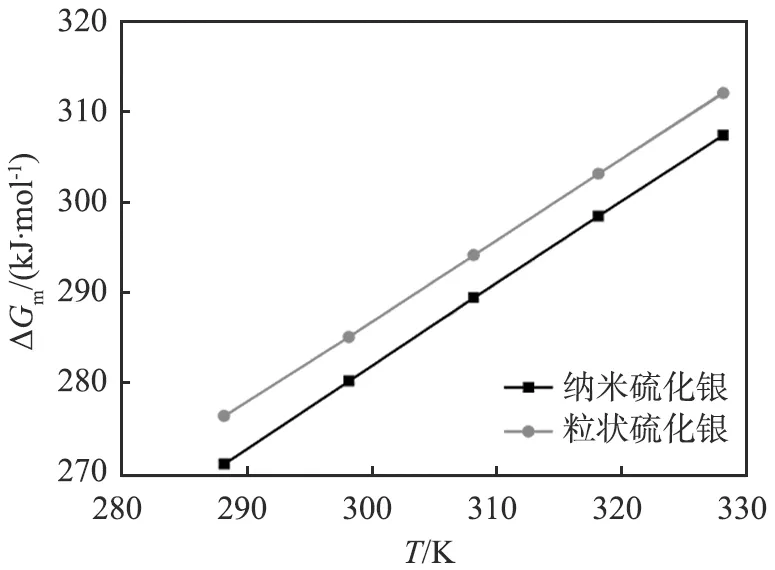
(a)硫化银图4 硫化镉、硫化铅和硫化银的标准摩尔溶解吉布斯自由能ΔGm与热力学温度T的关系
ΔGm=ΔHm-TΔSm。
(12)

表3 硫化镉、硫化铅和硫化银的标准摩尔溶解焓和标准摩尔溶解熵
2.3偏摩尔表面热力学函数与表面热力学函数
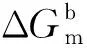
(13)
(14)
(15)

根据文献[22-24]中的研究结论, 表面热力学函数是偏摩尔热力学函数的1.5倍, 可以推算纳米材料的表面热力学函数。 结合以上公式, 计算纳米硫化镉、 硫化铅和硫化银饱和溶液在溶解平衡时的偏摩尔表面热力学性质和摩尔表面热力学性质见表4、 5。
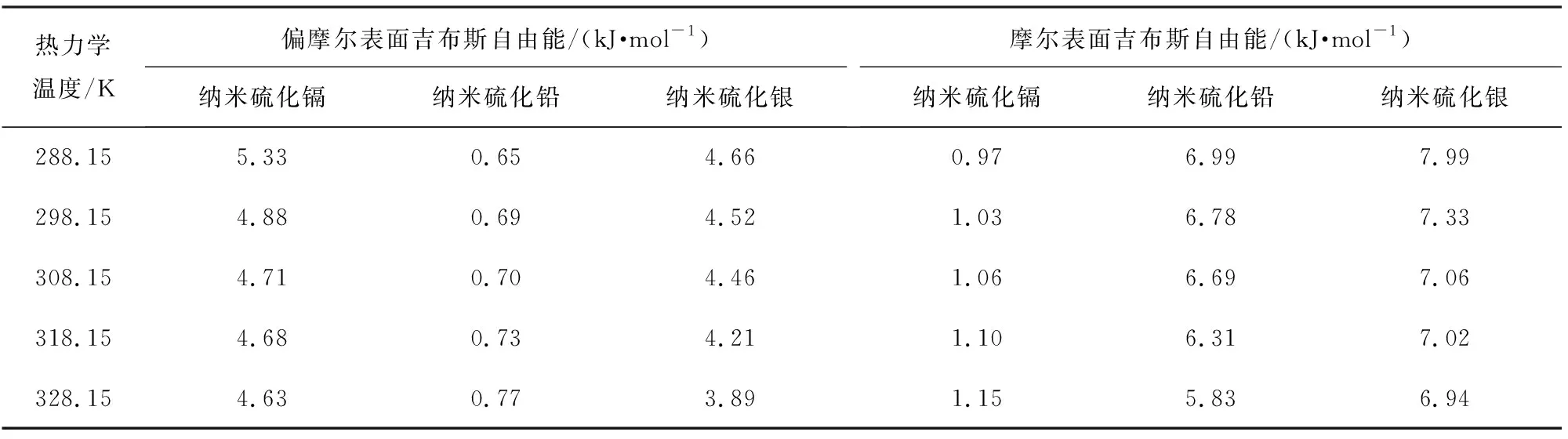
表4 纳米硫化镉、硫化铅和硫化银的偏摩尔、 摩尔表面吉布斯自由能

表5 纳米硫化镉、硫化铅和硫化银的偏摩尔、摩尔表面焓和熵
当晶体材料粒径达到纳米级后,表面原子占据比例急剧增大,表面原子力场尚未饱和,受力不均且具有悬空键,因此不能忽略表面原子极其活泼、不稳定产生的较大生成表面能,纳米材料与粒状材料的生成摩尔吉布斯自由能差别在于纳米材料过剩的摩尔表面吉布斯自由能。粒状材料生成摩尔吉布斯自由能基本都存在体相部分,与纳米材料的体相相同,因此纳米材料生成吉布斯自由能等于粒状材料生成吉布斯自由能和表面能之和。纳米材料化学反应的生成焓和熵也遵循上述规律,由此可得
(16)
(17)
(18)

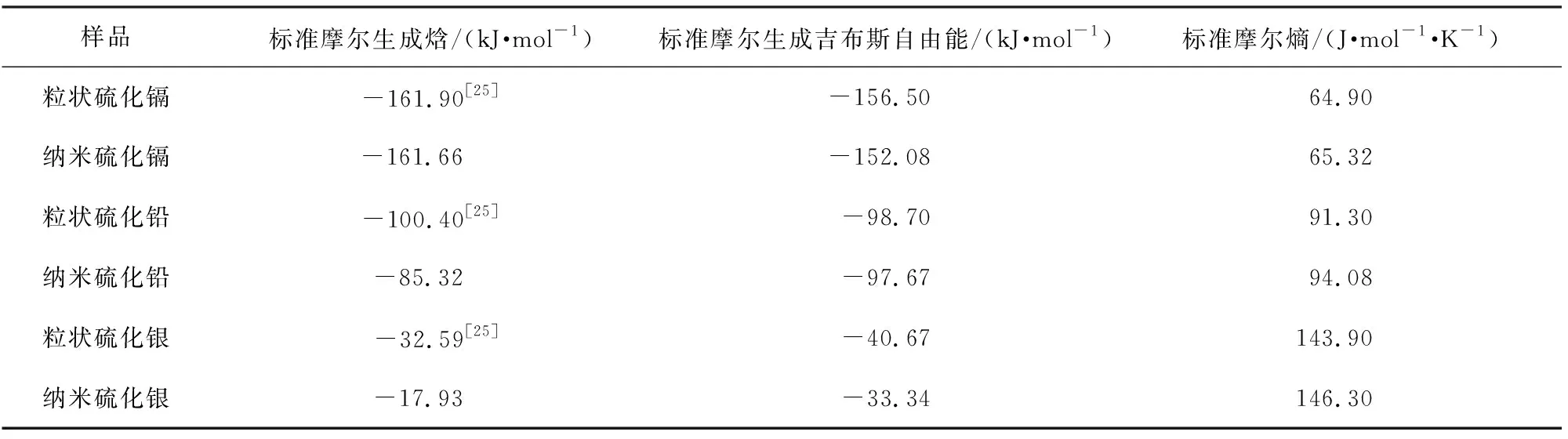
表6 热力学温度为298.15 K时硫化镉、硫化铅和硫化银的标准摩尔生成热力学函数值
3 结论
本文中建立了一种难溶硫化物体系的表面热力学性质测定方法,分别测定了粒状和纳米硫化镉、硫化铅、硫化银在去离子水中饱和溶解平衡时的电导率,依据热力学原理分别研究了其溶解平衡常数、溶解吉布斯自由能、溶解焓、溶解熵;通过纳米和粒状材料的对比,分别计算了纳米硫化镉、硫化铅和硫化银的偏摩尔、 摩尔表面热力学函数,从而获取纳米材料的标准摩尔生成热力学函数,探讨了纳米材料热力学函数随温度变化规律和原因,得出以下结论:
1)随着粒径减小,纳米硫化镉、硫化铅和硫化银标准溶解吉布斯自由能比对应粒状材料的小;
2)纳米和粒状硫化镉、硫化铅和硫化银的溶解吉布斯自由能均随着温度的升高而增大;
3)纳米硫化镉、硫化铅和硫化银的偏摩尔、摩尔表面吉布斯自由能随着温度升高而下降。
