基于氧化石墨烯和酶辅助信号循环放大的Ag+快速检测方法
2020-03-04杨丽娟于凯利
杨丽娟,于凯利,刘 巍
(新乡医学院药学院,河南新乡 453003)
银离子(Ag+)是一种重金属离子。随着在电子、摄影等工业生产和日常生活中的应用越来越广泛,Ag+现已广泛地存在于人类生活的环境中。Ag+可以与羧基、巯基或氨基发生相互作用亦可以取代酶中的其他必需金属离子使酶失活,从而使生物系统受到严重的破坏[1]。传统的银离子检测方法包括紫外分光光度法、原子吸收光谱法、电感耦合等离子体质谱法、量子探针技术等。这些方法虽然能够做到对痕量Ag+的检测,但仍存在一些缺点,比如仪器复杂、成本昂贵等。近年来基于荧光法、比色法的传感器用于Ag+的检测取得很大的进展[2-4],为检测Ag+提供了新的发展方向,然而大多数的传感器还是存在特异性不强、灵敏度低、材料复杂等缺点。因此,开发一些简单、灵敏的Ag+检测方法显得尤为重要。
基于酶辅助的分析物回收循环利用的信号放大方法是一种有效的信号放大方法。Ag+和两个胞嘧啶可以结合形成稳定的C-Ag+-C复合物[5]。核酸外切酶III(Exo III)对这种Ag+介导的DNA错配双螺旋结构具有水解作用。因此,Ag+可以从错配的DNA双螺旋结构中释放,随即与新的荧光基团标记的ssDNA重新结合形成DNA错配双螺旋结构。该过程的多次循环即可实现荧光信号的增强和放大。
本文基于GO对标记在ssDNA上的荧光基团具有强大的荧光猝灭能力和Exo III辅助的分析物Ag+循环回收利用作用,构建了一种具有特异性识别且能高效快速检测Ag+的荧光传感系统,为Ag+的检测提供一种新的方法。
1 实验部分
1.1 试剂及仪器
氧化石墨烯(厚0.55~1.2nm,尺寸0.5~3μm,纯度>99%)购于成都中科时代纳米科技有限公司;FAM-ssDNA(5’-FAM-CCC CCC CCC CCC CCC-3’)购于上海生工生物工程股份有限公司;Exo III购买于NEB(北京)有限公司。
RF-6000荧光分光光度计(日本岛津公司);MS204S分析天平(瑞士METTLER TOLEDO 公司);HH-S4数显恒温水浴锅(常州国宇仪器制造有限公司)。
1.2 氧化石墨烯(graphene oxide,GO)溶液的配制
将10mg GO粉末用去离子水在10mL容量瓶中定容,超声2h,离心(12000r/min)除去未剥离的氧化石墨,取上清液即得均匀的GO悬浮液(1mg/mL)。
1.3 实验方法
将2μL FAM-ssDN溶液(10μM)加入到一定体积的Tris-HCl缓冲溶液中(20mM,pH=7.4,含MgCl25mM和NaCl 50mM);加入1μL 2×10-4M Ag+溶液和4μL 1mg/mL的GO混悬液至400μL;随后放入37℃的水浴锅中孵育80min以形成C-Ag+-C复合物;加入40U的Exo III在37℃水浴锅中继续孵育20min;最后80℃孵育10min使Exo III失活。以494nm为激发波长,在510nm~650nm范围内扫描荧光发射谱图。
2 结果与讨论
2.1 荧光传感器的工作原理
GO与染料荧光素(FAM)标记的DNA寡核苷酸的相互作用形成了稳定的FAM-ssDNA/GO复合物,FAM的荧光被GO猝灭。没有Ag+存在时,FAM-ssDNA继续被吸附在GO表面从而使荧光基团无法释放,没有荧光信号。当Ag+存在时,Ag+与FAM-ssDNA反应结合,形成发卡结构或Ag+介导的DNA错配双螺旋结构(FAM-ssDNA),从GO表面解吸附,荧光信号恢复。加入Exo III之后,发卡结构和/或FAMssDNA被Exo III消化分解,FAM和Ag+同时得到释放,荧光信号恢复。当释放的Ag+再次与GO表面的其他FAM-ssDNA结合时,加入的Exo III还可以进一步酶解释放荧光基团和Ag+,这样荧光信号就得以循环放大,从而可以实现微量Ag+的定量检测。
2.2 C-Ag+-C结构的表征
如图1所示,FAM-ssDNA的荧光探针(50nM)的荧光信号在含有10μg/mL GO的Tris-HCl缓冲溶液中反应20min后几乎被完全猝灭(曲线a),这表明GO可以有效地吸附FAM-ssDNA。图1中曲线b荧光信号增强是因为FAM-ssDNA通过C-Ag+-C形成发卡结构和/或DNA双螺旋结构(FAMdsDNA),阻止了荧光基团与GO之间的荧光共振能量转换。在有500nmol/LAg+存在时(曲线b)荧光发射强度较没有Ag+存在时(曲线a)明显增强。在这里,定义荧光恢复率为F/F0。F0为FAM-ssDNA和GO溶液的荧光强度值(曲线a在518nm处),F为加入Ag+(曲线b在518nm处)或Exo III(曲线c在518nm处)的溶液的荧光强度值。加入Ag+(曲线b)之后,体系的荧光恢复率为2.14。随着Exo III的加入,体系的荧光强度进一步增加,荧光恢复率为6.16。(曲线c与曲线a在518nm处)。
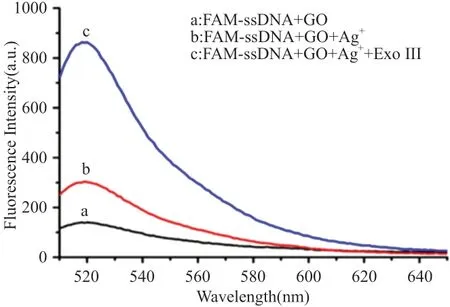
图1 50nmol/L FAM-ssDNA在不同条件下的荧光发射光谱图
2.3 实验条件的优化
2.3.1 GO浓度优化
如果GO浓度太低,溶液中会有过多游离的FAM-ssDNA,导致背景噪音过高(F0值)。而如果GO浓度太高,过量的GO会带来更多的非特异性吸附,导致荧光信号过低(F值)。因此,需要寻找合适的GO浓度。按1.3的实验方法,向体系中加入不同体积的GO混悬液,使GO浓度分别为0、5、10、15、20μg/mL,与FAM-ssDNA溶液混合,然后加入Ag+和Exo III。实验结果表明,荧光恢复率随着GO浓度的增加逐渐增加,在GO浓度达到10μg/mL时,荧光恢复率达到最大值。当GO的浓度大于10μg/mL时,荧光恢复率逐渐降低。因此,GO的最适浓度为10μg/mL。
2.3.2 Exo III最佳浓度的选择
按1.3的实验方法,分别加入10、20、40、50、60U 的Exo III,测定体系的荧光强度。实验发现,体系的荧光强度随着Exo III浓度的增加而增加。但当其浓度达到40U的时候,体系的荧光强度值达到最大,此后随酶浓度的增加体系荧光强度反而下降。因此,该体系加入Exo III的最佳浓度为40U。
2.3.3 酶消化时间的选择
按1.3的实验方法,将Exo III的消化时间分别设为10、20、30、40、50、60min,如果以消化时间为横坐标,体系荧光强度为纵坐标,描绘体系荧光强度随消化时间的变化曲线的话,可以明显看出前20min内,体系的荧光强度随消化时间显著增加,但之后增加不再明显。所以,Exo III的最佳消化时间选择为20min。
2.4 荧光传感器的灵敏度
图2为加入不同浓度Ag2+后的荧光发射光谱图。可以看出,随着Ag+浓度从0增加到700nmol/L,体系的荧光强度值逐渐增加。在500nmol/L Ag+的条件下,该体系的荧光恢复率(F/F0)为5.76。图2为该荧光体系中Ag+浓度与荧光强度的关系。图3的内插图显示,Ag+浓度在50nmol/L至500nmol/L范围内,荧光恢复率与Ag+浓度的对数呈线性关系,F/F0=3.03lg[Ag+]-2.35(R2=0.992)。
2.5 选择性检测
通过检测在相同条件下加入其他金属离子(如Cu2+、Fe2+、K+、Ca2+、Na+、Mg2+、Fe3+、Pb2+、Hg2+)时 荧 光 强 度 的 差异来评价该检测方法的选择性。图4展示了不同溶液(包含500nmol/L的Ag+或10μmol/L的其他金属离子)之间的荧光强度差异。可以看出,Ag+可以使体系表现出相当大的荧光强度差异响应值,但换成其他高浓度金属离子时,荧光强度的差异并没有明显的变化。该结果表明,检测方法对Ag+具有较高的选择性。
3 结束语
本文设计了一种操作简单、灵敏度高、特异性强的 DNA荧光探针,构建了一种基于氧化石墨烯(GO)和酶辅助循环信号放大作用的高灵敏的Ag+检测方法。C-Ag+-C结构可以使荧光基团从GO表面释放,从而实现荧光信号的恢复。Exo III将错配的双螺旋结构进行剪切,进一步恢复和增强荧光信号。实验表明,在最优的条件下,Ag+浓度(50~500nmol/L)的对数与荧光恢复率呈现良好的线性关系,并且荧光探针对Ag+具有特异性的识别作用。
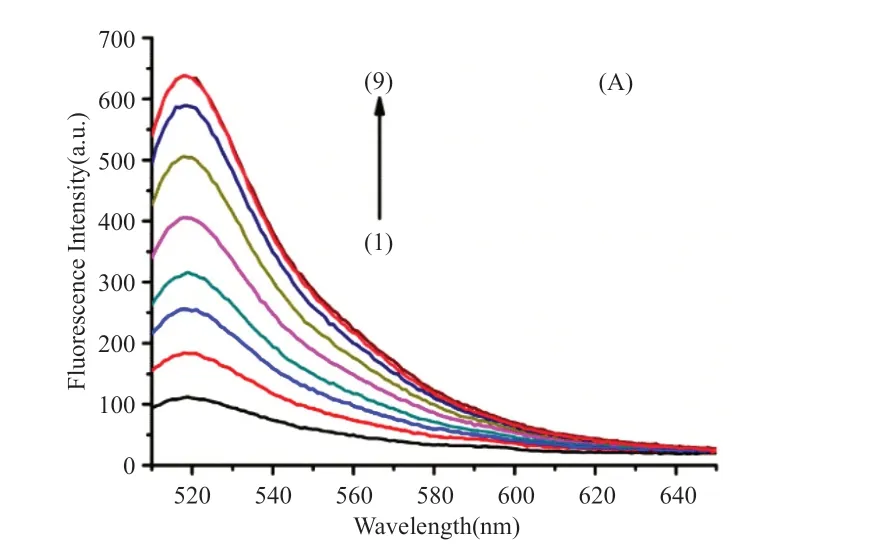
图2 不同浓度Ag+的体系荧光发射光谱图。
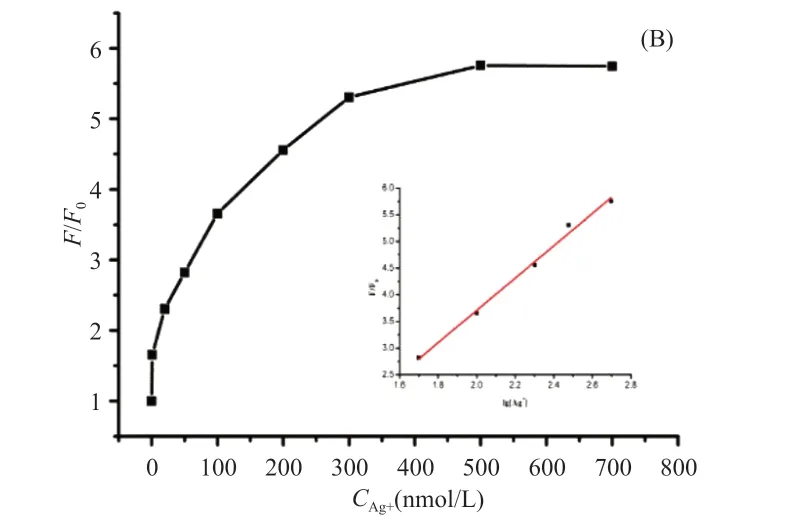
图3 荧光恢复率与Ag+浓度的曲线关系
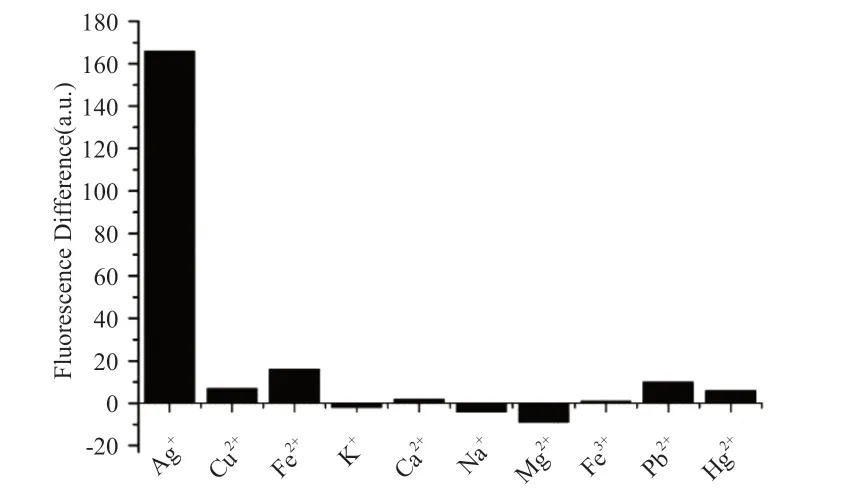
图4 不同金属离子溶液的荧光强度差异。
