神经纤维瘤病II型基因型与表型研究现况
2020-03-04刘羽阳张家墅杨仕明张军
刘羽阳 张家墅杨仕明张军*
1解放军医学院(北京100853)
2解放军总医院耳鼻咽喉头颈外科(北京100853)
3解放军总医院神经外科(北京100853)
【关键字】神经纤维瘤病II型;二代测序;基因诊断;生物信息学
神经皮肤性疾病(Neurocutaneous Disorders,NCD)是一组疾病,其中每一种都有独特的神经系统表现和良性皮肤病变,通常伴有其他器官系统的发育不良(常包括视觉系统)。神经纤维瘤病(Neurofibromatosis,NFT)是最常见的NCD,共有六种不同类型,其中神经纤维瘤病II型(Neurofibromatosis 2,NF2)是最常见的类型之一。
神经纤维瘤病II型是由于NF2基因突变导致的常染色体显性遗传病。临床以双侧前庭神经鞘瘤(Vestibular Schwannomas,VSs)为特征性表现,常伴多发的神经系统肿瘤及眼和皮肤等相关病变。其常见的神经系统病变包括:双侧前庭神经鞘瘤、其他颅神经鞘瘤、颅内脑膜瘤、脊柱肿瘤及周围神经病变[1]。眼部常见病变包括:白内障、视网膜前膜及视网膜错构瘤[2]。常见皮肤病变包括:皮肤肿瘤、皮肤斑块及皮下肿瘤[3,4]。
NF2患者面临诸多问题,例如丧失听力,反复多次手术切除颅内及脊柱、脊髓占位,重要神经功能的丧失,预期受命的缩短等[5,6]。面对诸多病变,治疗策略的选择十分复杂。对于新诊断的患者,基于相似基因型的疾病表型预测对疾病的评估是非常有帮助的。具有早期双侧听力丧失的高风险的患者与低危患者治疗策略是完全不同的[7]。
1 NF2基因结构及表达产物
NF2基因为定位于22q12.2染色体的抑癌基因,长约110000bp,编码区cDNA长为1785bp,包含17个外显子,其中仅前15个外显子可产生致病性突变。NF2基因mRNA经选择性剪切形成多种mRNA亚型,常见的为I亚型(缺失外显子16)和II亚型(包括全部外显子),两者约占90%,仅前者有抑制肿瘤生长作用,III亚型(缺失外显子15及16)较少,且较I亚型活性低[8]。NF2的基因产物—Merlin蛋白包含595个氨基酸,与红细胞膜蛋白4.1超家族(Ezrinradixin-Moesin,ERM)蛋白高度同源,是一种细胞骨架连接蛋白,包括FERM域(N-末端,1-8号外显子)、连接区(9号外显子)、α-螺旋区(10-13号外显子)和C-末端,与细胞膜稳定性、细胞间黏聚及细胞与胞外基质的黏附关系密切[9,10]。与ERM类不同的是,Merlin的C-末端缺少保守的肌动蛋白结合的序列,同时突变往往导致C-末端功能异常[11-13]。
2 NF2基因突变分类
影响NF2疾病严重程度最主要的几大因素包括:基因突变种类,突变所在位置以及携带该致病突变的细胞数量。按照基因突变的遗传模式,可分为生殖系突变和体细胞突变。按照携带突变细胞数量不同,可分为肿瘤组织嵌合体突变、外周血嵌合体突变及完全突变[14]。按照受累基因改变尺度大小又可分为大、中、小三型,其分别为:染色体改变、中型缺失与重复以及单碱基变异。其中染色体改变可分为:染色体缺失、重复、倒位及易位,染色体缺失与重复可统归为拷贝数异常,包括染色体非整数倍的缺失及重复和染色体微缺失、微重复。中型突变指范围在30bp-100kbp之间的缺失和重复,因为其超出某些检测技术手段(如FISH、aCGH、CNVseq等),所以将其单列出来。单碱基变异常被俗称为点突变,其包括碱基置换,小的(30bp以内)的插入和缺失等,从该类突变导致后果来看,小型突变又可分为:错义突变、无义突变、移码突变、同义突变、剪接点突变及动态突变等。在单基因遗传病中,此类变异是最主要的致病方式。
3 NF2基因型与表型关联
基因型与表型的相关性研究目前已得到许多初步结果。截短突变与严重的临床表型相关[5]。首次出现症状的平均年龄以及种系截短突变的诊断年龄分别是16和20岁[15],平均存活期为45.9年[5]。相比之下,剪接点突变和错义突变患者平均存活期为74.2年和79.1年。除此之外,截短突变导致患者听力丧失较早[16]。首次出现症状的年龄及诊断年龄均是疾病严重程度的重要预测指标[17],与前庭神经鞘瘤生长速度相关[18],并且与死亡率直接相关[19]。颅内脑膜瘤的出现与早期死亡相关。脑膜瘤的出现以及诊断年龄较早预示着较差的预后[17]。有关数据显示,携带剪接点突变、大片段缺失、错义突变及嵌合体的患者相比截短突变,具有出现症状及诊断时间更晚的特点[20]。除此之外,相比于截短突变,携带上述突变的患者,出现外周神经肿瘤、脊柱脊髓肿瘤、脑膜瘤的几率更低,疾病负荷较轻[15]。3’端截短突变(外显子14和15)疾病表型比外显子2-13突变轻[1],然而外显子1突变表型较轻[5]。对于同一位置的突变,体细胞嵌合体疾病表型轻于非嵌合体突变[21]。在剪接点突变中,5’末端突变与外显子8至15突变相比,疾病表型更重[5]。包含启动子或外显子1的突变基因型相比上述位置被保留,疾病表型更轻[15]。基于NF2基因突变严重等级评分(UK Neurofibromatosis type 2 Genetic Severity Score)[14],可以更好的评估疾病严重程度及预后。根据基因突变的类型和嵌合现象出现与否,该评分系统分为3个等级,从1A至3类。该系统不同于以往的评分系统,而是将组织嵌合体突变列为单独考虑的一类,是因为该类型突变的临床表型更轻。与评分相对应的3类分别是组织嵌合体突变、经典型突变及严重型突变。其中,组织嵌合体突变包括:符合临床诊断标准[22],但外周血检测中未发现NF2基因突变,或仅在组织中发现有嵌合体NF2基因突变。经典组中包括:NF2突变在外周血中被检测到,或患者为遗传性NF2患者,但没有发现NF2基因突变(但需要排除嵌合现象并且考虑到现有手段无法探测到的NF2突变)。严重组中包括:非嵌合体外显子2-13截短突变。分类1中细分为推测和确诊的嵌合体NF2突变,分类2根据突变类型分为轻型和中型。确定组织嵌合体突变,需要至少在两块独立的神经鞘瘤标本中发现NF2基因突变,并且外周血检测中未发现NF2基因突变。如果仅可获得一块神经鞘瘤组织,并在其中发现NF2突变,外周血检测中未发现NF2突变,那么则归入1A组,猜测其为组织嵌合体突变。如果神经鞘瘤组织未被获取,但是患者符合NF2临床诊断标准,也归入1A组中。外周血嵌合体突变定义为二代测序中突变检测率<50%或者在肿瘤组织中发现NF2基因突变,随后在外周血中也发现了低水平的该基因突变[14]。有关各类突变临床特点及定义详情见表1。
在Dorothy[14]所描述的142名NF2的患者中,基于NF2基因突变严重等级评分,经统计分析得出以下结果。诊断年龄及患者现龄与基因突变严重等级评分成负相关。在肿瘤负荷方面,随着评分等级升高,双侧前庭神经鞘瘤、颅内脑膜瘤、脊髓神经鞘瘤、脊柱内脑膜瘤出现频率升高,并与其呈线性趋势,而单侧前庭神经鞘瘤出现频率降低。组3中更多的患者患有脊柱内脑膜瘤和脊髓神经鞘瘤(36.8%和94.7%),组1中则分别为15.3%和48.3%。脊髓内室管膜瘤的出现频率在各组之间略有区别,组2A和2B分别为44%和33%,组3为26.3%,组1为11.9%。在治疗方面,该评分系统与初次放射治疗年龄,开始使用贝伐单抗年龄,初次手术年龄成负相关,并与主要干预措施数量成正线性相关。在主要干预措施数量评估中,组1平均为1.4次,组3平均为3.4次。47.4%和26.3%的组3患者需要实行脊柱脊髓手术和贝伐单抗的治疗,在组1中分别为9.5%和0%。组1患者中,60%的患者需要进行1次或更少的干预措施,19%的患者超过3次干预措施,而在组3患者中,其分别为37%及53%。在遗传学方面,评估组内家族性与散发性比值可以发现,组2和组3中分别为35%:65%及16%:84%,两组中共55名散发患者,其中71%在组2中。这些结果在一定程度上表明,在基因突变严重等级评分系统中,随着等级升高,遗传适应性越低。用基因突变严重等级评分评估由Kluwe[23]和Ruttledge[24]既往发表的80名NF2患者,也得到了类似的结论,诊断年龄与该评分系统在两组患者均具有良好相关性。Ruttledge[24]所报道的患者中,随着评分等级的升高,诊断患脑膜瘤的患者所占比例越多;Kluwe[23]所报道的患者中,随着评分等级的升高,患颅内肿瘤、脊柱内肿瘤的患者比例增多。虽然现在有很多关于NF2基因型与表型的研究,但真正运用到日常临床工作中,还有一定的困难,许多NF2的研究没有按照基因型分层,这使得队列之间的比较非常困难,因此在NF2研究中按照突变类型分类显得尤为重要,基于相似的突变基因型可以推测相关预后及作出相应的临床决策,并且在一定程度上可以先于症状明确诊断。例如,相对于组3而言,组2A患者需要接受脊柱脊髓手术和脑膜瘤手术干预的可能性明显减小,并且开始干预的年龄明显推后。对于外周血未检测到突变的散发患者而言,诊断年龄明显推后,预示着较好的表型及预后。面对较高的早期双耳失聪风险的患者,可以选择较早进行手术干预前庭神经鞘瘤,从听力重建中获得最大化收益。对于突变严重的儿童患者,家庭成员应尽早学习手语和唇语以便于日后交流。基于基因突变严重等级评分对NF2患者进行评估,可以将复杂的基因型与表型信息转变为简洁的分类评分,方便与患者交流病情,便于比较不同队列中疾病的自然史和预后,使得NF2的评估、治疗决策及相关研究更加规范。
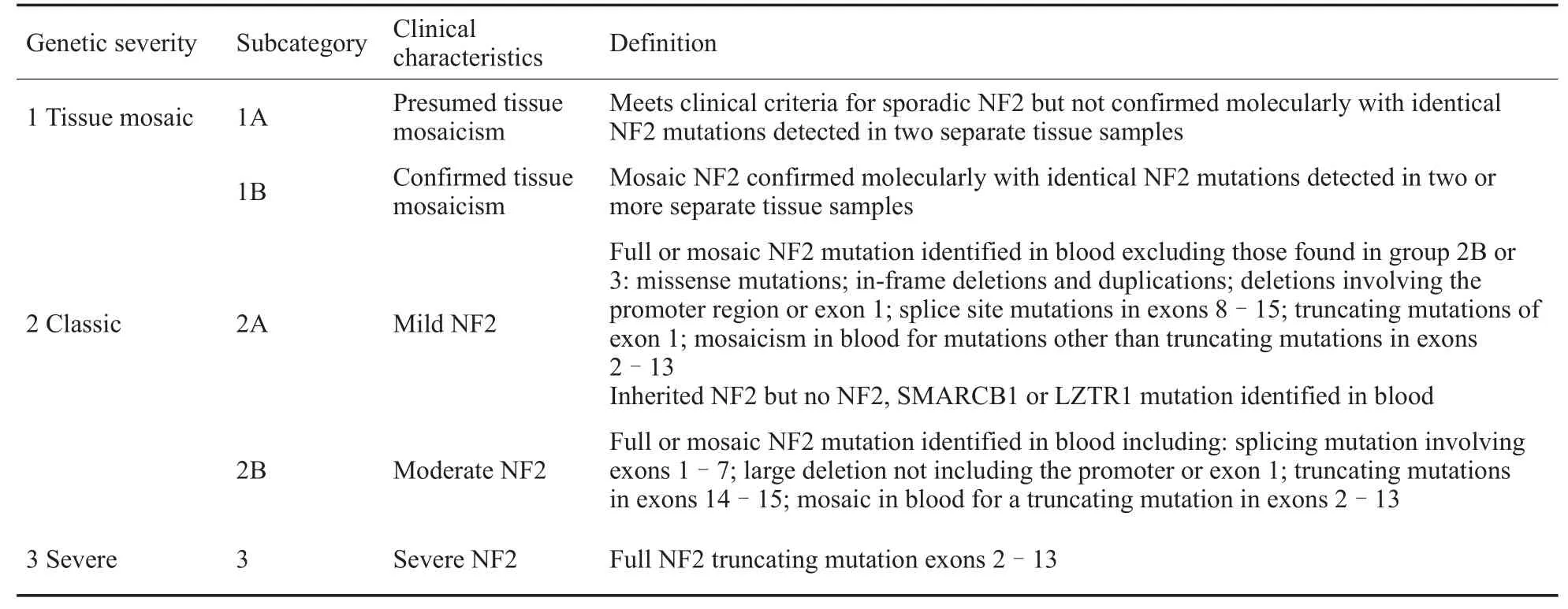
表1 神经纤维瘤病II型基因突变严重等级评分Table 1 UK Neurofibromatosis type 2(NF2)Genetic Severity Score
4 NF2相关眼部病变基因型与表型评估
NF2相关眼部病变评估是神经外科医生容易忽略的方面。对于NF2患者而言,视力问题、肌无力及第八对脑神经受累导致的平衡功能欠佳都会促成身体无法活动,许多患者在成年早期就必须依靠轮椅生活[25]。成年患者主要表现为听力损失、步态不稳,共济失调等临床表现,而儿童患者早期表现为眼部病变,皮肤病变等,缺乏典型的临床表现,容易导致误诊为其他疾病而错过最佳治疗时机。对于儿童NF2患者,视盘的先天性异常、视网膜错构瘤,青少年白内障可以危害视觉系统的发育[3,26]。屈光不正、弱视,双眼视觉形成障碍也十分常见[27,28]。NF2相关的视神经鞘脑膜瘤可能在儿童期或青春期出现,通常导致受累侧视力恶化,并进展为失明[29]。在成年NF2患者中,外部肿瘤压迫或颅内压增高可能损害视神经功能[2,29],继发于神经营养性和神经麻痹性角膜炎的角膜混浊也可以使视力受损。复视可能是由于动眼神经鞘瘤或海绵窦脑膜瘤导致[2,30],眼球震颤也可能出现。所有上述病理改变相互叠加,共同对视觉功能造成损害[31]。尽管眼部病变严重影响NF2患者的生活质量,但有些眼部病变在早期经积极干预可以达到明显改善视力的效果,因此,个性化个体化的评估NF2患者眼部病变及对视力影响程度,采取一定方法预测患者预后,并指导治疗十分关键。Sally[31]基于83位NF2患者眼部病变并结合患者基因突变及NF2基因突变严重等级评分[14]所得出的牛津神经纤维瘤病II型眼部评分系统(Oxford NF2 Ophthalmic Score,ONOS),详情见表2。该系统可以在一定程度上达到上述需求。NF2患者基因型与诊断时视觉功能和随时间恶化的可能性相关。评分稳定意味着视觉功能无恶化,评分逐渐升高可能预示着视力恶化是由可治愈原因导致的,短时间内评分升高预示着新的病理改变的出现。突变为严重组患者,视力恶化的原因往往是难以干预的,这些患者需要持续的监测和治疗潜在的并发症,特别是颅内高压及神经营养性角膜病变。突变为中型组患者,视力恶化主要是由于可治疗的颅内压升高和面神经麻痹的并发症。突变为轻型组患者,超过25%的患者会出现面神经麻痹,近20%出现视神经萎缩,然而这些患者的长期视觉功能预后是良好的。对于嵌合体突变组患者而言,大多数患者视觉功能预后良好,很少需要进行干预。可见ONOS可作为NF2患者持续生活质量评估的一个工具。除了可以早期识别可干预视觉恶化相关病因外,ONOS评分还可以提醒医疗团队对于已确定视力损害的NF2患者进行适当的咨询和转诊。
5 NF2相关听力损伤与基因型关联
双侧前庭神经鞘瘤是NF2的特点,并且出现在约95%的患者中,前庭神经鞘瘤的生长及其相应治疗措施会导致明显的听力损伤,而且这种损伤通常上是双侧且严重影响患者生存质量[32]。因此,听力保留成为NF2患者治疗策略选择的关键所在。然而,不断增加的肿瘤负荷迫使医生以损伤患者听力为代价对其进行相应的干预措施[33]。有些NF2患者选择观察疗法,不对其病变进行干预,这些患者的听力损伤是逐渐发展的,然而突发的感音性耳聋也时有发生[34-37]。对NF2患者听力损伤进程的深入了解,将提高对患者病情进展预判的准确性,并为NF2治疗决策提供重要信息。现有的关于NF2听力损伤进程及相关机制的研究数量有限,尽管有许多关于散发前庭神经鞘瘤的听力损伤的研究,但已经报道的NF2患者的前庭神经鞘瘤生长速度和疾病自然史在各研究中变异性很大,所以并不能参考散发性前庭神经鞘瘤的相关研究[38]。除此之外,NF2患者听力损伤与放射学所测量的前庭神经鞘瘤生长速率之间关联性不强[39]。已发表的有关NF2自然史及听力损伤进程的研究还存在诸多问题,例如,对NF2中选择保守观察疗法的肿瘤进行研究[40],或研究中存在选择偏倚[18,41,42],即报告了部分NF2患者队列,不能很好的代表整体。还有一些研究的随访时间较短,不能准确的反应实际疾病进程的信息。再者,NF2患者不同的临床表型和不同的疾病进程方式是NF2自然史研究中重要的混杂因素,这些因素可能来源于不同的NF2基因突变类型、位置和所携带突变的细胞比例[18,21,43]。可见,只有选择合适的评估方法才能提高临床适用性,为NF2患者提供更为准确的预测。基于基因严重性评分结合患者听力学评估的方法能较好的解决以上问题。听力学评估采用美国耳鼻喉头颈外科协会标准指南和NF2听觉脑干植入及人工耳蜗植入英国共识。Dorothy[14]结合142名NF2患者听力评估资料得出结论,听力等级与基因突变严重等级评分成正线性相关,组织嵌合突变组相比严重组有更多的患者具有可实用性听力,在严重组中,55.6%患者最佳言语识别率>70%,在组织嵌合突变组中为90.3%。基因突变严重等级评分与丧失听力平均年龄呈负相关,在组织嵌合突变组中丧失听力平均年龄为58.2年,严重组中为23.1年。Beatrice[38]对147名NF2患者采用上述方法也得出了相似结论,即基因严重性评分是听力损伤程度的重要预测因子,与最佳识别评分(optimum discriminations scores,ODS)、听力分级、纯音测听(Pure-tone average,PTA)每年最大衰减数都有较好的相关性。失去可用性听力的整体中位数年龄为78岁,但在不同基因突变分组中差别较为明显,在严重组中,失去可用性听力的中位数年龄为32岁,而组织嵌合体突变组为80岁。结合患者基因型对听力损伤进程进行评估,既达到了精准个体化评估的目的,为患者治疗决策提供较为准确的依据,又为NF2疾病自然史研究提供较为规范的研究数据。

表2 牛津神经纤维瘤病II型眼部评分(ONOS)Table 2 Oxford NF2 Ophthalmic Score
总而言之,进一步深入研究NF2基因型与表型的相关性,从多器官多系统层面综合评估患者疾病表型和肿瘤负荷,并运用精准的基因测序手段,结合遗传病家系分析,这些都是进一步深入研究该病的基石所在。运用基因突变严重等级评分和ONOS评分系统可以更加精确的评估患者基因突变的严重程度,结合表型评估二者关联,进而判断患者预后,为患者选择合适的干预手段。此外,规范化收集NF2患者信息更能促进NF2疾病自然史研究,有助于临床医生和科研人员更进一步了解疾病本质特征,为未来最终攻克NF2打下良好基础。
