育肥猪肠道变形杆菌的分离鉴定及系统发育性分析
2020-03-04于季申孟祥竹陈宜贤张晓轩倪宏波李鹏
于季申,孟祥竹,陈宜贤,张晓轩,倪宏波,李鹏
(黑龙江八一农垦大学动物科技学院,大庆 163319)
猪是现今畜牧业中提供肉食品的重要杂食性动物,同时也是研究人的肠道菌群的主要模型动物之一[1]。在过去虽然在猪肠道菌群的结构、功能及宿主关系等多方面都开展了大量研究[2],但至今,学者们对猪肠道菌群的真实情况仍然不够了解。维持动物胃肠道内平衡的微生物群落是肠道健康的重要组成部分,猪肠道内定居着数量庞大、种类繁多的微生物菌群。微生物菌群之间形成了相互依存、相互作用的整体。微生物与动物的生长、发育、消化、吸收、营养、代谢、免疫等方面的过程有直接关系。猪肠道微生物主要包括厌氧菌、需氧菌和兼性厌氧菌。其中,厌氧菌占肠道微生物的98%以上,是肠道中的优势细菌,而好氧菌和兼性厌氧菌占总菌数的1%以下[3]。通常情况下,猪肠道的微生物由生理性细菌、条件致病菌和病原菌组成。动物肠道微生物群也由多种细菌组成,影响宿主多方面功能。揭示猪肠道微生物群落的分类组成和功能对于鉴定微生物在宿主中的生理和健康具有重要意义。由于猪肠道微生物群落影响着猪机体健康和生产性能,因此,尽管大多数关于微生物菌群的研究都受到培养技术的限制,但肠道微生物的结构和功能仍受到很多学者的关注,几十年来一直是一个重要的研究热点。
变形杆菌为人畜共感染的机会致病菌[4]。据报道,1962~2007 年国内各个省份变形杆菌属导致重大食物中毒事件264 起,中毒人数达1.7 万人[5]。普通变形杆菌是多种细菌性感染与食物中毒的病原[6]。奇异变形杆菌为无荚膜、无芽孢、有鞭毛和有菌毛的革兰阴性杆菌,其广泛分布于自然界、动物粪便、临床标本以及人和动物的肠道内,是导致人和动物感染的重要条件致病菌。BISGAARD 等[1]首次从患输卵管炎的产蛋鸡中分离到奇异变形杆菌;江益民等[7]首次从病死肉鸡中分离到奇异变形杆菌。近年来,奇异变形杆菌感染流行趋势不断扩大,鹌鹑[8]、狐狸[9]、鸽子[10]、貂[11-12]等动物感染奇异变形杆菌的报道屡见不鲜,尽管近些年国内有关猪源变形杆菌的报道很多,但变形杆菌身为人畜共患条件致病菌,在健康人和动物肠道中存在,一定条件下引起食物中毒,表现恶心、呕吐、腹泻等,依然受到很多学者的关注。
广泛分布的16S rRNA 基因的DNA 序列测定长期以来一直被用作确定原核生物系统发育关系的金标准。它是目前唯一的分类标记,Vinje 等[13]为其建立了包含综合分类信息的数据库。16S rRNA 基因的鉴别位点位于9 个可变区(V1-V9),这对准确估计微生物多样性的丰富度很重要,但其他区域也对鉴别能力有显著贡献。Klindworth 等[14]在用于16S rRNA 基因扩增的寡核苷酸的设计中根据16 SrRNA 基因的总覆盖度和谱系光谱,对其所包含的可变区进行优化。16S rRNA 基因序列大肠杆菌有1 542 bp 长。Amir等[15]为了克服现有的阅读长度测序技术的不足,已经有各种成功的尝试,通过整合从16S rRNA 基因的多个可变区域获得的短读来获得更高的分辨率。或由Miller 等[16]短读的整个16 Srdna 序列组装而成。然而,短读序列的排列,特别是在组装含有16S rRNA基因高度保守区域的基因时,可能具有挑战性,而且容易出错。通过对常规和焦测序水稻根系微生物16S rRNA(V1-V4)测序数据进行比较,获得不同长度的数据,Okubo[17]和他的同事们由于过高估计水稻根系微生物在属水平上的显着性差异,发现了根瘤菌在层面上没有观察到任何偏差。为了得出类似的结论,Yarza[18]和他的同事从16S 核糖体rna 部分序列的otu 聚类中预测,要全面、可靠地估计类群丰富度,尤其是对高分类等级的分类,需要近全长片段长度大于1 300 个核苷酸的序列。目前,GS FLX+测序器(Roche/454)使用钛XL+化学可以达到1 000 bp 的阅读长度。随着新测序平台的发展,16S rRNA 基因的全长分析成为可能。一个限制因素是,Yarza 目前发表的16S rRNA 序列长度中只有23%大于900 bp,测序技术的发展和数据库的全长度读取是相互依赖的,高质量的16 SrRNA 数据将迅速增加。Mosher[19]和他的同事分析了PacBioRSⅡ测序器获得从元基因组环境样品中产生的16S rRNA 片段的全长度读取的能力。虽然高误差率(17%~18%)大大高估了他们在2013 年的初步研究中的物种丰富度,但16S 测序技术的进一步改进大大改善了结果,使微生物的准确鉴定达到环境样品中的物种水平。综上所述,近些年的快速发展和新的创新测序技术的能力,经过仔细的错误监测和故障排除,已经适应科学时代的要求。16S 测序、宏基因组和培养组的联合可以验证前人海量的大数据分析结果,同时也为提高商品猪的高效安全养殖带来可能。
1 材料与方法
1.1 材料
1.1.1 仪器和试剂
试剂:Taq MasterMix,Marker 均选自(宝日生物公司);EB,50xTAE,VK1 均选自(北京索莱宝公司);16S 7F 引物,1510R 引物及测序服务由上海生工公司完成引物序列如下:
上游1510R 引物: 5′-ACGGYTAGGTTGTTACGACTTT -3′;
下 游 7F 引 物: 5′ -AGAGTAAGATYMTGGCTCAGG -3′。
1.1 方法
1.2.1 样品的采集
采用直肠采集法从某猪场采集6 头健康的大白品种育肥猪新鲜粪便各1 份。粪便样本直接放置在厌氧袋中,并置于带冰的泡沫箱中,立刻运送回实验室做下一步处理。
1.2.2 实验前准备工作
准备工作:前期送到的所有的试剂及材料,都需要进行灭菌处理,以保证无菌,减少损失。
(1)提前两天将进行营养液的无菌处理,需将牛瘤胃液和脱纤维的羊血进行涂板检验。若发现有污染。先用0.45 μm,后用0.2 μm 孔径的滤膜进行过滤,再涂板检验,每次用完牛瘤胃液和羊血后,都需要涂板检验。将未使用的培养皿进行紫外消毒。
(2)提前一天将培养基配置完成,共3 种培养基见表1,加热溶解后进行高压灭菌后待培养基凉至60 ℃加入营养液,倒板。板放入4 ℃保存。每种平板拿出一块放入37 ℃温箱孵育确保无污染。

表1 培养基名称及厂家Table 1 Name and manufacturer of culture medium
1.2.3 16S rRNA 基因PCR 扩增
对应试管在3 个1.5 mL EP 管标号。摇晃试管,使菌体与培养液混匀。PCR 检测及测序:吸取菌液500 μL 注入到一个EP 管中,12 000 rpm,10 min,弃上清,加入1 mL 去离子水,用封口膜封上。电磁炉100 ℃水浴煮6 min。取0.3~0.5 μL 进行PCR。
扩增PCR 反应程序见(表2)。

表2 16S rRNA 基因扩增PCR 反应程序Table 2 PCR reaction procedure of 16Sr RNA gene amplification
(1)第一次PCR 体系为:25 μL max,0.5 μL 模板,1 μL 上游引物,1 μL 下游引物,22.5 μL 水,阴性对照模板改为水。
(2)将第一次显示为阴性的样本进行二次PCR,此时模板量改为3 μL。
(3)对PCR 产物进行1%琼脂糖凝胶电泳检测。0.2 g 琼脂糖+20 mL TAE,加热溶解后室温放置至60 ℃左右,加入1 uLEB,混匀后对光检查液体内EB是否全部溶解,倒入模具。15 min 后加样;0.4 g 琼脂糖+40 mL TAE,加入2 μL EB。
(4)对电泳检测条带正确的PCR 产物送测序。
1.2.4 药敏试验
将鉴定为奇异变形杆菌和普通变形杆菌的纯培养物用接种棒均匀涂布在鲜血培养基上,将药敏纸片(氟苯尼考、头孢曲松高度敏感;链霉素、盐酸林可霉素、卡那霉素、新霉素、氨苄西林钠、阿莫西林、庆大霉素9 种药物)分别贴于平皿中,37 ℃培养24 h,测定抑制菌圈直径大小,根据检测标准判定结果。
1.2.5 数据分析
(1)测序结果与Genebank 数据库中登录的基因序列进行同源性比对分析。
(2)用DNA Star 软件构建系统进化树,并进行同源性分析。
(3)将15 株菌的药敏结果进行对比分析,测定抑制菌圈直径大小,根据检测标准判定结果。
2 结果
2.1 PCR 鉴定结果
通过提取细菌DNA 为PCR 模板,应用16S 通用引物1510R 和7f 进行PCR 扩增得到目的片段约为1 700 bp,其部分结果如图1:
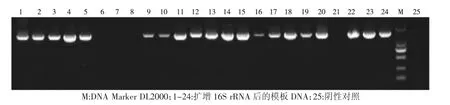
图1 细菌扩增16S rRNA 结果Fig.1 Amplification of 16S rRNA by bacteria
2.2 菌分离鉴定结果
通过16S rRNA 基因测序鉴定,最终分离鉴定结果包括:奇异变形杆菌(Proteus mirabilis)、变形杆菌(Proteus mirabilis)、粪肠球菌(Enterococcus faecalis)、表皮葡萄球菌(Staphylococcus epidermidi)、腐生葡萄球菌(Staphylococcus saprophyticus)和地芽孢杆菌(Bacillus licheniformis),见表3。
2.3 16S rRNA 基因组DNA 序列分析
将分离菌株H1-H15 的PCR 扩增产物进行测序,测序后利用MED6 软件系统发育树分析发现,H1-H15同源性都接近于100%;见图2。最后在NCBI 上利用BLAST 软件与Gen Bank 中公布的12 株参考菌株进行同源性对比分析,与参考菌株的同源性为99.8%~100%,见图3。最终确定H1-H15 都为变形杆菌。

表3 分离鉴定菌种结果Table 3 Isolation and identification of bacteria
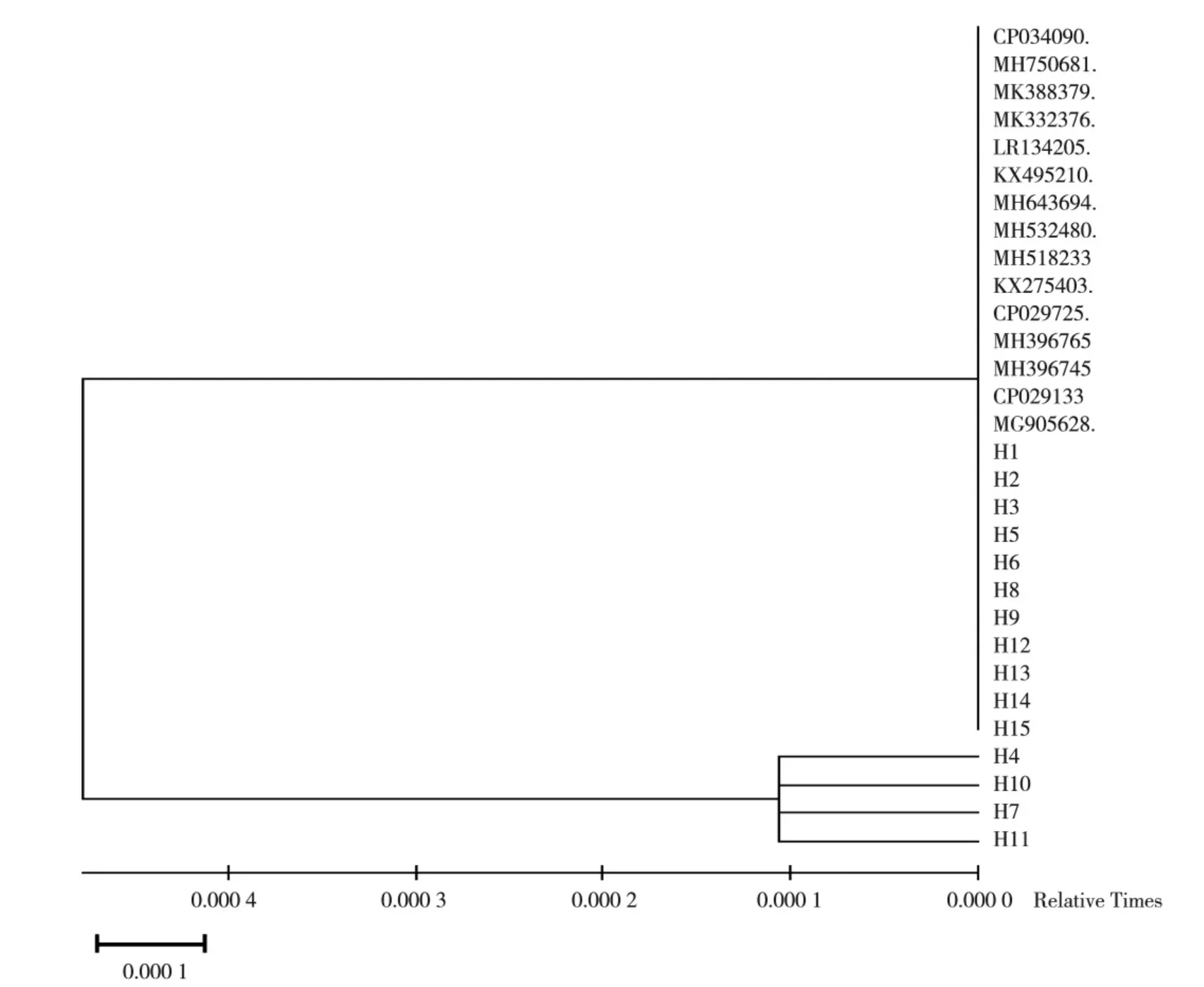
图2 分离菌株的16S rRNA 基因的进化树分析Fig.2 Evolutionary tree analysis of 16S rRNA gene of isolated strains

图3 同源性比对分析结果Fig.3 Analysis results of homology comparison
2.4 药敏实验结果(见表4)
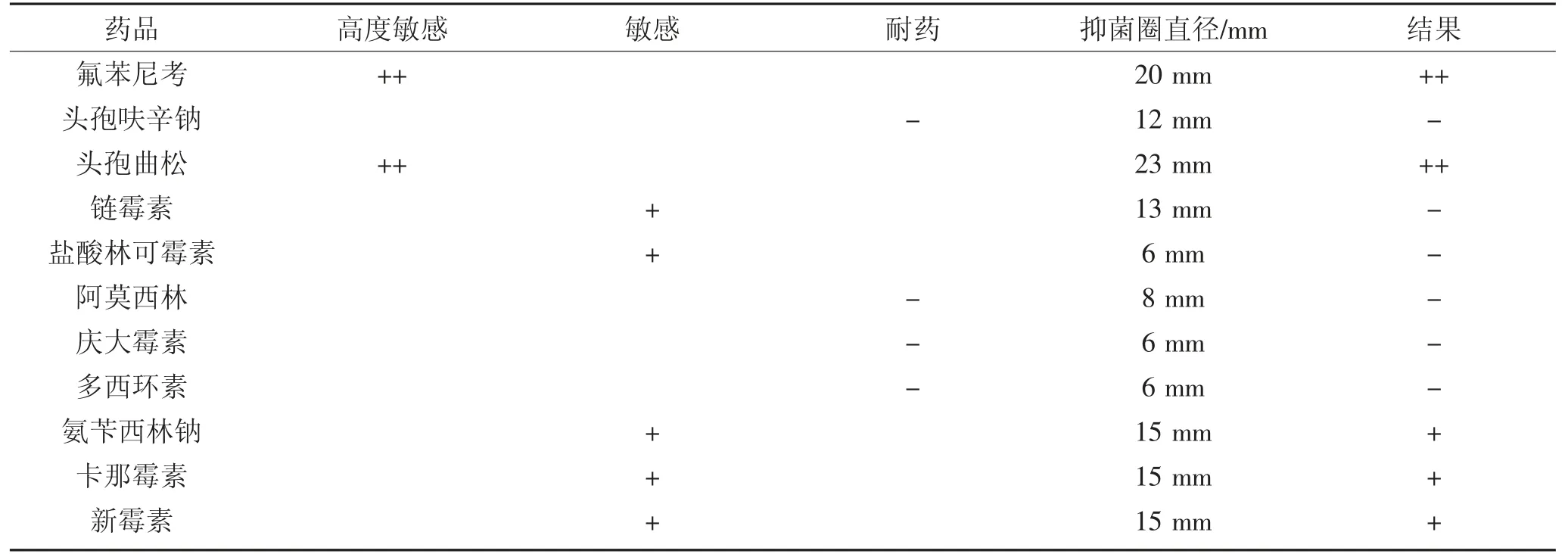
表4 15 株变形杆菌的综合药敏结果Table 4 15 comprehensive drug sensitivity results of proteus
3 讨论
近年来,奇异变形杆菌感染流行趋势不断扩大,鹌鹑、狐狸、鸽子、貂等动物感染奇异变形杆菌的报道屡见不鲜,禹文海等[20]报道了用PCR 的方法快速检测猕猴的奇异变形杆菌;段二珍等[21]报道了从病死的狐狸体内分离出奇异变形杆菌,该菌具有很强的致病力,通过系统发育树分析与貉的奇异变形杆菌有很高的同源性;周芳等[22]报道了鸡源的奇异变形杆菌感染后通过系统发育分析发现该菌发生变异,耐药性增强,史同瑞等[23]报道了水貂的奇异变形杆菌对卡那霉素、链霉素、阿米考星等药物敏感,对氧氟沙星、红霉素等多种抗生素耐药;任梅渗等[24]报道了猪源奇异变形杆菌对很多种抗生素有很强的耐药性;李欣南等[25]报道了鸡源奇异变形杆菌在肉鸡养殖中具有较高的感染率,该菌对11 种抗生素的耐药性普遍偏高,其中对黏杆菌素、氟苯尼考、恩诺沙星等9种药物耐药率达到了80% 以上,对头孢噻呋等药物敏感,综合参看近年来CNKI 上关于动物奇异变形杆菌的文献,目前只局限于对单株变形杆菌的动物致病力实验、体内分离、药物分析等基本实验数据分析,而且单个菌株到几个菌株都只局限于小数据分析,不足以说明实质问题。16S 测序、宏基因组和培养组的联合可以验证前人海量的大数据分析结果,利用组学的培养技术与16S 测序鉴定共鉴定出15 株变形杆菌;实验主要着重于猪肠道变形杆菌的生长特性和大数据分析,这正是与海量前人的实验结果的鲜明对比之处;实验结果验证猪肠道变形杆菌可以通过培养组学技术培养出来。在了解变形杆菌生长特性后入手并做了药物分析实验,结果显示氟苯尼考、头孢曲松高度敏感。实验结果既能说明猪肠道变形杆菌的培养特性,又能从大数据实验数据角度分析验证前人海量的实验数据。
奇异变形杆菌虽然在现今集约化养殖条件的猪场不易被发现,但通过培养组学技术以及16S 测序技术解决了实际问题,又通过系统进化树发育性分析及Gen Bank 中参考菌株的同源性比对最终确定了11 株奇异变形杆菌,4 株普通变形杆菌。说明了变形杆菌可以在体外分离培养,只要做好预防措施会大幅度的提升商品猪变形杆菌感染的安全问题,实验虽然药敏结果显示氟苯尼考、头孢噻呋高度敏感,但不可生搬硬套,因为有些养殖场,长期不科学使用抗生素可导致耐药性过强,同时会增加奇异变形杆菌病的治疗难度,各猪场在针对本病进行预防时应选用不同的抗生素,要灵活运用,根据猪场的实际情况,做好防重于治的准备,例如饲养密度、湿度、温度、免疫程度、是否定期消毒;都要考虑在发病因素内,一旦发现致病菌及时治疗并对症下药[26]。
4 结论
(1)该试验通过16S rRNA 基因测序技术和培养组学技术分离鉴定出11 株奇异变形杆菌和4 株普通变形杆菌,并且通过发育树分析和同源性比对分析说明了健康大白品种育肥猪奇异变形杆菌和普通猪源性变形杆菌的亲缘性和遗传进化规律。
(2)药敏结果显示奇异变形杆菌和普通变形杆菌对于氟苯尼考、头孢曲松高度敏感;链霉素、盐酸林可霉素、卡那霉素、新霉素、氨苄西林钠中度敏感;阿莫西林、庆大霉素耐药。氟苯尼考、头孢曲松可作为临床感染治疗的参考用药。
