重组Ad-SurvivinT34A腺病毒对Lewis肺癌细胞生长的抑制作用*
2020-03-04张鹏王春婷黄雪梅谢康
张鹏,王春婷,黄雪梅,谢康
610041 成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院,放射肿瘤学四川省重点实验室(张鹏、谢康);610041成都,四川大学 生物治疗国家重点实验室(王春婷);646000四川 泸州,西南医科大学附属中医医院 肿瘤血液病二科(黄雪梅)
肺癌仍是目前世界上致死率最高的恶性肿瘤,包括非小细胞肺癌(non-small cell cancer,NSCLC)和小细胞肺癌,NSCLC约占85%左右[1]。临床上常规的治疗方法主要包括手术切除、放化疗等,但是其5年生存率仍有待提高,术后复发是影响患者长期生存的主要因素。近年来,新技术手段的不断涌现促进人们对肿瘤的发生发展机制开展了更加深入、细致的研究,在肿瘤驱动因子、节点蛋白以及肿瘤微环境方面也取得了重要成果,靶向治疗与免疫治疗正作为NSCLC的新型治疗模式,临床上逐渐应用于晚期或复发患者的一线或二线治疗[2-5]。
理论上,肿瘤免疫治疗的目标是诱导机体产生针对肿瘤细胞的特异性免疫,成功的免疫诱导首先是要识别位于人类白细胞抗原(HLA-Ⅰ或HLA-Ⅱ) 上的肿瘤相关抗原(tumor-associated antigens,TAAs ),然后再通过T细胞受体的信号激活宿主T细胞反应[6]。因此,理想的TAAs应特异性地表达在肿瘤细胞上,而在正常细胞不表达或者只表达在不重要的正常组织,同时TAAs应该是肿瘤发生发展过程中的重要的基因,能够通过抑制其表达而使肿瘤不能逃避免疫监视[7]。然而肿瘤细胞自体抗原的免疫原性较弱,机体对这些肿瘤抗原是耐受的,正常情况下不足以产生自体免疫反应。已有研究表明,可以利用异种同源基因在进化过程中所形成的细微差别来打破免疫耐受,增强免疫原性,诱导肿瘤细胞的细胞和体液免疫反应,进而达到抗肿瘤的目的[8]。
Survivin T34A是Survivin的一种显性负突变体,系Survivin蛋白的第34位苏氨酸突变成了丙氨酸(Thr34Ala)。Thr34是细胞周期素依赖性蛋白激酶p34cdc2的磷酸化位点,因此该位点的磷酸化是保持Survivin 抗凋亡功能的基础。一旦将该位置上的氨基酸Thr替换成Ala,则去除了p34cdc2-cyclin B1磷酸化位点,从而使该突变体具有显性负作用[9-14]。研究发现,重组腺病毒Ad-T34A感染能够诱导人乳腺癌、宫颈癌、肺癌、大肠癌、前列腺癌等肿瘤细胞发生自发性凋亡,而处于增殖状态的正常人类细胞如纤维母细胞、内皮细胞、平滑肌细胞等却不受影响[15-16]。同时,SurvivinT34A 突变体还能促进肿瘤组织内血管内皮细胞的凋亡,瘤内注射携带SurvivinT34A 突变体的腺病毒可以抑制裸鼠体内乳腺癌移植瘤的生长,减少肿瘤源性血管密度达60%[17]。本实验室的初步研究使用Clustal W(http://www.ebi.ac.uk/clustalw/)对小鼠和人的Survivin蛋白序列进行相似性比较发现,两者同源性高达83%,具备产生异种交叉免疫反应的可能性。并且,用携带人和小鼠SurvivinT34A突变体的质粒分别转染小鼠和人的肿瘤细胞后,二者均可诱导肿瘤细胞凋亡。因此,在本实验中我们构思采用异种SurvivinT34A为基础的肿瘤治疗方案,通过对动物肿瘤模型的治疗,研究异种Survivin T34A腺病毒治疗能否不仅促使肿瘤细胞凋亡,抑制肿瘤内新生血管的形成,而且诱导针对Survivin的特异性细胞免疫反应,从而在多个层面上更强抑制肿瘤,从而达到针对Survivin的肿瘤靶向治疗的最佳效果,并分析具体机制。
1 材料与动物
pORF9-mSurvivinT34A、pORF9-hSurvivinT34A克隆质粒载体、穿梭质粒pENTR11 vector、病毒骨架质粒载体pAd/CMV/V5-DEST vector均购自Invitrogen 公司。DMEM、胎牛血清和胰蛋白酶购自Gibco 公司(美国) 、Hoechst 33258染色试剂购自成都碧云天生物技术公司、原位TUNEL检测试剂盒购自Boehringer Mannheim公司。羊抗小鼠Survivin、羊抗人Survivin抗体购自Santa Cruz Biothech公司、辣根过氧化物酶标记大鼠抗羊抗体购自Vector Laboratories公司。大鼠抗小鼠CD31(PECAM-1)单克隆抗体购自BD Pharmingen公司。人胚肾细胞(293细胞)、小鼠Lewis肺癌(Lewis lung cancer,LLC)细胞株均由本实验保存。清洁级6~8周龄C57BL/6小鼠均来源于四川大学华西实验动物中心。
2 方 法
2.1 细胞培养
将人胚肾293细胞、鼠LLC细胞株(本实验室提供) 复苏,用含10%已灭活的胎牛血清(成都哈里生物有限工程公司) 的DMEM(GIBCO) 培养基,置于含5%CO2,37℃恒温细胞培养箱中培养,待生长细胞达到80%以上的汇合度时,胰酶消化,进行传代培养。
2.2 采用Gateway系统构建、制备重组腺病毒
根据 pENTR11 vector酶切位点,设计引物序列,分别从pORF9-mSurvivinT34A、pORF9-hSurvivinT34A质粒克隆mSurvivinT34A、hSurvivinT34A完整开放阅读框。通过聚合酶链式反应(polymerase chain reaction,PCR)或传统的克隆方法将目的基因克隆进入门载体。混合包含目的基因的入门克隆和合适的目的载体及GatewayTMLR ClonaseTM酶,产生表达克隆。PCR鉴定以及酶切鉴定正确后,将保种菌液送测序,测序结果正确后准备进行重组腺病毒包装。重组病毒质粒转化TOP10大肠杆菌,37℃振摇扩增。小量提取高纯度高浓度质粒,经PacI酶切,使重组病毒质粒线性化,胶回收大片段,分光光度计测定质粒浓度备用。通过脂质体介导重组质粒转染293细胞,培养10天左右开始出现细胞病变,14天用细胞刮棒将细胞刮入无菌离心管中,分别在37℃和-20℃冻融3次以破碎细胞,离心收集上清,-80℃保存备用。将收集的病毒上清按照TCID50方法检测滴度,进行单克隆重组腺病毒的筛选。将第四代病毒种子液抽提腺病毒DNA,PCR验证E1A、E2B、目的基因条带,以293细胞DNA为阳性对照。丢弃E1A为阳性的病毒种子。用第四代病毒种子液感染生长状态良好的LLC细胞,48~72h后进行Western Blot检测Survivin蛋白的表达。验证后确认得到完全正确的病毒种子,进行重组腺病毒的大规模扩增和纯化。分别用VP法和TCID50法测定纯化病毒的纯度和滴度,将得到的纯化后的病毒进行分装,用作后续实验。
2.3 重组Survivin腺病毒体外促凋亡作用
当LLC细胞融合达60%~80%,生长状态良好时,用胰酶消化细胞,计数后接种六孔板,每孔接种5×105个细胞,二氧化碳孵箱37℃培养16~24h,观察细胞生长情况。当细胞密度达60%~70%融合,细胞总数大约为106时,分别用Ad-null、Ad-MST34A、Ad-HST34A病毒感染细胞,病毒感染复数(multiplicity of infection,MOI)为50,计算病毒用量为5×107PFU,设不加病毒孔作为空白对照。每隔30min摇晃六孔板一次,2小时后各孔加入DMEM培养基补足至2mL,二氧化碳孵箱中37℃培养36~72h。
2.3.1 形态学观察 病毒感染细胞后24h、36h、48h、60h及72h,分别在倒置显微镜下观察培养瓶中细胞的形态变化。选取细胞形态变化最明显的时段,感染60h时在倒置显微镜下照相。
2.3.2 Hoechest染色法观察细胞核形态的改变 病毒感染细胞60h后,吸去各孔培养基,加入Hoechest 33258染色液500uL将细胞覆盖。室温放置3~5min后,先吸除Hoechest 33258染色液,然后用生理盐水洗涤,每次3~5min,2~3次后直接在荧光显微镜下观察或封片后荧光显微镜下观察。若肿瘤细胞发生凋亡,会看到细胞核呈致密浓染,或碎块状致密浓染。
2.3.3 流式细胞术检测 流式检测采用氩离子激发荧光,激光光波波长为488nm,发射光波波长大于630nm,会产生红色荧光,因此可以分析PI荧光强度的直方图, 来定量观察亚G1期细胞在104个细胞中所占的比例。肿瘤细胞在处理48~72h后,用胰酶消化,镜下观察细胞收缩变圆后,终止消化,收集细胞(1~5)×106个,磷酸缓冲盐溶液清洗、重悬后上机检测。
2.4 重组Survivin腺病毒抑制体内LLC细胞生长
2.4.1 小鼠LLC细胞皮下移植瘤模型 首先收集处于对数生长期、生长状态良好的LLC肿瘤细胞,1500rpm离心3min,用双无培养基(无血清、无抗生素)洗涤1次,细胞计数后将浓度调整为4×106/mL,无菌条件下送到动物房。建模动物采用6~8周龄、18~24g的雌性C57BL/6小鼠。将LLC肿瘤细胞接种到小鼠右侧胁背部皮下,每只接种4×105个肿瘤细胞(0.1mL),共接种60只小鼠。
2.4.2 实验分组及处理 待细胞接种后第8天,可扪及小鼠胁背部肿瘤长至约1~3mm时,将小鼠随机分组,每组15只小鼠,具体实验分组如下:A)生理盐水治疗组 (NS);B)空载病毒治疗组(Ad-null);C)鼠源的MSurvivinT34A重组腺病毒治疗组(Ad-MS);D)人源的HSurvivinT34A重组腺病毒治疗组(Ad-HS)。每只小鼠尾静脉注射腺病毒1×109PFU/100μL,每周治疗一次,共治疗2次。
2.4.3 生长曲线和生存曲线绘制 小鼠肿瘤直径达到3~5mm后,各组取5只小鼠每三天测量各组小鼠肿瘤二维直径,计算肿瘤体积,公式为V=0.52×长×宽2,绘制生长曲线。每组取10只小鼠,治疗后观察各组小鼠生存时间,绘制生存曲线。
2.4.4 Cr51释放实验检测细胞毒性T淋巴细胞(cytotoixc T lymphocyte,CTL)活性 各组小鼠治疗2周后,每组小鼠取2只小鼠进行Cr51释放实验,检测各组小鼠脾脏淋巴细胞对LLC肿瘤细胞的特异性杀伤作用。
2.4.5 血清收集和抗体检测 待小鼠肿瘤直径达到20mm时每组处死5只小鼠,处死前眼眶取血0.5~1mL,37℃水浴30分钟,6000rpm离心5分钟,收集上清,置于-80℃备用。用之前制备的LLC细胞中提取的Survivin蛋白为底物,将收集到的血清按1:50比例加入1mL封闭液中,孵育过夜,常规操作后,羊抗小鼠的二抗按1:5000比例加入10mL TBST溶液中,孵育清洗后,检测各组小鼠血清中有无抗Survivin抗体产生。
2.4.6 肿瘤组织切片和染色 实验小鼠处死后完整剥离肿瘤组织,分成两部分,一部分加入OCT置于-80℃或液氮保存(用于冰冻切片),一部分用福尔马林固定(用于石蜡切片);同时取心、肝、脾、肺、肾脏等组织标记后福尔马林浸泡备用。CD31染色和TUNEL染色均按试剂盒说明书进行。
2.5 统计学分析
实验数据均采用软件SPSS 13.0进行统计分析,数值以均数加减标准差表示,计量资料采用Student’s t检验,小鼠生存率曲线采用Log rank test分析,P<0.05表示具有统计学意义。
3 结 果
3.1 重组SurvivinT34A病毒体外促凋亡作用
3.1.1 细胞大体形态观察 感染后60h各组肿瘤细胞形态变化如图1所示,可以观察到与空白对照组相比,Ad-MS、Ad-HS重组腺病毒感染组的LLC细胞形态发生明显变化,肿瘤细胞生长缓慢,变圆,脱落,细胞密度明显减少。同时,Ad-HS组肿瘤细胞形态变化时间延迟。而Ad-null组肿瘤细胞生长状态良好,肿瘤细胞生长分裂速度快,与空白对照组比较基本没有变化。

图1 LLC细胞感染重组腺病毒后形态变化图
Figure1.MorphologicalChangesofLLCCellsInfectedwithRecombinantAdenovirus
A. Control Group; B. Ad-null Group; C. Ad-MS Group; D. Ad-HS Group; LLC: Lewis lung cancer.
3.1.2 Hoechest染色法观察细胞核形态的改变 感染重组腺病毒60h后各组肿瘤细胞进行Hoechest 33258染色,在荧光显微镜下观察LLC肿瘤细胞的凋亡情况。如图2所示,凋亡细胞的细胞核呈致密浓染,或碎块状致密浓染,如箭头所示。可以看到空白对照组和Ad-null组凋亡细胞较少,Ad-MS、Ad-HS组凋亡细胞比例明显增加。
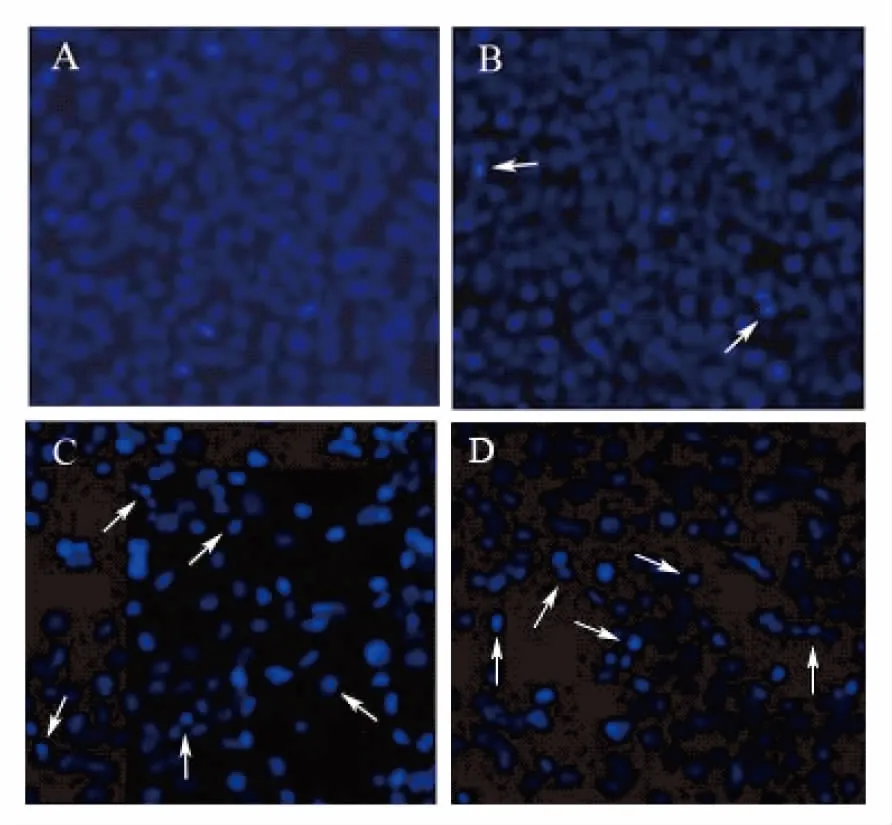
图2 LLC细胞感染重组腺病毒后Hoechest染色图
Figure2.HoechstStainsofLLCCellsInfectedwithRecombinantAdenovirus
A. Control Group; B. Ad-null Group; C. Ad-MS Group; D. Ad-HS Group.
3.1.3 流式细胞术检测 采用流式细胞术分析LLC细胞中亚G1期细胞所占比例,检测细胞凋亡率。LLC细胞感染重组腺病毒60h后各组肿瘤细胞检测结果如图3所示。可见Ad-MS、Ad-HS组肿瘤细胞凋亡率明显高于空白对照组和Ad-null组,差异有统计学意义(P<0.05)。

图3 LLC细胞感染重组腺病毒后流式细胞术检测图
Figure3.DetectionofLLCCellsInfectedwithRecombinantAdenovirusbyFlowCytometry
A. Control Group; B. Ad-null group; C. Ad-MS group; D. Ad-HS group; LLC: Lewis lung cancer.
3.2 重组Survivin腺病毒在体内抑制LLC细胞生长
建立小鼠皮下LLC移植瘤模型,当肿瘤长至3~5mm时进行分组治疗,每周治疗一次,治疗剂量为1×109PFU/100uL,共治疗两次。各组取5只小鼠,每二天测量一次各组小鼠肿瘤二维直径,根据公式V=0.52×长×宽2计算肿瘤体积,结果以均数±标准差表示,绘制生长曲线。结果显示Ad-MS、Ad-HS组肿瘤体积与NS组、Ad-null比较明显减小,差异有统计学意义(P<0.05)。Ad-HS组小鼠肿瘤体积小于Ad-MS,但两组之间差异无统计学意义。各组取10只小鼠,记录各组小鼠的生存时间,绘制生存曲线。结果显示Ad-MS、Ad-HS组小鼠生存时间明显长于NS组、Ad-null组,差异有统计学意义(Plt;0.05)。Ad-HS组小鼠生存时间长于Ad-MS,但两组之间差异无统计学意义(P<0.05)(图4)。
3.3 Ad-HS诱发的免疫反应
治疗2周后,每组小鼠取2只小鼠进行Cr51释放实验,检测各组小鼠脾脏淋巴细胞对LLC肿瘤细胞的杀伤作用。各组小鼠的CTL活性以细胞特异性裂解率表示(图5)结果证实Ad-HS病毒治疗组在不同效靶比情况下,与NS组、Ad-null、Ad-MS比较,细胞特异性裂解率均明显增高,差异有统计学意义(P<0.05),结果以均数±标准差表示。表明经Ad-HS治疗后的小鼠产生了针对表达Survivin蛋白的LLC细胞的特异杀伤活性,并呈现一定的量效关系。
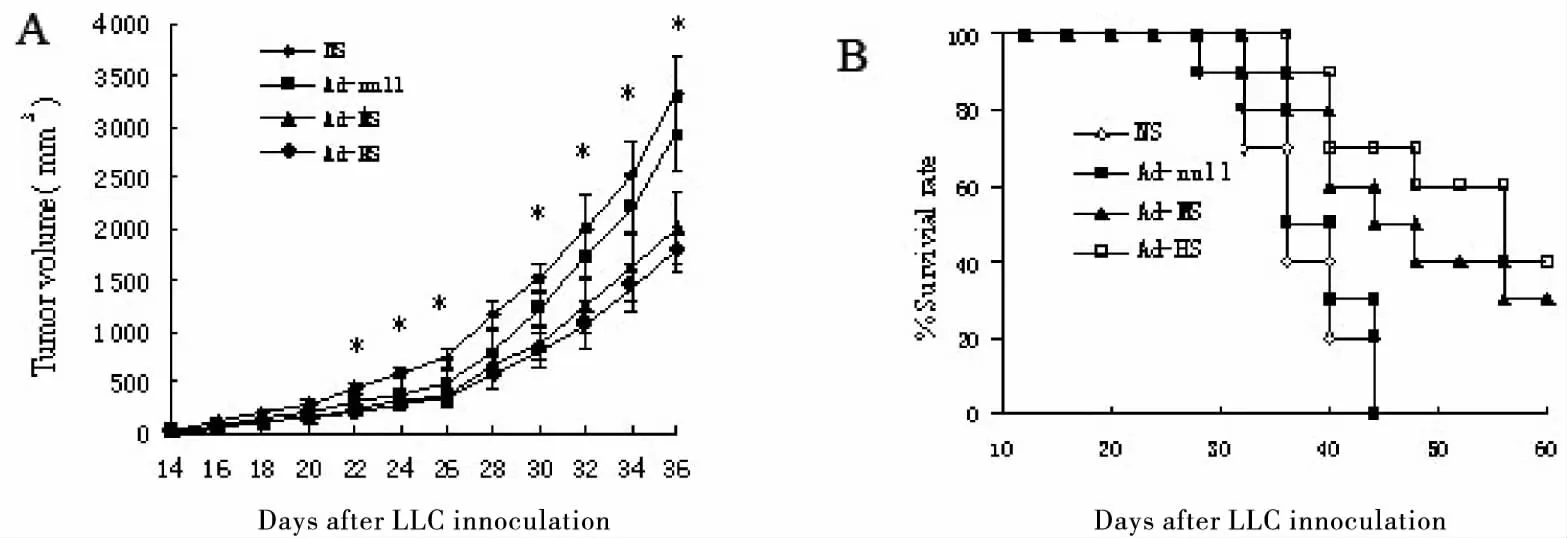
图4 重组腺病毒治疗C57BL/6小鼠LLC皮下移植瘤模型
Figure4.RecombinantAdenovirusintheTreatmentofC57BL/6MicewithLLCCellsUsingtheMiceSubcutaneousTumorCellTransplantationModel
A. Tumor volume; B. Survival rate; LLC: Lewis lung cancer.
3.4 血清抗体检测
治疗2周后,眼球取血处死小鼠,收集血清后,使用LLC、4T1细胞中提取的总蛋白通过western blot检测各组血清有无抗Survivin抗体产生,结果如图6。在Ad-MS、Ad-HS组重组腺病毒治疗后小鼠体内产生了针对Survivin的特异性抗体。而NS组、Ad-null组未检测到相应抗体产生。图6中A、C、E条带使用LLC细胞提取蛋白为底物,B、D、F条带使用4T1细胞中提取的蛋白为底物。使用4T1细胞中提取的蛋白进行抗体的验证,证明LLC动物模型中Ad-MS、Ad-HS组产生的抗体为Survivin特异性,而不是只针对LLC细胞内蛋白。
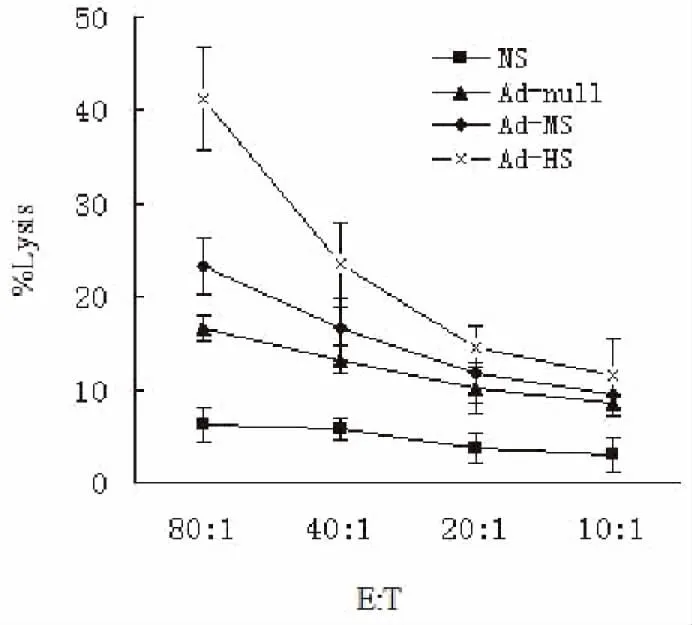
图5 Ad-HS治疗后诱发的CTL杀伤活性检测
Figure5.DetectionofCTLKillingActivityInducedbyTreatmentinAd-HSGroup
CTL: Cytotoxic T lymphocyte.

图6 重组腺病毒诱导的体液免疫
Figure6.HumoralImmunityInducedbyRecombinantAdenovirus
Panel A and B indicate serum in Ad-MS Group; Panel C and D indicate serum in Ad-HS Group; Panel E and F indicate serum in Ad-null Group.
3.5 肿瘤组织内的微血管免疫组化染色
各组小鼠处死后,取肿瘤组织进行石蜡切片,进行CD31免疫组化染色。血管呈现棕黄色者为阳性;无着色者为阴性。如图7所示,Ad-MS、Ad-HS病毒治疗组相比,肿瘤内微血管密度明显低于Ad-null组和NS组,全面观察每一张切片,随机选择血管密度最高的5个高倍视野(×400),计算每个高倍视野的微血管数量,每组各计数5个高倍镜视野,NS组、Ad-null、Ad-MS、Ad-HS高倍镜视野平均微血管密度分别是55.16±4.15、42.17±4.51、19±3.11、17.67±5.31,与对照组相比,实验组的微血管密度显著降低,差异有统计学意义(P<0.01)。

图7 各组肿瘤组织内微血管免疫组化观察(x400)
Figure7.ImmunohistochemicalStainingofMicrovesselsinTumorTissue(×400)
A.NS Group; B. Ad-null Group; C. Ad-MS Group; D. Ad-HS Group.
3.6 SurvivinT34A促凋亡作用检测
治疗结束后处死小鼠,取肿瘤组织固定,石蜡切片后进行原位荧光TUNEL显色检测各组肿瘤组织凋亡情况(图8)可以看到,图中荧光激发后显示为绿色的为凋亡细胞,Ad-MS、Ad-HS组小鼠肿瘤细胞凋亡细胞明显多于NS组、Ad-null组,凋亡率明显增加。Ad-MS、Ad-HS组两组之间凋亡率无明显差别。

图8 各组肿瘤组织内原位荧光TUNEL显色观察
Figure8.TumorTissueinEachGroupObservedbyTUNELAssay
A. NS Group; B. Ad-null Group; C. Ad-MS Group; D. Ad-HS Group; TUNEL: Terminal deoxynucleotidyl transferase dUTP nick end labeling.
4 讨 论
Survivin被认为是肿瘤的一个重要节点蛋白,在肿瘤发生发展中发挥重要作用。首先,Survivin属于结构独特的细胞凋亡抑制蛋白家族,在多个亚细胞器中表达并且受多种转录后机制的动态调控。其次,Survivin是一种重要的细胞分裂调控蛋白,调控细胞的凋亡和非凋亡性细胞死亡,并且在不利的生存环境下作为弹性反应因素保证细胞持续分裂和存活。遗传学者认为Survivin是保证器官和组织的稳态的重要开关,保持多个组织的生存和增殖活性。第三,Survivin是肿瘤特异分子之一,能抑制凋亡,促进肿瘤相关的血管生成,并且是多种肿瘤治疗方法的拮抗因素。最后,Survivin是肿瘤研究的重要分子,是多种肿瘤预后不良的重要分子标志,也是肿瘤发生和复发的诊断标志,并且是肿瘤新药的一个有效靶点[10]。从肿瘤治疗的角度来看,Survivin在肿瘤发生发展中起着非常重要的作用,因此通过抑制与拮抗Survivin的表达与活性,来抑制肿瘤生长的基因治疗一直是近年来研究的热点。
基于Survivin在肿瘤组织的表达特异性,以Survivin为靶点的免疫治疗具有广阔发展前景。Pisarev等[18]报道了全长Survivin T34A在肿瘤免疫治疗中的作用,使用重组Survivin T34A腺病毒感染DC细胞能够识别和杀伤肿瘤细胞。因此,我们设计此实验方案,充分发挥Survivin T34A既能诱导肿瘤细胞凋亡和抑制肿瘤血管生成,又能有效引起针对肿瘤的特异性免疫反应的作用,达到最大程度杀伤肿瘤细胞,抑制肿瘤生长的目的。但是目前关于Survivin的免疫研究中,大多是利用感染DC细胞呈递特异性抗原,或者利用能够引起强烈免疫反应的Survivin特异性肽段,以及联合应用免疫佐剂等方法来实现,鲜有直接利用Survivin基因或蛋白诱导特异性抗肿瘤免疫的实验报道。有报道用异种Survivin冲击DC细胞治疗小鼠胶质瘤比用野生型DC具有更好的抗肿瘤效果。因此,我们采用异种的SurvivinT34A重组腺病毒异种同源基因在进化过程中所形成的细微差别来打破免疫耐受、增强免疫原性,达到更好的治疗效果。
在本实验室的前期可行性分析中,我们比较了人Survivin与小鼠Survivin的同源性差异,发现两者氨基酸序列具有83%的同源性,保证了我们实验方案的可行性和科学性。因此,我们构建了重组Ad-MS、Ad-HS腺病毒,病毒包装完成后采用有限稀释法建立了具有高度复制感染能力的单克隆病毒种子库,感染肿瘤细胞后鉴定出Survivin蛋白的高表达,为后续的重组腺病毒大批量的扩增生产打下基础。在纯化过程中我们使用核酸酶消化病毒裂解过程中可能存在的基因组DNA, 进行氯化铯不连续密度梯度离心和连续密度梯度离心后,经过检验得到高纯度和滴度的重组病毒,为后续实验的进行打下了良好的基础。
在体外实验中我们使用重组Ad-MS、Ad-HS腺病毒在相同的MOI情况下感染LLC肿瘤细胞,采用不同方法检测细胞凋亡情况,证明重组Ad-HS腺病毒也可以引起鼠LLC肿瘤细胞的凋亡,并且致凋亡率与重组Ad-MS病毒无显著性差别。体内实验中我们将各组肿瘤组织标本切片,进行TUNEL染色检测组织中肿瘤细胞的凋亡情况,结果显示与对照组相比重组Ad-MS、Ad-HS腺病毒均能引起明显的细胞凋亡,两组细胞之间的凋亡率无明显差别。组织标本进行CD31染色检测微血管的密度,结果显示与对照组相比重组Ad-MS、Ad-HS腺病毒均能引起肿瘤组织中微血管密度的显著减少,两组组织之间的微血管密度无明显差别。以上实验结果表明hSurvivin虽然与mSurvivin氨基酸序列有差异,但是由于Survivin功能区进化过程中的保守性,重组Ad-HS腺病毒能够达到与重组Ad-MS腺病毒大致相似的促进肿瘤细胞凋亡和抑制肿瘤血管生成的作用。
由于mSurvivin、hSurvivin氨基酸序列的高度同源性,hSurvivin既具备了在小鼠体内诱导免疫应答产生免疫原性,又提供了免疫应答产物交叉作用于小鼠自身Survivin的可能性。相对小鼠基因组而言,Ad-MS是同种,而Ad-HS则是异种。从某种意义上来看,我们甚至可以这样认为,hSurvivin就是一种自然存在的小鼠Survivin蛋白的改变形式因而有产生自身反应性免疫应答的可能。从实验结果来看,Cr51释放实验证明重组Ad-HS腺病毒治疗组小鼠产生了针对表达mSurvivin 蛋白的LLC肿瘤细胞的特异CTL杀伤活性,并呈现一定的量效关系。我们收集各组小鼠的血清进行western blot检测结果显示重组Ad-MS、Ad-HS腺病毒治疗组小鼠均可产生针对mSurvivin 蛋白的抗体。这些结果均证明使用异种Survivin进行免疫治疗能够产生特异性的交叉反应,诱导了细胞免疫反应,能够打破体对自身Survivin蛋白的免疫耐受,从而发挥抗肿瘤作用。
综上所述,我们使用重组Ad-HS腺病毒治疗小鼠,能够产生针对LLC肺癌细胞的特异性细胞免疫、促肿瘤细胞凋亡、抑制肿瘤血管生成三方面的作用,因此能够延缓肿瘤的生长,延长小鼠的生存时间。虽然与重组Ad-MS腺病毒治疗组小鼠比较差异无统计学意义,但是治疗效果仍稍好于重组Ad-MS腺病毒治疗组,值得进一步探讨。虽然我们的研究仍有待进一步的完善以及进行更多肿瘤模型的验证,但是我们的实验开创了针对肿瘤节点蛋白-Survivin的新的靶向基因治疗的方法,在小鼠动物模型中取得一定的治疗效果,为后续实验提供了理论与实验基础。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
