植物内生菌G-1菌株的鉴定及其拮抗物质的初步研究
2020-03-04郭洁心马超朱洪磊张宝俊
郭洁心,马超,朱洪磊,张宝俊
(山西农业大学 农学院,山西 太谷 030801)
芽孢杆菌具有抗逆能力强、抑菌活性高、促进植物生长等特性,是植物病害微生物防治的首选资源。拮抗芽孢杆菌在生长代谢过程中能够产生多类抗菌物质,主要包括由核糖体合成的细菌素[1](bacteriocin)或拮抗蛋白[2],由非核糖体合成的脂肽类抗生素[3](lipopeptides antibiotics)或挥发性物质[4]等。其中脂肽类抗菌物质是由非核糖体途径合成的一种小分子物质,因具有抑菌广谱及较好的热稳定性、酸碱稳定性、紫外辐射稳定性被广泛研究。目前已报道的芽孢杆菌脂肽类抗菌物质主要有伊枯草菌素(Iturin A、C和杆菌抗霉素L、D、F等)、表面活性素(Surfactin A、B、C)和丰原素(Fengycin A、B、D和制磷脂菌素)[5~7]等。杨瑞先等[8]研究发现牡丹内生解淀粉芽孢杆菌Md31和Md33产生的脂肽类抗菌物质对牡丹灰霉病菌、牡丹炭疽病菌、牡丹黑斑病菌和牡丹黄斑病菌具有良好抑菌效果。
G-1菌株为从丁香树茎部分离获得1株植物内生细菌,对番茄灰霉病菌、番茄早疫病菌、立枯丝核病菌等多种植物病原真菌具有较好的拮抗作用。本研究拟通过形态学观测及多基因联合分析初步明确G-1菌株种属分类,并通过对其抗菌粗提物的稳定性及脂肽类抗生素编码基因簇分析,探究该菌株代谢物中抗菌物质的主要类型,为后续生防菌制剂的研发奠定基础和数据支撑。
1 材料和方法
1.1 供试材料
内生拮抗菌G-1菌株分离自山西农业大学校园内丁香树茎部,由山西省植物内生菌服务共享平台保藏并提供。病原菌:番茄灰霉病菌(Botrytiscirerea)、桃褐腐病菌(Moniliniafructicola)、番茄早疫病菌(Alternariasolani)、胡萝卜腐烂病菌(Ceratocystisfimbriata)、菜豆菌核病菌(Sclerotiniasclerotiorum)、辣椒枯萎病菌(Fusariumoxysporumf. sp.vasinfectum)、番茄枯萎病菌(Fusariumoxysporumf. sp.lycopersic)、棉花立枯病菌(Rhizoctoniasolani)和小麦赤霉病菌(Fusariumgraminearum)均系山西省绿色生物农药工程技术中心保存、提供。
PDA培养基:土豆200 g·L-1,葡萄糖20 g·L-1,琼脂16 g·L-1,pH 7.0;NA培养基:牛肉膏3 g·L-1,蛋白胨10 g·L-1,NaCl 5 g·L-1,琼脂16 g·L-1,pH 7.0;BPY培养液:蛋白胨10 g·L-1,牛肉浸膏5 g·L-1,酵母粉5 g·L-1,葡萄糖5 g·L-1,NaCl 5 g·L-1,pH 7.0。
1.2 G-1菌株抑菌谱测定
采用平板对峙法,培养9种植物病原菌,在培养的菌落上打取直径为5 mm的菌饼,分别接种于PDA平板中央,在距菌饼2 cm处取2点接种G-1,28 ℃恒温培养5 d后,测定病原菌菌落直径,计算抑菌率,以只接病原真菌为对照(CK),3次重复。
抑菌率/%=(对照组菌落直径-处理组菌落直径)/(对照组菌落直径-5 mm)×100
1.3 G-1菌株分类地位鉴定
采用平板划线法,将拮抗菌株G-1接种于NA培养基上活化24 h后,对其单菌落形态进行观察,同时进行革兰氏染色,并利用扫描电子显微镜观察其形态特征。
采用CTAB法[9,10]提取G-1基因组DNA。以G-1基因组DNA为模板,分别以27F和1492 r、gyrA-F和gyrA-R、gyrB-F和gyrB-R为引物(表1),建立PCR扩增体系(25 μL):2×Taq PCR Master MiX 12.5 μL、Forward Primer 1 μL、Reverse Primer 1 μL、DNA模板1 μL、ddH2O 9.5 μL。扩增程序为95 ℃预变性5 min,94 ℃变性40 s,54~56 ℃退火40 s,72 ℃延伸1 min,30个循环,72 ℃延伸10 min,10 ℃保存。扩增产物经1%的琼脂糖凝胶电泳检测后送于生工生物工程(上海)股份有限公司测序。
将获得的16SrDNA、gyrA、gyrB测序结果在NCBI上进行BLAST比对分析,从GenBank数据库中下载近似种的基因序列,利用MEGA5.05软件进行多重序列比对后,采用Neighbor-Joining构建系统发育树,确定植物内生菌G-1的分类地位。

表1 引物序列Table 1 Primer sequence
1.4 G-1代谢物部分物理性质测定
采用“酸沉醇提”的方法,从G-1菌株BPY发酵液中获得抗菌粗提物,抗菌粗提物用无菌水配制成10 g·L-1的抗菌粗提液,-20 ℃保存备用。
热稳定性测定:分别于40、60、80、100、121 ℃条件下处理抗菌物质30 min,采用生长速率法,以番茄灰霉病菌为指示菌测定抑菌活性,分析抗菌物质的热稳定性。
抑菌率/%=(对照组菌落直径-处理组菌落直径)/(对照组菌落直径-5 mm)×100
酸碱稳定性测定:分别用1 moL·L-1HCL和1 moL·L-1NaOH将抗菌粗提液分别调为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0。室温放置3 h后,再依次调节pH至7.0,采用生长速率法测定抗菌物质的酸碱稳定性。
紫外辐射稳定性测定:将抗菌粗提液于紫外灯15 cm处分别照射2、4、6、8、10、12、24 h,采用生长速率法测定抗菌物质对紫外辐射的稳定性。
1.5 抗菌肽物质PCR验证
根据调控Iturin A、Fengycin A和Surfactin合成的基因分别设计合成3对特异引物ituA、fenA和srfC,并以菌株G-1基因组DNA为模板,建立PCR扩增体系,2%琼脂糖凝胶电泳检测后,送交生工生物工程(上海)股份有限公司测序(表2)。
2 结果与分析
2.1 内生菌G-1菌株抗真菌谱
平板抑菌试验表明,G-1菌株对多种植物病原菌都具有较强的抑菌活性(图1),抑菌率在69.1%~83.14%之间(表3)。其中,对番茄灰霉病菌、桃褐腐病菌抑菌效果最好,抑菌率分别为83.14%和81.65%;对灰葡萄孢菌、链格孢菌等有较好的抑制效果,但对棉花立枯病菌、小麦赤霉病菌的抑制率为70.78%和69.1%,抑制效果相对较差。

表2 抗菌肽调控基因的引物序列

表3 G-1菌株对9种病原真菌的抑制作用

1~9分别为菜豆菌核病菌、番茄枯萎病菌、番茄灰霉病菌、番茄早疫病菌、桃褐腐病菌、辣椒枯萎病菌、胡萝卜腐烂病菌、棉花立枯病菌、小麦赤霉病菌1~9 respect Sclerotinia sclerotiorum、Fusarium oxysporum f. sp.Lycopersic、Botrytis cirerea、Alternaria solani、Monilinia fructicola、Ceratocystisfimbriata、Fusarium oxysporum f. sp. vasinfectum、Rhizoctonia solani、Fusarium graminearum图1 G-1菌株抑菌图谱Fig.1 The antifungal map of the G-1 strain against pathogenic fungi
2.2 植物内生菌G-1分类地位
2.2.1 形态特征
通过对菌株G-1培养特征的形态观察,发现G-1菌株菌落在NA培养基上呈现乳白色,表面较干燥、菌落中心凸起褶皱,边缘为锯齿状(图2A)。
光学及电子显微观测表明,菌株G-1为杆状,大小约20.5~20.6 μm×2.0~2.4 μm,芽孢椭圆形,革兰氏染色为阳性,初步确定其为芽孢杆菌(图2)。
2.2.2 多基因联合分析
PCR扩增结果如图3所示,琼脂糖凝胶电泳检测表明,每对引物所扩增条带单一,与预期片段相符,长度分别约在1500、600、280 bp左右,表明引物的特异性良好,PCR产物质量较高。

A:G-1菌落形态B:染色前芽孢形态 C:染色后芽孢形态 D:G-1扫描电镜图A: Colony morphology of G-1 B: predyed spore morphology C: postdyed spore morphology D: G-1 scanning electron microscopy图2 菌株G-1形态观察及扫描电镜观察Fig.2 Morphology observation and electron microscopy of strain G-1
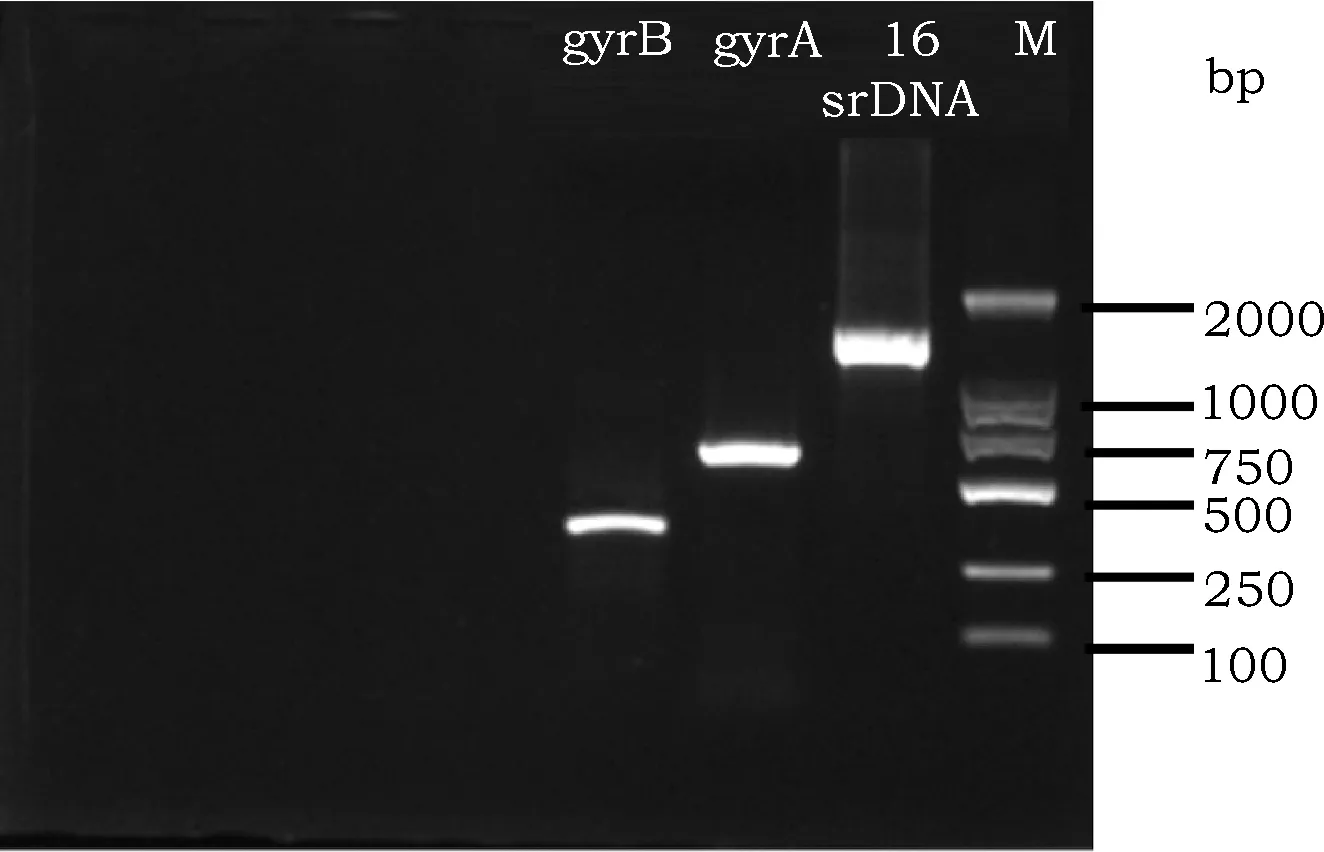
图3 菌株G-1 16SrDNA、gyrA、gyrB扩增产物电泳结果Fig.3 Electrophoresis of the genome of 16SrDNA、gyrA and gyrB by PCR products of strain G-1
将获得的16SrDNA、gyrA和gyrB序列分别与NCBI GenBank数据库中芽孢杆菌属及其相近种的16SrDNA、gyrA和gyrB序列Blast比对后,发现与Bacillusamyloliquefaciens、Bacillusmethylotrophicus同源性最高,均可达到98%以上,以不同芽孢杆菌种的模式菌株为基础,采用Sequence Matrix软件,分别将不同芽孢杆菌种的细菌促旋酶、gyrA部分基因序列、gyrB部分基因序列及16SrDNA 基因序列串联,构建数据集,同质性检验,采用MEGA5.0构建系统发育树,结果表明:菌株G-1与枯草芽孢杆菌群的多个物种的同源性均高于90%以上,其中与Bacillusmethylotrophicu(KT920452.1)的同源性最高(图4),二者聚为一类。因此,结合形态学、16SrDNA基因序列分析结果,初步将G-1菌株的分类地位鉴定为甲基营养型芽孢杆菌(Bacillusmethylotrophicus)。
2.3 内生菌G-1抗菌物质的物理性质
G-1抗菌物质的热稳定性如图5A所示,抗菌物质经不同温度处理后,随着温度的升高,抑菌活性逐渐降低的趋势,在121 ℃处理30 min后对番茄灰霉病菌仍保持81.76%的抑菌效率,与对照(25 ℃)的抑菌活性94.3%相比,仍保持86.7%的活性,表明菌株G-1产生的主要抗菌物质热稳定较好。
在pH 2~12处理条件下,G-1菌株均有较好的抑菌活性,其对番茄灰霉病菌的抑菌活性在81.37%~93.81%之间。在强酸、强碱条件下,抑菌活性有所下降,在pH为12处理后,依然保持81.37%的抑菌活性(图5B),与对照相比下降13.26%。
菌株G-1经过不同时间紫外辐射后其抑菌活性较稳定,下降幅度较小,即使紫外照射24 h后,其抑菌活性仍然能达到85.68%(图5C)、表明菌株G-1抗菌物质具有较好的抗紫外辐射的能力。
2.4 抗菌脂肽调控基因的PCR分析
扩增结果如图6所示:所扩增得到目的片段单一、条带清晰,扩增片段与预期片段相符,扩增结果进一步表明,菌株G-1具有分泌代谢ituA、fenA和srfC的能力。因此表明甲基营养型芽孢杆菌G-1主要抗菌物质为抗菌脂肽。
3 讨论与结论
枯草芽孢杆菌菌群是一类表型相似产芽孢的革兰氏阳性菌,现已报道的有10多个近缘种,其16SrDNA序列相似度可达99%以上,因此芽孢杆菌的分子鉴定中须结合其保守的功能基因如gyrA、rpoB、purH、polC、groEL等才能明确到种[11]。Yu G H等[12]利用16S rDNA结合gyrA和gyrB基因将生防芽孢杆菌R31快速鉴定为枯草芽孢杆菌。Yuji Kubo等[13]结合rpoB、purH、gyrA、groEL等基因进行多位点核苷酸序列系统发育分析,成功鉴定出多株枯草芽孢杆菌和解淀粉芽孢杆菌。本文利用形态观察、16SrDNA与gyrA、gyrB多基因联合分析将该菌株的分类地位初步鉴定为甲基营养型芽孢杆菌。

图4 基于16SrDNA、gyrA和gyrB基因数据集构建的G-1系统发育树Fig.4 The phylogenetic trees based on datasets of the concatenated sequences of 16SrDNA,gyrA,and gyrB genes
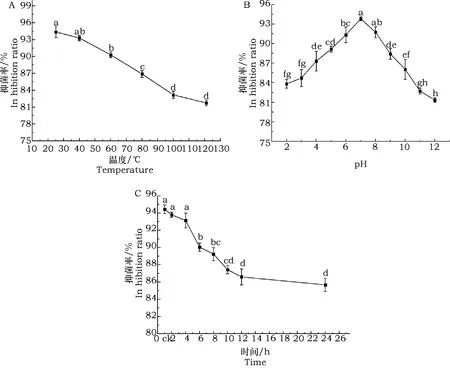
图5 G-1菌株抗菌物质部分理化性质Fig.5 Inhibitory activity of crude extract of G-1 responding to different environmental condition

图6 菌株G-1 ituA、FenA和srfC扩增产物电泳结果Fig.6 Electrophoresis of the genome of ituA,FenA and srfC by PCR products of strain G-1
同时,针对芽孢杆菌几种代表性脂肽的合成酶基因设计特异性引物进行PCR扩增,推测G-1菌株生物合成抗菌物质的潜在类型。特异引物扩增分析表明,G-1菌株具有分泌代谢ituA、fenA和srfC的能力,这与曲晓旭[14]芽孢杆菌产抗菌脂肽调控基因的检测方法相似。脂肽类抗菌物质普遍具有较好的热稳定和抗酸碱和紫外辐照能力。黄华毅等[15]试验表明枯草芽孢杆菌STO-12的脂肽类物质在高温处理、强酸强碱处理及紫外线处理下,其抑菌活性保持一定的稳定性。洒荣波[16]从杨树内生拮抗菌N6-34中分离纯化出一种活性组分Fengycin,其对温度、酸性、紫外线照射、水解蛋白酶等条件稳定。本试验测定结果表明,G-1菌株不但抑菌活性高,抗菌谱广,而且其抗菌物质的稳定性也较好,表明菌株G-1为1株具有开发潜力的拮抗菌株。后续可对其不同脂肽类抗菌物质进行抑菌活性测定,进而明确哪一类脂肽类物质起主要抑菌作用,为拮抗菌的快速筛选及生防菌制剂的研发奠定基础和数据支撑。
