奶牛孕酮浓度电化学检测方法
2020-03-04杨政聂建华刘振宇王阵贺路志明
杨政,聂建华,刘振宇,王阵贺,路志明
(1.山西农业大学 工学院,山西 太谷 030801;2.吕梁市兴县农业农村局,山西 兴县 033600;3.山西农业大学 信息科学与工程学院,山西 太谷 030801)
在奶牛养殖过程中,高效准确的预测及诊断奶牛是否处于妊娠或发情状态,对奶牛的健康养殖具有重大意义[1,2]。研究发现,奶牛在繁殖过程的不同阶段,体内分泌的孕酮含量会发生改变,进而会对生理活动造成影响[3]。因此,有效检测孕酮含量可以准确的判断出奶牛的生理健康状况。
孕酮是由卵巢中的黄体细胞所分泌的一种激素,是一种小分子的环状碳水化合物[4]。在奶牛体内,孕酮的含量极少且分泌时间不确定,这对孕酮浓度的检测造成了不便。目前,孕酮浓度的检测方法主要有胶体金技术[5]、酶联免疫法[6]和放射免疫法等[7]。但是,这些方法存在灵敏度低、操作复杂和应用推广受限等缺点。因此,本文采用一种操作简单,灵敏度高的电化学检测方法对孕酮浓度进行了检测[8]。该方法主要是通过制备电化学免疫传感器,将抗原或抗体固定在电极表面,使其发生化学反应,并建立一种浓度信号与电信号之间的转换关系,实现对物质浓度的检测[9]。
近年来,国内外对孕酮浓度的检测技术及方法进行了研究与优化分析,U. Eletxigerra等[10]研究了一种检测孕酮受体的电化学磁免疫传感器,并对丝网印刷碳电极进行了安培检测;Gevaerd A等[11]利用氧化石墨烯作为人工酶活性位点,对黄体酮进行了伏安测定,并用电子扫描显微镜观察了氧化石墨烯修饰后的电极表面形态,采用循环伏安法对其进行了电化学分析;D Samsonova J V等[12]研究了一种快速测定全乳孕酮含量的侧流酶免疫分析方法;张俊等[13]研究了一种高效液相色谱-质谱/质谱的孕酮检测方法,并对其进行了优化分析;吴凌等[14]研究了一种新的奶牛乳汁孕酮ELISA试剂盒,并对其灵敏性和稳定性等性能进行了优化分析;钱伟东等[15]对检测奶牛乳汁的孕酮免疫生物传感器进行了优化分析,进一步提高了孕酮检测的精确度和灵敏度。由于上述检测方法操作复杂,会导致检测结果出现较大误差。因此,建立一种灵敏度高、误差小和操作简单的奶牛孕酮浓度检测方法成为了研究关键。
本文在上述研究的基础上,以电化学分析方法为基础,首先对裸丝网印刷金电极进行活化预处理和修饰,然后用蛋白A将孕酮单克隆抗体固定在电极表面,并用交流阻抗法进行表征,最后通过分析不同浓度孕酮抗体与抗原反应得到的数据,建立孕酮抗原浓度与电学阻抗之间的关系模型,实现孕酮浓度的检测。
1 材料与方法
1.1 试剂与材料
主要仪器设备:BS224S电子分析天平(德国Sartorius公司);Interface1000电化学工作站(美国Gamry公司);MilliQ超纯水系统(美国Millipore公司);220 AT丝网印刷金电极(西班牙Dropsens公司);SUPRA 55电镜扫描仪(德国Zeiss公司);PHS-3C PH酸度计(上海雷磁仪器厂);20 μL、100 μL移液枪各一支(芬兰Dragon公司)。
主要药品:0.5 mol·L-1浓硫酸,铁氰化钾、亚铁氰化钾、氯化钾(上海紫一试剂厂);金黄色葡萄球菌A蛋白(美国Sigma-Aldrich公司);超纯水(18.2 MΩ·cm);孕酮单克隆抗体(美国Sigma公司)。
1.2 试验方法
循环伏安法[16,17]是通过控制电极电势以不同速率的三角波形进行一次或多次反复扫描,该扫描过程会得到电活性物质氧化和还原反应的电流-电压曲线。根据曲线的形状变化,可对氧化还原反应的可逆程度进行分析,判断反应物的化学活性。该方法适用于金、铂、玻璃碳电极以及化学修饰电极等,是一种研究电化学体系的重要方法。
交流阻抗法[18,19]主要是将电化学系统控制在小幅度的工作条件下,使电极的电流或电势按正弦波规律变化,同时对系统的交流阻抗(或导纳)进行检测和计算,得到相对应的交流阻抗谱,实现对电化学系统中的参数计算,并对反应机理进行系统分析。此方法可对电极工作过程进行准确的计算分析,广泛应用于电化学的研究领域中。
1.3 丝网印刷金电极预处理
本试验所用丝网印刷金电极如图1所示,主要由对电极、工作电极和参比电极组成,工作电极与其它2个电极所形成的回路,可以准确的反映出化学反应与电信号之间的转换关系[20]。电极预处理需要确保电极在不被损坏的情况下,将其置于0.5 mol·L-1的硫酸溶液中,采用循环伏安法进行扫描,控制扫描电压范围在-0.1~0.5 V之间,以10 mV·s-1的扫描速率扫描10次[21]。
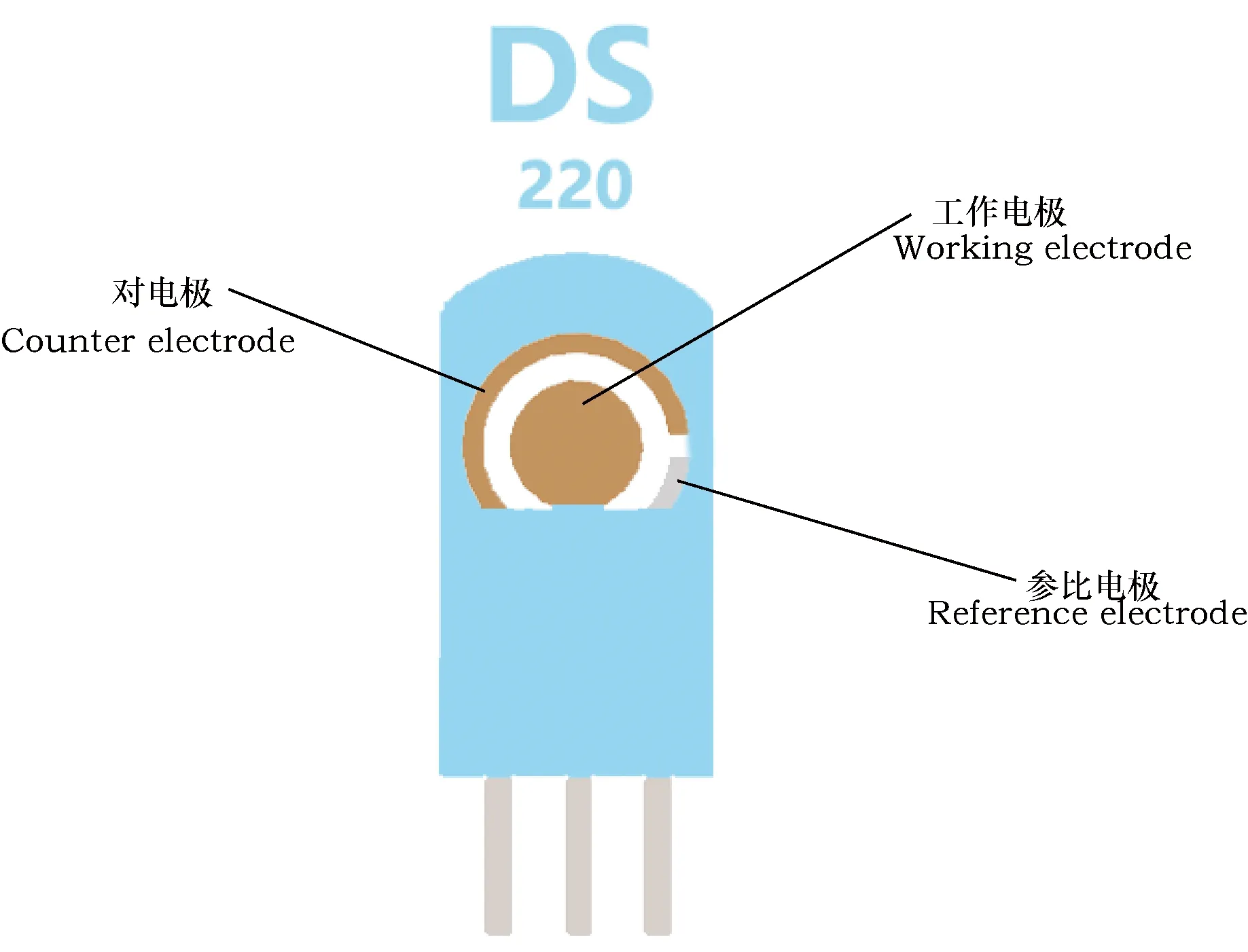
图1 丝网印刷金电极结构示意图Fig.1 Structural sketch of screen-printed gold electrode
1.4 电极制备
将30 μL的0.1 g·mL-1蛋白A溶液均匀涂抹于工作电极表面,在密闭潮湿的室温条件下静置1 h后用去离子水清洗干净。然后将30 μL的8 mg·L-1孕酮单克隆抗体滴加于蛋白A吸附的丝网印刷金电极表面,在密闭潮湿的室温条件下静置45 min后清洗干净。
1.5 奶牛孕酮浓度测定
首先将20 μL孕酮单克隆抗体均匀涂抹于工作电极表面,在密闭潮湿的室温条件下静置1 h后用去离子水和PBS清洗干净,并将其工作电极置于电镜扫描仪中,设置电镜扫描仪的加速电压为20 kV,放大1 000倍后,对工作电极表面的结合物进行观察分析;然后将20 μL的2 mg·L-1孕酮酶标抗原均匀滴加于工作电极表面,在密闭潮湿的室温条件下静置45 min后清洗干净;最后在电解液溶液中测量阻抗。
2 结果与分析
2.1 电极活化前后对比
电极预处理后,其电化学活性会发生改变,对其进行循环伏安法扫描得到的曲线和数据分别如图2和表1所示。
由图2与表1可知,预处理后的电极,法拉第电流增大,充电电流减少。其氧化峰Ipa增大,还原峰Ipc减小,电位差ΔEp减小,氧化峰与还原峰电流比值的绝对值|Ipa/Ipc|更接近于1。说明预处理会使电子转移能力增强,导电性增加,提高了反应的可逆性。

图2 电极活化前后的电极循环伏安曲线Fig.2 The electrode cyclic voltammetry curve before and after electrode activation
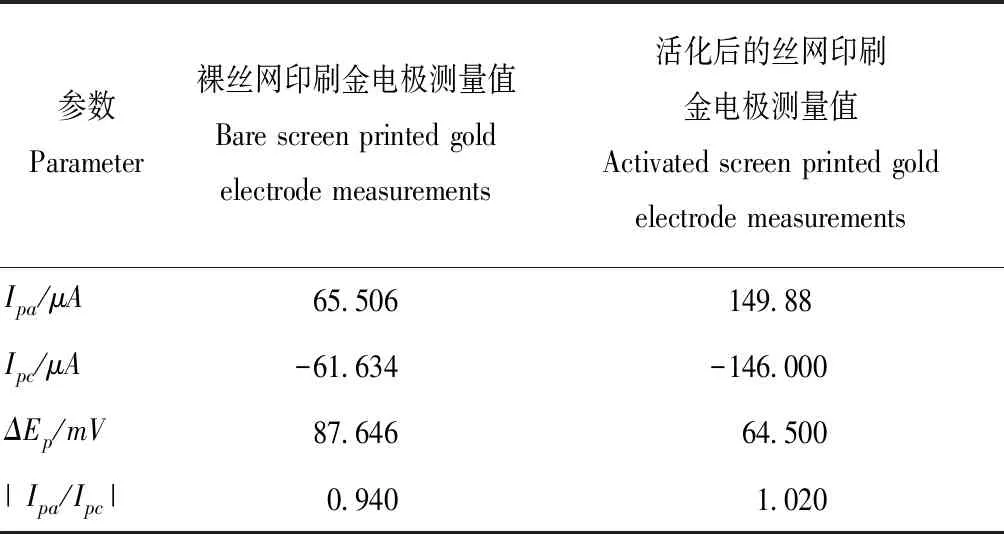
表1 电极表征参数对比
2.2 蛋白A固定孕酮单克隆抗体
为了保证试验的准确和稳定,需要对抗体固定条件进行探讨。本试验采用葡萄球菌A蛋白对预处理后的电极进行修饰,得到的电镜扫描结果(图3)。
由图3可知,经蛋白A修饰后的工作电极,表面间隙明显减少,颗粒面积增大且数量增多,说明蛋白A在电极表面的附着效果良好。用蛋白A修饰后,将电极置于电解液中,并用交流阻抗法进行表征,得到蛋白A固定前后的电极阻抗谱图(图4)。蛋白A修饰前后的曲线在初始阶段基本处于重合状态,说明两者使用的电解液溶液相同,反应较稳定;而曲线的后面部分则发生了显著变化,蛋白A修饰后的曲线半径明显增大,说明其电极阻抗值增加,进而表明了蛋白A与电极表面的结合会降低电子转移速率。将试验得到的阻抗数据用Zsimpwin软件拟合出相应的阻抗Nyquist曲线,如图5所示,具体参数如表2和表3所示。图(a)为用Zsimpwin拟合的阻抗曲线,图(b)为采用电路形式为R(C(RW))时的等效电路图。根据拟合结果可知,卡方值Chisq为0.001 284,表明实测值和拟合值之间偏差程度小,拟合效果好;迭代次数Iter为2,表明等效电路在较少的迭代次数下就能实现等效,符合实际要求,有较高的可靠性。由表2和表3可知,电解液阻抗值R1由13.71 ohm·cm2变为14.2 ohm·cm2,变化范围较小,表明电极表面发生的化学反应没有引起电解液电阻的改变;电极极化阻抗R2由1.835 ohm·cm2变为31.53 ohm·cm2,该数值增加幅度大,进一步表明蛋白A修饰过的电极表面会结合形成一层膜性物质,增大阻抗,减小电子的转移速度。因此,选用蛋白A修饰的丝网印刷金电极,符合试验设计要求,对固定孕酮单克隆抗体发挥了巨大作用,提高了试验稳定性。

图3 工作电极的扫描电镜图Fig.3 Scanning electron microscope working electrode
2.3 蛋白A固定孕酮单克隆抗体与孕酮抗原反应试验
将孕酮单克隆抗体固定在蛋白A修饰的丝网印刷金电极上,然后用电镜扫描仪进行扫描(图6)。当电极表面固定孕酮单克隆抗体后,其表面的颗粒状物质比蛋白A修饰后的多且间隙较少,符合试验要求。由于蛋白A与孕酮单克隆抗体反应得到的主要物质成分为蛋白质,这将增加电极表面的阻抗值,因此在实际检测中,可以根据阻抗值的变化来确定抗体的浓度。

图4 蛋白A修饰前后阻抗谱Fig.4 Impedance spectra before and after protein A modification

图5 拟合阻抗Nyquist曲线和等效电路Fig.5 Fitting impedance Nyquist curve and equivalent circuit

表2 蛋白A固定前的各元件参数
将0、1、2、4、8 mg·L-1的孕酮单克隆抗体,分别固定于蛋白A修饰后的丝网印刷金电极上,将电极放入电解液溶液中,选择频率为0.1~100 000 Hz之间,进行交流阻抗法测试,得到的阻抗谱(图7)。图7中的反应过程分为反应动力学和扩散2个过程,高频区是由电化学动力学控制引起的,检测到的阻抗值主要为双电层的容抗弧[22]。通过分析高频区曲线的变化规律可以得出:阻抗值随着孕酮单克隆抗体浓度的增大而增大,当浓度为0 mg·L-1时,得到的阻抗值最小;当浓度为1、2、4 mg·L-1时,图中的曲线半径相差不大,说明这些浓度的阻抗值比较接近;当浓度为8 ng·mL-1时,此时得到的阻抗值最大。由于阻抗值越大,整体反应也越充分,可以促进蛋白质与电极表面的有效结合。而在低频区检测到的值主要为Warburg阻抗,该值的出现主要是由扩散现象引起的,因此可以利用扩散阻抗求出扩散系数。

表3 蛋白A固定后的各元件参数

图6 蛋白A修饰后和固定孕酮单克隆抗体后的工作电极电镜扫描图Fig.6 Scanning electrode electron microscopy of protein a modified and immobilized progesterone monoclonal antibody
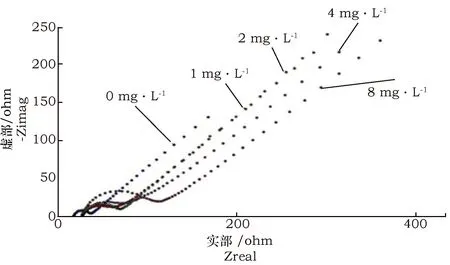
图7 不同浓度的单克隆抗体固定于蛋白A修饰电极后得到的阻抗谱Fig.7 Impedance spectra of monoclonal antibodies immobilized on protein a modified electrodes at different concentrations
通过以上分析可知,电极表面发生的化学反应主要集中在高频区,采用Zsimpwin软件对高频区中所得到的阻抗数据进行拟合分析。由拟合结果可知,当抗体浓度为0 mg·L-1时,阻抗值为16.31 ohm·cm2,误差为0.798%;抗体浓度为1 mg·L-1时,阻抗值为31.21 ohm·cm2,误差为2.371%;抗体浓度为2 mg·L-1时,阻抗值为35.21 ohm·cm2,误差为1.057%;抗体浓度为4 mg·L-1时,阻抗值为43.59 ohm·cm2,误差为3.224%;抗体浓度为8 mg·L-1时,阻抗值为74.72 ohm·cm2,误差为1.923%。利用SAS软件拟合阻抗值和固定孕酮抗体的浓度,得到的回归曲线(图8)。由图8可以得出,回归曲线为y=6.765 8x+19.911 ,R2=0.974 2,显著性检验概率P值为0.0018,表明孕酮单克隆抗体浓度范围在0~8 mg·L-1时,阻抗值与抗体浓度呈线性关系,具有较好相关性。该曲线可以较好的区分0、1、2、4、8 mg·L-15个浓度的单克隆抗体溶液,但是当抗体浓度大于8 mg·L-1时,其线性拟合曲线不是很理想,且基本与8 mg·L-1时的阻抗值相同,因此本试验选取抗体浓度为8 mg·L-1时来制作孕酮阻抗传感器。为了提高试验反应速率,需要确定孕酮单克隆抗体和孕酮之间的最优浓度比。因此,用浓度为2 mg·L-1孕酮抗原分别与浓度为0、1、2、4、8 mg·L-1的孕酮单克隆抗体进行反应,反应过程采用交流阻抗法进行表征分析。交流阻抗谱如图9所示。由图9可知,当抗体浓度不断增大时,曲线半径也在不断变大,进而表明抗体与孕酮反应时,其结合所产生的蛋白质等复合物的物质浓度会增加,使电子转移时受到的阻碍增大,转移速率降低。通过Zsimpwin拟合阻抗数据得到不同浓度的抗体阻抗值由高到低依次为:8 mg·L-1时为275.8 ohm·cm2、4 mg·L-1时为223.9 ohm·cm2、2 mg·L-1时为153.5 ohm·cm2、1 mg·L-1时为105.4 ohm·cm2和0 mg·L-1时为50.43 ohm·cm2,且误差分别为2.17%、1.864%、3.818%、2.888%和1.876%。用SAS软件将阻抗值与抗体浓度进行回归拟合,得到回归曲线(图10)。由图10可知,孕酮单克隆抗体浓度在0 ~ 8 mg·L-1范围时,随着抗体浓度的逐渐增大,其对应的阻抗值也在逐渐增大。得到的线性回归方程为y=27.183x+80.258,决定系数为R2=0.9093,显著性检验概率p值为0.0119,具有较好的相关性。但是当抗体浓度大于8 mg·L-1时,其线性拟合曲线不理想,因此,采用8 mg·L-1的孕酮单克隆抗体作为最优孕酮阻抗传感器的固定抗体浓度。

图8 阻抗值与单克隆抗体浓度的回归曲线Fig.8 Regression curve between impedance value and monoclonal antibody concentration

图9 2 mg·L-1孕酮与不同浓度的单克隆抗体反应得到的阻抗谱Fig.9 Impedance spectra of 2 mg·L-1 progesterone reaction with monoclonal antibodies of different concentrations
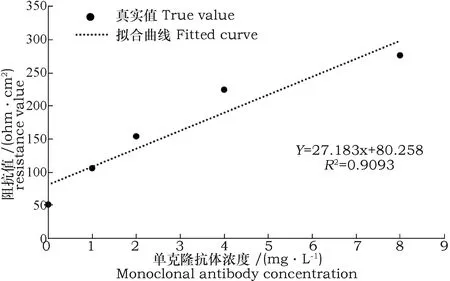
图10 孕酮单克隆抗体浓度和阻抗的回归曲线Fig.10 Regression curve of concentration and impedance of progesterone monoclonal antibody
3 讨论与结论
(1)预处理后的电极,法拉第电流增大,充电电流减少。其氧化峰Ipa增大,还原峰Ipc减小,电位差ΔEp减小,氧化还原电流比|Ipa/Ipc|更接近于1。说明预处理会使电子转移能力增强,有利于提高孕酮阻抗传感器的灵敏度。
(2)选用蛋白A修饰的丝网印刷金电极固定孕酮单克隆抗体后,将测得的阻抗数据用Zsimpwin进行拟合,得到的卡方检验值Chisq为0.001 284,等效电路迭代次数Iter为2,表明拟合效果好,可靠性高。其极化阻抗值为31.53 ohm·cm2,远远大于裸电极的极化阻抗值1.835 ohm·cm2,使电化学活性显著增强。
(3)由电镜扫描图分析可知,经蛋白A修饰后的工作电极,表面间隙减少,颗粒面积增大且数量增多,说明蛋白A在电极表面的附着效果良好。当电极表面固定孕酮单克隆抗体后,其表面的颗粒状物质比蛋白A修饰后的多且间隙较少,符合试验要求。
(4)孕酮单克隆抗体浓度x和阻抗y之间的回归曲线方程为y=27.183x+80.258,R2=0.909 3,显著性检验概率P值为0.011 9,呈现出良好的线性关系,并得出了最优孕酮阻抗传感器的固定单克隆抗体浓度8 mg·L-1。该检测方法灵敏度高,符合实际检测要求。
