伊立替康调控SNHG1/miR-195的表达抑制肝癌细胞增殖、迁移、侵袭的影响及机制研究
2020-03-03孙绪举干飞胡娟张继东
孙绪举 干飞 胡娟 张继东
肝癌是世界上第六大常见癌症,也是全球癌症死亡的第四大原因,据统计,每年约有841 000例新增病例和782 000例死亡病例,其中,全世界大多数地区的男性发病率和死亡率均高出2~3倍,使肝癌居于男性癌症相关死亡原因的第二位[1]。肝癌预后差,只有极少数的患者通过手术切除或肝移植治愈[2]。超过80%的患者因疾病晚期或肝功能不良而无法接受有效治疗[3]。因此,迫切需要寻找有效的药物或治疗方法来提高患者预后。伊立替康(Irinotecan,CPT-11)是临床用于治疗不可切除/复发性结直肠癌的关键抗癌药物[4]。既往研究发现,聚乙二醇微球负载伊立替康与动脉导向栓塞治疗在转移性肝癌中是有效的,并且导致轻微的毒性和良好的生活质量[5],伊立替康联合吉非替尼能够显著抑制肝癌细胞增殖和克隆形成能力,并诱导细胞凋亡,对肝癌起着抑制作用[6,7]。但伊立替康对肝癌生物行为影响的具体机制尚不清楚。因此,本研究以肝癌细胞HepG2为对象,考察伊立替康对细胞增殖、迁移和侵袭的影响,并结合长链非编码RNA SNHG1(Long noncoding RNA SNHG1,SNHG1)和微小RNA-195(microRNA-195,miR-195),旨在探索其可能的作用机制。
1 材料与方法
1.1 主要试剂 肝癌细胞HepG2购自美国ATCC细胞库,伊立替康购自华中科技大学医院,RPMI-1640培养基、胎牛血清购自美国Gibco公司,青链霉素、胰蛋白酶、MTT、RIPA裂解液购自美国Sigma公司,si- SNHG1、pcDNA3.1- SNHG1、miR-195、anti-miR-195购自武汉淼灵生物科技有限公司,Lipofectamine 2000、TRIzol购自美国Invitrogen公司, Transwell小室购自美国Corning公司,Matrigel基质胶购自美国BD公司,细胞周期蛋白D1(CyclinD1)、p21、E-钙粘蛋白(E-cadherin)、基质金属蛋白酶-2(Matrix metalloproteinase-2,MMP-2)、甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)蛋白抗体购自美国Cellular Signaling Technology公司,辣根过氧化物酶标记二抗购自北京中杉金桥生物技术有限公司,逆转录试剂盒、qPCR试剂盒购自美国ThermoFisher公司。
1.2 细胞培养与实验处理 肝癌细胞HepG2复苏后,加入含10%胎牛血清、100 U/ml青链霉素的RPMI-1640培养液,置于37℃恒温、5%CO2的培养箱内培养。2~3 d换1次液,待细胞生长至80%密度,加入胰蛋白酶消化,以1∶3~1∶2的比例接种传代。选取对数生长期的HepG2细胞,使用不同浓度16 ml/L、32 ml/L、64 ml/L的伊立替康处理,将正常培养的HepG2细胞设为对照组(Con组)。
1.3 细胞转染 细胞HepG2稀释为1×105个/ml的细胞悬液,接种于6孔板,培养至70%融合度时,按住Lipofectamine 2000试剂说明书的指示,将si- SNHG1、pcDNA3.1- SNHG1、miR-195、anti-miR-195及各自阴性对照转染入HepG2细胞,转染48 h。根据不同的实验目的,转染pcDNA3.1-SNHG1、anti-miR-195的细胞HepG2使用32 ml/L伊立替康进行处理。
1.4 MTT法检测HepG2细胞增殖 收集各组HepG2细胞,按照5×104个/ml的浓度接种于96孔板,分别连续培养24 h、48 h、72 h,培养结束后,加入5 mg/ml MTT溶液100 μl,37℃条件下孵育4 h,离心弃上清,加入二甲基亚砜(Dimethyl sulphoxide,DMSO)200 μl,置摇床37℃孵育10 min,酶标仪读取490 nm波长处的吸光度(OD)值,OD(490 nm)值越大,表示细胞增殖能力越强。
1.5 Transwell小室法检测细胞迁移和侵袭 检测细胞迁移能力时,收集各组HepG2细胞,采用无血清RPMI-1640培养基稀释为5×105个/ml的浓度,在上室中添加100 μl。下室加入500 μl含10%胎牛血清的RPMI-1640培养基。培养24 h,之后用无菌棉签除去多余细胞,甲醛固定15 min,结晶紫染色15 min,通过显微镜观察,记录迁移细胞数。检测细胞侵袭能力时,100 μl Matrigel基质胶与500 μl无血清培养基充分混合,吸取50 μl于上室,37℃静置3~4 h。其余步骤同上。
1.6 Western blot检测CyclinD1、P21、E-cadherin、MMP-2蛋白表达 收集各组细胞HepG2,加入RIPA裂解液用以提取总蛋白,提取到的蛋白经10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE),转聚偏二氟乙烯(Polyvinylidene fluoride,PVDF)膜,于5%脱脂奶粉中封闭1 h,加入CyclinD1、p21、E-cadherin、MMP-2以及内参GAPDH一抗(1∶1 000稀释),在4℃条件下孵育过夜,Tris-HCl-Tween缓冲盐溶液(Tris buffered saline with Tween,TBST)充分洗膜(3次×10 min),加入二抗(1∶5 000稀释),孵育1 h,TBST充分洗膜(3次×10 min),进行显色、显影,分析蛋白条带灰度值。
1.7 qPCR检测SNHG1和miR-195表达 使用TRIzol试剂提取细胞HepG2的总RNA,逆转录为cDNA。以cDNA为模板,进行qPCR反应。SNHG1上游引物序列5’-GATTTACGCGCACGTTGGAA-3’,下游引物序列5’-ACCAGTAAGCTCTTGTGGGC-3’,miR-195上游引物序列5’-GGCTCTAGCAGCACAGAAAT-3’,下游引物序列5’-ATATTGGCAGACTCGCTTCC-3’,内参U6上游引物序列5’-CTCGCTTCGGCAGCAC
A-3’,下游引物序列5’-AACGCTTCACGAATTTGCGT-3’。根据得到的Ct值,用2-ΔΔCt法计算SNHG1和miR-195相对表达量。
1.8 双荧光素酶报告实验 StarBase软件(http://starbase.sysu.edu.cn/)预测出SNHG1与miR-195存在结合位点,猜想SNHG1可能靶向调控miR-195表达。分别构建含有miR-195结合位点的野生型SNHG1(WT-SNHG1)和突变型SNHG1(MUT- SNHG1)荧光素酶报告载体,利用Lipofectamine 2000试剂,将其与miR-195或miR-NC共转染入细胞HepG2,转染48 h,依照双萤光素酶报告基因检测试剂盒步骤测定荧光素酶活性。
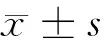
2 结果
2.1 伊立替康对细胞HepG2增殖、迁移、侵袭的影响 MTT法检测细胞HepG2增殖,与Con组比较,16 ml/L、32 ml/L、64 ml/L伊立替康明显降低细胞活性(P<0.05),并呈剂量和时间依赖性。根据结果,选用抑制率约为50%的伊立替康浓度(32 ml/L)用作后续实验。Transwell小室法检测细胞HepG2迁移和侵袭,32 ml/L 伊立替康较Con组大幅减少迁移细胞数和侵袭细胞数(P<0.05)。Western blot检测结果表明,16 ml/L、32 ml/L、64 ml/L伊立替康显著降低细胞HepG2中Cyclin D1蛋白水平而增加P21蛋白表达量(P<0.05),并呈剂量依赖性;32 ml/L 伊立替康明显提高E-cadherin蛋白表达而减少MMP-2蛋白表达量(P<0.05)。见图1,表1、2。

图1 伊立替康对细胞HepG2增殖、迁移、侵袭蛋白表达的影响;A 伊立替康对细胞HepG2增殖蛋白表达的影响;B 伊立替康对细胞HepG2迁移、侵袭蛋白表达的影响
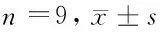
表1 伊立替康对细胞HepG2增殖的影响
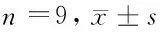
表2 伊立替康对细胞HepG2迁移、侵袭的影响
2.2 伊立替康对细胞HepG2中SNHG1表达的影响 qPCR检测细胞HepG2中SNHG1表达,结果发现伊立替康组细胞中的SNHG1表达量远远低于Con组(P<0.05)。见表3。
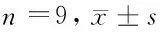
表3 伊立替康对细胞HepG2中SNHG1表达的影响
2.3 抑制SNHG1表达对细胞HepG2增殖、迁移、侵袭的影响 将SNHG1转染入细胞HepG2,结果显示,与si-NC组比较,SNHG1表达量明显下降(P<0.05),说明成功构建抑制SNHG1表达的HepG2细胞。相比于si-NC组,抑制SNHG1表达显著降低24 h、48 h和72 h的细胞活性(P<0.05),并呈时间依赖性,大幅减少迁移细胞数和侵袭细胞数(P<0.05),且减少Cyclin D1、MMP-2蛋白水平,提升P21、E-cadherin蛋白表达量(P<0.05)。见表4、5,图2。
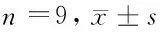
表4 抑制SNHG1表达对细胞HepG2增殖的影响
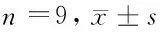
表5 抑制SNHG1表达对细胞HepG2迁移、侵袭的影响

图2 抑制SNHG1表达对细胞HepG2增殖、迁移、侵袭蛋白表达的影响
2.4 过表达SNHG1能逆转伊立替康对细胞HepG2增殖、迁移、侵袭的影响 与Con组比较,伊立替康明显影响细胞HepG2中SNHG1水平、细胞活性、迁移细胞数、侵袭细胞数和CyclinD1、P21、E-cadherin、MMP-2蛋白表达(P<0.05),结果同2.1、2.2。与伊立替康32 ml/L+pcDNA3.1组比较,伊立替康 32 ml/L+pcDNA3.1- SNHG1组显著升高细胞HepG2中SNHG1表达量,提高24 h、48 h和72 h的细胞活性,并呈时间依赖性,增加迁移细胞数和侵袭细胞数,以及Cyclin D1、MMP-2蛋白表达量,降低P21、E-cadherin水平,上述差异均具有显著性(P<0.05)。见图3,表6、7。
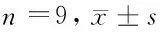
表6 过表达SNHG1能逆转伊立替康对细胞HepG2增殖的影响
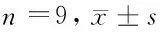
表7 过表达SNHG1能逆转伊立替康对细胞HepG2迁移、侵袭的影响

图3 过表达SNHG1能逆转伊立替康对细胞HepG2增殖、迁移、侵袭蛋白表达的影响
2.5 SNHG1靶向miR-195 StarBase靶基因预测工具检测到SNHG1与miR-195含有互补的核苷酸序列。双荧光素酶报告数据显示,miR-195对WT- SNHG1荧光素酶相对活性具有显著抑制作用(P<0.05),对MUT- SNHG1荧光素酶相对活性无明显影响。qPCR检测结果表明,pcDNA3.1- SNHG1较pcDNA3.1明显减少miR-195表达量(P<0.05),si- SNHG1较si-NC显著增加miR-195表达量(P<0.05)。见图4,表8、9。
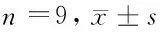
表8 双荧光素酶报告实验
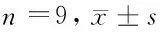
表9 SNHG1调控miR-195的表达
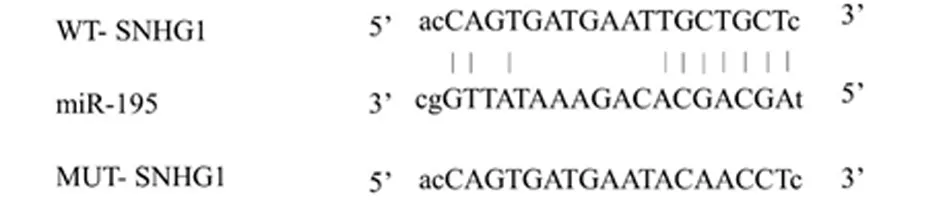
图4 SNHG1靶向miR-195
2.6 抑制miR-195表达能逆转伊立替康对细胞HepG2增殖、迁移、侵袭的影响 与Con组相比,伊立替康显著升高细胞HepG2中的miR-195水平(P<0.05),并明显影响细胞活性、迁移细胞数、侵袭细胞数和CyclinD1、P21、E-cadherin、MMP-2蛋白表达(P<0.05),结果同2.1。与伊立替康32 ml/L+anti-miR-NC组比较,伊立替康 32 ml/L+ anti-miR-195组明显减少细胞HepG2中的miR-195、P21蛋白、E-cadherin蛋白表达量,提高24 h、48 h和72 h的细胞活性,且呈时间依赖性(表10),以及提高CyclinD1、MMP-2蛋白水平、迁移细胞数和侵袭细胞数,显著均具有差异性(P<0.05)。见表10、11。
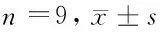
表10 抑制miR-195表达能逆转伊立替康对细胞HepG2增殖的影响
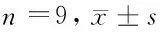
表11 抑制miR-195表达能逆转伊立替康对细胞HepG2迁移、侵袭的影响
3 讨论
伊立替康是喜树碱的一种类似物,在体内代谢活化为7-乙基-10-羟基喜树碱(SN-38)的前药[8]。伊立替康具有广谱的抗肿瘤活性,如非小细胞肺癌、胃癌[9],尤其是结直肠癌[10]。研究发现伊立替康与5氟尿嘧啶(5-FU)、奥沙利铂和叶酸等联合使用可用于治疗无法切除的胰腺癌患者[11]。纳米脂质体伊立替康联合氟尿嘧啶和亚叶酸可延长转移性胰腺导管腺癌患者的生存率[12]。伊立替康与姜黄素组合明显抑制转移性结直肠癌细胞活力,并增加细胞凋亡[13],长期接触伊立替康可减少神经胶质瘤细胞C6的细胞迁移[14]。然而,伊立替康对肝癌细胞毒性以及参与该过程的分子机制仍然未知。本研究中,伊立替康以剂量和时间依赖方式抑制HepG2细胞增殖,并明显减少迁移细胞数、侵袭细胞数、CyclinD1、MMP-2蛋白表达量,提高P21、E-cadherin蛋白表达(P<0.05)。说明伊立替康在肝癌中同样发挥抗癌作用,这与先前的报道一致。此外,qPCR检测数据显示,伊立替康明显下调HepG2细胞中SNHG1表达,表明SNHG1可能是伊立替康抑癌作用的重要调节剂。 长链非编码RNA(Long noncoding RNA,lncRNA)为长度大于200个核苷酸的转录物,据报道,许多已鉴定的lncRNA可作为诱饵,支架,指导或miRNA海绵来影响包括肝癌在内的多种肿瘤进程[15],如UICLM[16]。研究发现SNHG1在多种恶性肿瘤表达异常,作为致癌基因影响肿瘤细胞的生物学行为[17]。SNHG1在肝癌、肺癌、结直肠癌和胃癌中表达上调,且与肺癌瘤体大小、TNM分期和远端转移正相关[18,19]。SNHG1在结直肠癌组织和细胞系中表达上调,下调SNHG1抑制结直肠癌细胞迁移,增殖和集落形成,但促进细胞凋亡[20]。本实验中,抑制SNHG1表达显著降低HepG2细胞活性,并呈时间依赖性,以及明显减少迁移细胞数、侵袭细胞数、Cyclin D1、MMP-2蛋白表达量,而提升P21、E-cadherin蛋白水平(P<0.05),提示与其他癌症相同,SNHG1在肝癌中也充当致癌因子,促进肝癌细胞增殖、迁移和侵袭。另外,功能实验测定显示,过表达SNHG1能逆转伊立替康对细胞HepG2增殖、迁移、侵袭的抑制作用,提示伊立替康通过下调SNHG1表达发挥抗癌功能。 微小RNA(MicroRNA,miRNA/miR)是一类内源性短链非编码RNA,通过与靶mRNA的3,非编码区域(3,untranslated region,3,UTR)碱基配对,调节基因表达,其在肝脏疾病发展和进展中的特定贡献已被描述[21],如miR-34a[22]、miR-196a[23]等。资料显示,miR-195在肝癌中下调表达,过表达miR-195可抑制肝癌细胞迁移、侵袭[24]。在过去几年中,已经研究了miRNA和lncRNA作为许多不同疾病的潜在诊断预测因子或治疗靶标[25]。LncRNA CACS15通过miR-145调节ABCC1,从而促进结直肠癌中奥沙利铂的耐药性,lncRNA XIST是结直肠癌的预后因子,通过促进胸苷酸合酶表达抑制5-Fu诱导的结直肠癌细胞毒性。本项实验中,SNHG1靶向miR-195,上调或下调SNHG1明显调控miR-195,并且抑制miR-195表达能逆转伊立替康对细胞HepG2增殖、迁移、侵袭的影响,证明通过SNHG1并调控miR-195表达可能是伊立替康实现抗肝癌作用的重要途径。 总之,本研究结果表明,伊立替康可有效抑制肝癌细胞增殖、迁移和侵袭,伊立替康通过调控SNHG1/miR-195的表达,进而发挥抗肝癌作用,这为肝癌提供了潜在治疗药物和治疗靶点。
