秸秆还田对黑土亚表层微生物群落结构的影响特征及原因分析
2020-03-03董建新李玉义逄焕成
丛 萍,王 婧,董建新,李玉义,刘 娜,逄焕成
秸秆还田对黑土亚表层微生物群落结构的影响特征及原因分析
丛 萍1,2,王 婧1,董建新2,李玉义1,刘 娜1,逄焕成1※
(1. 中国农业科学院农业资源与农业区划研究所,北京 100081;2. 中国农业科学院烟草研究所,青岛 266100)
为明确切碎秸秆与秸秆颗粒对黑土亚表层土壤微生物群落结构的影响效应,从而评价不同秸秆还田方式对亚表层的培肥效果,该研究于2016—2018年在东北黑土区进行一次性玉米秸秆深埋还田试验,设置切碎秸秆低量(QS1)、切碎秸秆高量(QS5)、秸秆颗粒低量(KL1)与秸秆颗粒高量(KL5)4种秸秆还田处理,并与秸秆不还田(CK)进行对比,于每年玉米收获季对土壤理化指标及微生物菌群结构进行监测。结果表明,1)秸秆还田第1年,切碎秸秆处理显著提高土壤总磷脂脂肪酸含量及真菌摩尔百分数,其高量处理较CK最高增加71.0%和120.5%,而秸秆颗粒处理对细菌、革兰氏阳性菌和革兰氏阴性菌的摩尔百分数增幅更显著,其高量处理最高增加41.6%、29.7%和26.3%;还田第2年高量处理显著提高各菌群磷脂脂肪酸含量,且切碎高量处理的真菌摩尔百分数含量显著高于颗粒高量处理21.0%;还田第3年仅高量处理下的菌群结构有显著分异。2)还田初期切碎秸秆处理显著提高真菌:细菌比值,而低量还田则对革兰氏阳性菌和革兰氏阴性菌比有提高,随还田时间的增加,高量还田比值提高更显著,利于长期维持生态系统稳定性。3)秸秆高量还田可显著改变土壤理化因子水平,这是导致微生物群落结构分异的重要原因,其显著影响因子随还田年限而更替:第1年,土壤容重、酸碱度、全氮和碳氮比为显著(<0.05)影响因素;第2年,土壤含水量、有机碳、碳氮比和土壤容重为极显著影响因素(<0.01);第3年仅有机碳为显著因素(<0.05)。切碎秸秆高量还田处理微生物群落结构分布与CK区分最为明显,对土壤真菌群落的调控能力更强,更适宜于东北黑土亚表层肥力的提升。
土壤;秸秆;微生物群落结构;深还田;亚表层
0 引 言
土壤微生物是土壤生态系统中最活跃的具有生命特征的重要组成成分,参与生态系统中的各个养分生化循环过程[1-2],土壤微生物多样性以及结构变化已成为衡量土壤肥力质量的重要指标[3-4]。秸秆还田是当前增加农地有机物料投入的重要手段之一,可以培肥土壤、提升地力。秸秆施入到土壤中对微生物群落结构及多样性有重要影响,一方面作为高碳源有机物质为土壤微生物生命活动提供能量,另一方面,秸秆还田后改变了土壤的孔隙结构及水分状况等,影响了微生物的生存环境[5-6]。可见,秸秆还田易于影响微生物生境中的敏感性因子,研究土壤中的微生物变化有利于更好地评价秸秆还田的培肥效果。
亚表层是位于心土层(20~50 cm)范围内的重要耕作层以及作物根系分布层,位于约20~40 cm,对土壤碳固定以及作物产量提高有重要作用[7]。然而当前东北黑土犁底层增厚变硬(增厚至7~11 cm)[8]、亚表层有机碳含量锐减(较垦前降低40%~60%[9]、黑土层变薄(近40%已小于30 cm)[10-11]等问题严峻,亟需有效措施进行培肥改良。秸秆深还田是培肥亚表层的重要措施[12-14],它直接将秸秆施入30~40 cm土层,使土壤容重降低9.9%~6.2%[13],有机碳增加10%~20%,并且改善效果在一定程度上随着秸秆用量的增加而增大[14]。然而,当前有关秸秆还田对亚表层微生物群落结构影响的研究甚少,土壤生物学肥力的改善效果未知。
研究表明,秸秆用量、秸秆形态以及还田年限等对土壤微生物均有不同影响。秸秆用量因耕作方式以及气候类型而异,东北玉米大豆轮作区免耕条件下60%的秸秆还田量更有利于提高微生物活性[15],而在南方水稻产区耕翻条件下2/3还田量处理的土壤微生物活度最高,少免耕条件下1/3还田量处理最高[16]。秸秆形态越细小,粉碎化程度越高,越有利于加快微生物的腐解进程[17],并且能够影响细菌及真菌的群落组成[18]。在中国北方地区,长期玉米秸秆还田能够显著提高真菌生物量,而对细菌无显著影响[19],但是短期的秸秆还田则能够增加土壤总磷脂脂肪酸(PLFA)数量、真菌以及细菌生物量[20]。但上述有关秸秆还田对土壤微生物影响的研究往往只针对于0~20 cm耕层,且还田量大多低于全量还田,致使玉米秸秆的肥料化利用率仍然偏低。收割机切碎后的秸秆直接还田操作相对简便,是农民常用的秸秆还田形式吗,但秸秆形态较为粗放,可能无法在短期内快速培肥,而新型的秸秆颗粒肥是用常规秸秆细粉后挤压制成,具有体积小、施用方便、养分释放率高的优点,且前期试验验证其具有快速培肥耕层土壤的效应[21-22]。对于土壤亚表层而言,其氧气以及水分条件等均异于耕层[23],当不同形态或者是大量秸秆施入亚表层后,碳源的增加及其他理化性状的改变必然引起土壤微生物群落的变化,但其影响特征以及改变原因尚不清晰。因此,本研究将收割机切碎的秸秆(QS)以及秸秆颗粒(KL)2种形态的秸秆实施深还田,在前期研究的基础上设置高、低两种倍量,并与秸秆不还田(CK)进行对比。研究目的在于:一是探究不同秸秆形态以及倍量还田下亚表层土壤细菌及真菌群落结构的变化,二是明确东北黑土区影响亚表层微生物群落变化的主要环境因子,以期从土壤微生物学角度为东北黑土亚表层的培肥方式提供指导。
1 材料和方法
1.1 试验地概况
田间定位试验于2015-2018年在吉林省公主岭市朝阳坡镇(43°36′N,124°43′E)进行,该地位于我国东北黄金玉米生产带上,地处吉林省中西部,东辽河中游右岸。当地以雨养农业为主,种植作物主要为玉米、大豆。属温带大陆性季风气候,年平均气温5.6 ℃,年均降水量594.8 mm,无霜期144 d。试验地土壤类型为典型黑土,耕作方式以旋耕、翻耕为主。土壤基础理化性状如表1。

表1 2015年10月试验地土壤基本理化性状
1.2 试验材料
本试验设置玉米切碎秸秆、玉米秸秆颗粒2种不同秸秆形态,以当地秸秆常量还田的用量为基准(玉米收获后剩余地上部的总量,每年约为15 t/hm2),分别设置玉米秸秆切碎还田(QS1, 15 t/hm2)、玉米秸秆切碎还田(QS5, 75 t/hm2)、玉米秸秆颗粒还田(KL1, 15 t/hm2)、玉米秸秆颗粒还田(KL5, 75 t/hm2)4种秸秆还田处理,并以秸秆不还田(CK)为对照。每个处理3次重复,共设15个小区,随机区组排列,每个小区为长4 m、宽4 m(6垄)共计16 m2见方,小区与小区之间留出1 m距离,避免因农机具拖曳秸秆而对小区处理造成影响。试验布置前需收集当地玉米收获时随收割机切碎的玉米秸秆,长度约10~15 cm,将收集起的秸秆分为2部分,一部分风干后用作切碎秸秆还田处理(QS),另一部分收集起来的玉米秸秆用HC-2000型粉碎机粉碎后过2 mm筛,按照30%~35%比例添加蒸馏水,搅拌均匀后用FTHBCX350型环模秸秆颗粒机挤压制得直径4 mm、长度4~6 cm的棒状固体,即秸秆颗粒(KL),不同形态秸秆的主要理化性状如表2所示。

表2 不同形态秸秆的主要理化性状
1.3 试验设计
在2015年10月前茬玉米收获后实施秸秆翻埋,将收集到的切碎秸秆以及秸秆颗粒按照规定用量均匀铺于各个小区内,由拖拉机牵引翻埋犁(功率>92 kW)统一对整片试验田进行翻埋耕作,从而避免对相邻小区的碾压。秸秆翻埋犁作业深度约为30~40 cm,可将绝大部分切碎秸秆以及秸秆颗粒翻入20~40 cm亚表层范围。此后3年试验期间不再进行任何秸秆还田,每年玉米播种前需清除地表残留秸秆。当地种植制度为玉米连作一年一熟制,供试玉米品种为奇玉8号,通常为每年5月初进行播种,种植密度为67 500 株/hm2,播种前进行侧面深施基肥,施用量为纯N 225 kg/hm2、P2O575 kg/hm2和K2O 225 kg/hm2。其中磷肥、钾肥一次播种,氮肥30%基施,70%拔节施,各处理的田间管理与普通高产玉米相似,并于每年10月初收获。
1.4 测定指标与方法
1.4.1 土壤样品采集
2016-2018年连续3年在夏玉米成熟期(10月初),在距离小区边缘0.5 m的内部依据五点取样原则用不锈钢土钻取20~40 cm土层的土样,混匀作为一个重复。将土壤样品从土钻中取出后,剔除可见的掉落物和根系,将土块轻轻捏碎、混匀,在田间过2 mm筛[24],一部分新鲜土样立即放在保温盒内用冰袋保存运回实验室,冷冻干燥后放在−80 ℃保存,用于磷脂脂肪酸(PLFA)法测定微生物群落结构;另一部分土样放入自封袋中带回实验室风干,用于测定土壤理化因子指标。
1.4.2 磷脂脂肪酸(PLFA)的测定
土壤微生物群落采取磷脂脂肪酸(PLFA)方法进行测定。磷脂脂肪酸的提取方法主要参照Frostegard等[25]的方法。采用美国MIDI Sherlock微生物鉴定系统平台(Version 4.5, MIDI, Inc, Newark, DE)的PLFA模块,以氢气为载气,以安捷伦Agilent 6890N气象色谱仪及FID检测器为硬件平台,色谱柱为Agilent 19091B−102(25 m× 200m× 0.33m),每个样品进样量为1L。根据MIDI平台规范,所有测试均采用0.5 mg/mL十九酸甲酯标准品(冷泉港生物科技股份有限公司)进行校正。脂肪酸定量用峰面积和内标曲线法表征,单位nmol/g。
以磷脂脂肪酸16:0、17:0、16:1ω5c、16:1ω7c、16:1ω9c、17:1ω8c、18:1ω5c、18:1ω7c、a15:0、a17:0、cy17:0、cy19:0ω8c、i14:0、i15:0、i16:0、i17:0和i19:0表征细菌[26]。用18:2ω6,9c、18:1ω9c和18:3ω6c(6,9,12)表征真菌[27]。以16:0(10Me)、17:0(10Me)和18:0(10Me)表征放线菌。以14:0、17:0、18:0、i14:0、i15:0、i16:0、i17:0、a15:0、a17:0和cy17:0、cy19:0ω8c、16:1ω5c、16:1ω9c、16:1ω7c、17:1ω8c、18:1ω5c、18:1ω7c分别表征革兰氏阳性菌(G+)和革兰氏阴性菌(G-)[28]。
1.4.3 环境因子的测定
秸秆还田后直接改变土壤容重(soil bulk density,SBD,g/cm3)、土壤含水量(soil water content,SWC,g/kg)、pH值、土壤有机碳含量(soil organic carbon,SOC,g/kg)、土壤全氮(total nitrogen,TN,g/kg)以及土壤C/N,因此选择此6项作为主要的环境因子。其中,SBD在田间运用环刀法对20~40 cm土层进行测定;SWC则运用经典烘干法对20~40 cm土层进行测定;土壤pH运用FE38-FiveEasyPlus™(Mettler-Toledo, Switzerland)型pH计进行测定;土壤有机质(soil organic matter,SOM,g/kg)采用重铬酸钾外加热法测定,再根据SOM(g/kg)=SOC(g/kg)×1.724来换算成有机碳的含量;TN采用凯氏定氮法进行测定;C/N则是SOC与TN的比值。
1.5 数据处理
采用Microsoft Excel 2016对试验数据进行整理,运用SAS 9.4软件中的单因素方差分析(one-way ANOVA)比较不同处理间的差异(LSD,=0.05)。采用Canoco 5.0软件对不同处理间微生物群落分布差异进行主成分分析(principal component analysis, PCA),对微生物群落结构变化与环境因子的相互关系进行冗余分析(redundancy analysis, RDA)。
2 结果与分析
2.1 秸秆还田对亚表层土壤微生物群落的影响
2.1.1 亚表层土壤微生物磷脂脂肪酸(PLFA)的变化特征
在黑土亚表层中微生物群落数量的大小顺序为细菌最大,真菌与放线菌次之。与CK相比,秸秆还田前2年显著增加亚表层土壤磷脂脂肪酸(PLFA)总量以及细菌、真菌的摩尔百分数,但能够降低放线菌摩尔百分数,降低幅度随还田时间的增加略有减小(表3)。主要表现如下:
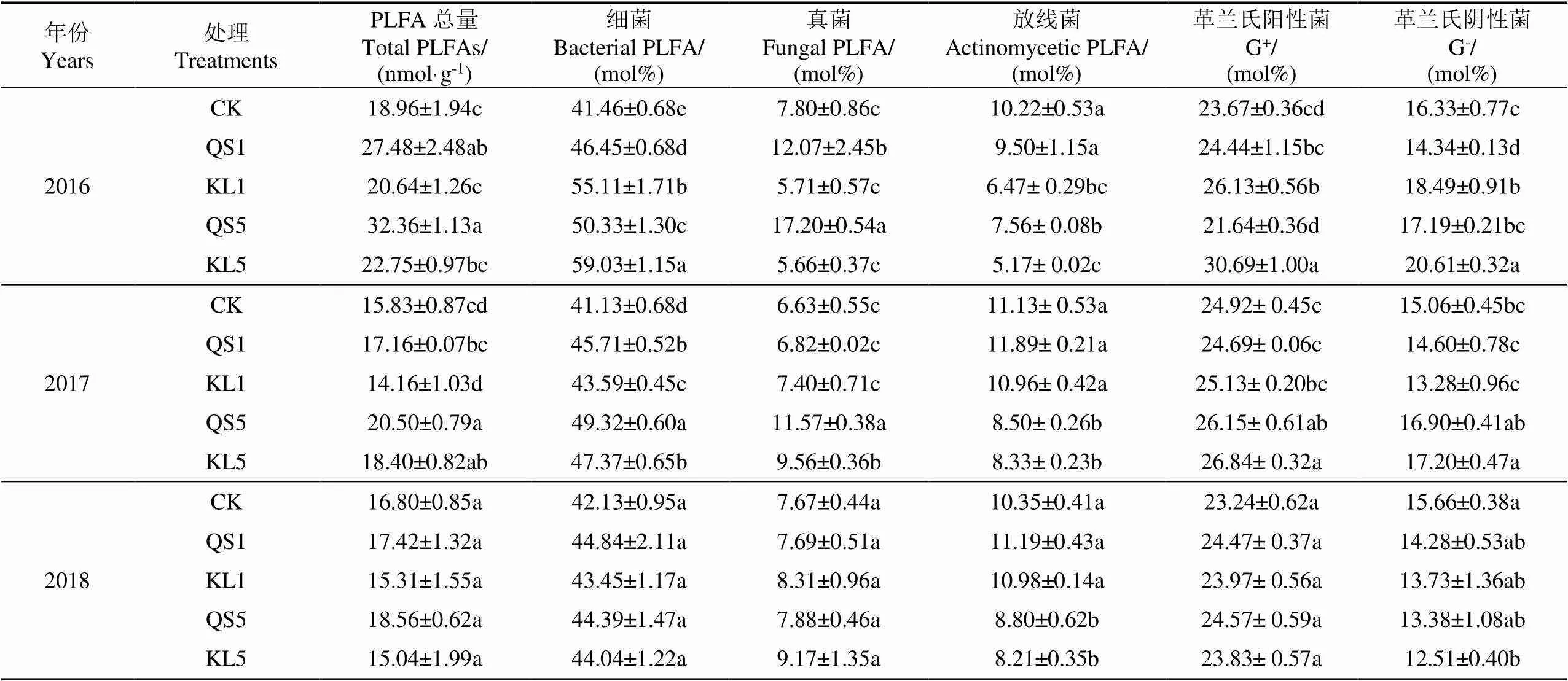
表3 2016-2018年不同处理下亚表层土壤(20~40 cm)PLFA总量以及各菌群PLFA变化
注:CK为秸秆不还田;QS1为玉米秸秆切碎还田,15 t·hm-2;KL1为玉米秸秆颗粒还田,15 t·hm-2;QS5为玉米秸秆切碎还田,75 t·hm-2;KL5为玉米秸秆颗粒还田,75 t·hm-2。小写字母代表不同处理间进行差异比较,差异分析在<0.05的显著性水平,下同。
Note: CK, no straw return; QS1, chopped straw return with 15 t·hm-2; KL1, pelletized straw return with 15 t·hm-2;QS5, chopped straw return with 75 t·hm-2; KL5, pelletized straw return with 75 t·hm-2. Different lowercase letters represent differences between treatments at the level of 0.05, the same below.
2016年,PLFA总量变幅在18.96~32.36 nmol/g,与CK相比,QS1与QS5处理分别显著增加亚表层土壤PLFA含量45.5%(<0.05)与71.0%(<0.05)。秸秆还田能显著增加细菌摩尔百分数,增幅为14.5%~41.6%(<0.05),以秸秆颗粒最为显著;切碎秸秆还田能显著增加真菌摩尔百分数,QS5与QS1分别较CK提高120.5%(<0.05)与54.7%(<0.05),且QS5处理显著高于QS1;秸秆还田能降低放线菌的摩尔百分数,其中KL5降低幅度最大,约为29.4%(<0.05);KL5处理下G+与G-的摩尔百分数最高,分别高于CK 29.7%(<0.05)与26.3%(<0.05),而KL1次之,QS5最低。由此可见,在还田第1年秸秆形态对PLFA总量以及菌群结构影响显著,秸秆颗粒能够显著增加细菌摩尔百分数,而切碎秸秆更易引起真菌摩尔百分数的显著提高,且切碎秸秆对真菌的增加程度要高于秸秆颗粒之于细菌。
2017年,PLFA总量变幅在15.83~20.50 nmol/g,与CK相比,QS5与KL5处理分别显著增加土壤PLFA总量29.5%(<0.05)与16.2%(<0.05),但二者无显著差异;秸秆还田处理下细菌摩尔百分数含量均显著高于CK,表现为QS5>KL5与QS1>KL1,增幅为6.0%~19.9%(<0.05);从真菌含量变化看,QS5与KL5分别显著高于CK 74.5%(<0.05)与44.2%(<0.05),且QS5亦显著高于KL5 21.0%(<0.05);而对于放线菌而言,KL5与QS5仍表现出显著降低趋势,低于CK约24.3%;秸秆高量还田较CK显著增加革兰氏阳性菌(G+)与革兰氏阴性菌(G-)的摩尔百分数约6.3%(<0.05)与13.2%(<0.05),但KL5与QS5之间无显著差异。由此可见,秸秆还田第2年PLFA总量以及各菌群变化受秸秆用量的影响显著,秸秆高量还田能够显著增加PLFA总量以及细菌、真菌、G+与G-的摩尔百分数,显著降低放线菌的摩尔百分数。
2018年,PLFA总量变幅在15.04~18.56 nmol/g,但秸秆还田对PLFA总量及细菌、真菌与G+的摩尔百分数无显著影响。其中,秸秆高量还田能显著降低放线菌的摩尔百分数约17.9%(<0.05),KL5亦能显著降低G-20.1%(<0.05)。可见随着还田时间增加,秸秆对土壤微生物群落结构的影响逐渐减小,微生物群落结构有回归于最初结构组成的趋势。
2.1.2 亚表层真菌:细菌比值以及G+:G-比值的变化特征
土壤中真菌:细菌比值及G+:G-比值常用来表示土壤生态系统的稳定性,比值越大,土壤生态系统越稳定[29]。其中真菌:细菌比值的提高可增加土壤固碳能力,而G+:G-比值高则表明腐殖化程度较高的碳源较多[30]。从真菌:细菌比值来看(图1a),与CK相比,2016年切碎秸秆还田提高了真菌:细菌比值,而秸秆颗粒还田降低了真菌:细菌比值,其中QS5处理下土壤亚耕层真菌:细菌比值为0.34,显著高于CK的0.19(<0.05),KL5仅为0.10,显著低于CK(<0.05);2017年,QS5与KL5真菌:细菌比值均显著高于CK,其中QS5最高为0.23(<0.05),KL5为0.20(<0.05);2018年各处理真菌:细菌比值均与CK无显著差异。随着秸秆还田时间的增加,切碎秸秆还田真菌:细菌比值逐渐降低,而秸秆颗粒还田则逐渐上升,秸秆高量还田更易提高真菌:细菌比值。
从G+:G-比值来看(图1b),2016年,QS1的G+:G-比值为1.89,显著高于CK的1.65(<0.05),而QS5为1.26,显著低于CK(<0.05);2017年,各处理虽与CK相比无显著差异,但KL1的G+:G-比值最高为1.89,显著高于QS5与KL5(<0.05);2018年,虽然秸秆还田处理均较CK提高了G+:G-比值,但无显著差异。由此可见,G+:G-比值的变化受秸秆形态与秸秆用量的综合影响,还田前期高量处理在一定程度上抑制了G+:G-比值的增加,但随着还田时间的延长,秸秆高量还田的G+:G-比值逐渐提高,这是因为G-对新鲜有机碳的输入反应更敏感,起初占据优势地位[31],而到后期有机碳转化为稳定碳源,G+开始增长。

注:不同字母代表相同年份下不同处理间差异显著(P<0.05)。
2.1.3 亚表层各菌群PLFA的分布特征
对亚表层土壤中所检测出的所有PLFA单体的摩尔数进行主成分(PCA)分析(图2、图3和图4)。2016年,PC1与PC2分别占据了总变异的25.23%和24.34%,QS5处理的样本在第一主成分上明显与CK区分开,而QS1处理的样本在第二主成分上明显与其他处理的样本区分开(图2a)。其中饱和脂肪酸(14:0、15:0、16:0、17:0、20:0、23:0、i13:0、i14:0、i16:0和i17:0)、环丙烷脂肪酸(17:0cy ω7c)、甲基支链脂肪酸(17:0 (10Me)和16:0(10Me))以及部分单不饱和脂肪酸(16:1 ω7c、16:1 ω5c、17:1 ω8c和18:1 ω9c)和多不饱和脂肪酸(22:5 ω6c、20:5 ω3c、19:3 ω3c和18:2 ω6c)在第一主成分上载荷值较高且为正值(图2b),而在第一主成分的载荷值的负值区域仅有部分单不饱和脂肪酸(14:1 ω9c、14:1 ω8c、19:1 ω8c、20:1 ω9c和16:1 ω9c)和多不饱和脂肪酸(21:3 ω3c、19:3 ω6c和16:3 ω6c)分布。从第二主成分上来看,在载荷值为正值部分主要分布饱和脂肪酸及甲基支链脂肪酸,而载荷值为负值部分主要分布不饱和脂肪酸和环丙烷脂肪酸。其中不饱和脂肪酸多为革兰氏阴性菌和真菌的标记脂肪酸,而饱和脂肪酸、环丙烷脂肪酸以及甲基支链脂肪酸多为革兰氏阳性菌和放线菌的标记脂肪酸,其中环丙烷脂肪酸在厌氧环境下广泛存在,可作为厌氧环境指标[32]。

2017年的PCA分析显示,PC1与PC2分别占据了总变异的36.66%和20.66%,在第一主成分上QS5样本与KL5和QS1样本与CK和KL1样本均有较好的区分,而在第二主成分上,QS1样本则与其他处理的样本有较好区分(图3a)。从第一主成分来划分,土壤中多数PLFA单体的载荷值为正值,仅有少数多不饱和脂肪酸(21:3 ω3c和18:2 ω6c)以及甲基支链脂肪酸(17:1 ω7c(10Me)和16:0(10Me))的载荷值为负值;从第二主成分来划分,甲基支链脂肪酸(18:1 ω7c(10Me)和19:1 ω7c(10Me))与单不饱和脂肪酸(22:1 ω3c和19:1 ω8c)载荷值为正值,而载荷值为负值部分多为饱和脂肪酸(12:0、17:0、a14:0和a16:0)分布(图3b)。
2018年的PCA分析显示,PC1与PC2分别占据了总变异的28.48%和21.79%,在第一主成分上QS5样本与CK有明显区分,在第二主成分上KL1、KL5和QS1样本与CK的样本有较好的区分(图4a)。从第一主成分来划分,多不饱和脂肪酸(24:1 ω3c、20:5 ω3c和20:3 ω6c)以及饱和脂肪酸(12:0、a13:0和i15:1 ω6c)的载荷值为正值,甲基支链脂肪酸(18:0(10Me)和16:0(10Me))以及部分饱和脂肪酸和小部分不饱和脂肪酸的载荷值为负值;而饱和脂肪酸与不饱和脂肪酸在第二主成分上均占有相当的正负载荷值(图4b)。
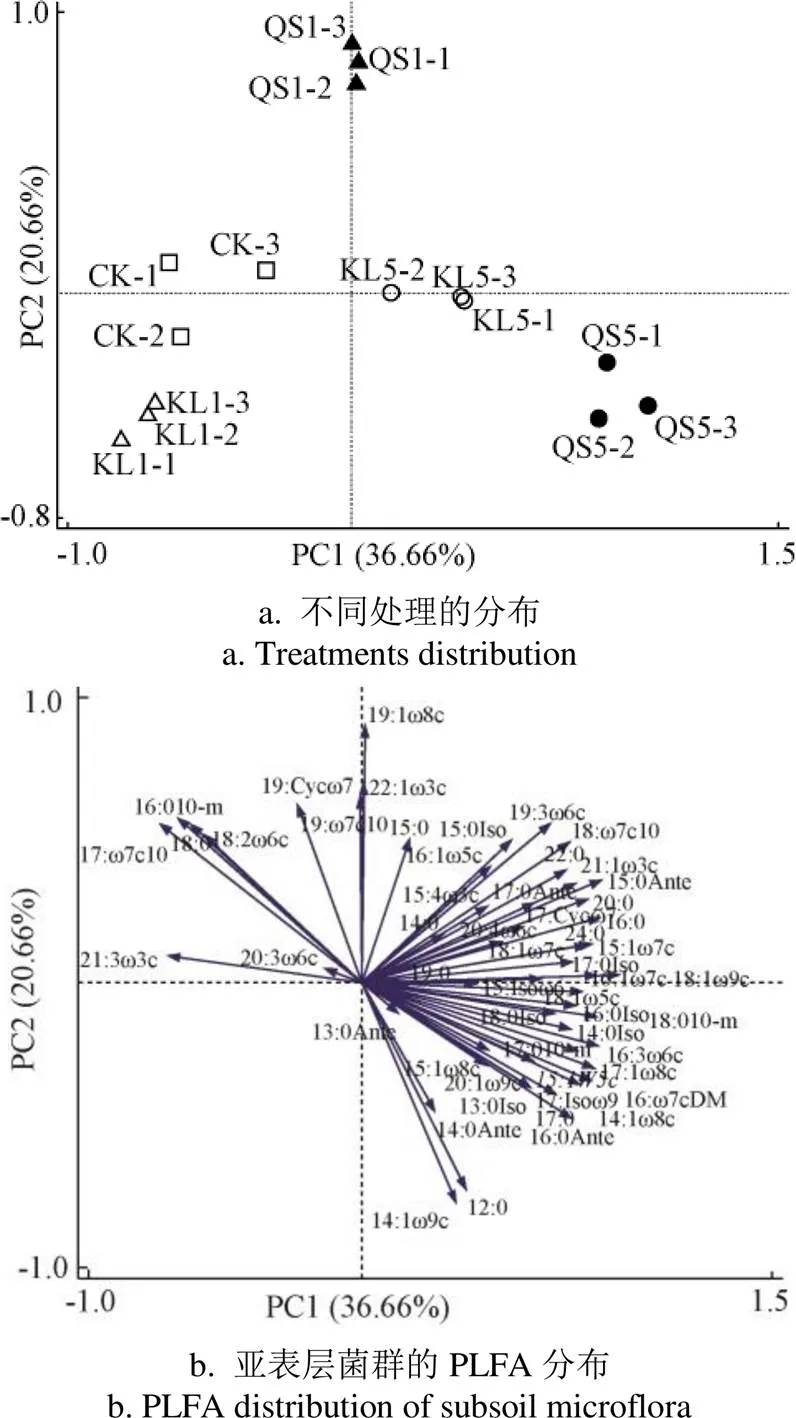
图3 2017年不同处理下亚表层土壤微生物群落结构的主成分分析

图4 2018年不同处理下亚表层土壤微生物群落结构的主成分分析
2.2 土壤微生物群落结构与土壤环境因子的关系
2.2.1 秸秆还田后土壤环境因子的变化
土壤环境因子的变化是影响土壤微生物群落结构组成的重要因素。表4表明,秸秆还田1 a,即2016年,QS5对土壤容重(SBD)、土壤含水量(SWC)及全氮(TN)的改善效果最显著,幅度均>20%(<0.05),而KL5对土壤有机碳(SOC)及碳氮比(C/N)的提升最显著,分别达21.3%(<0.05)与13.2%(<0.05),且秸秆还田对土壤pH有普遍降低作用。秸秆还田2 a,低量还田对各因素的影响程度降低,仅高量还田对各因素仍有显著影响,对土壤pH开始表现出提升效应,且QS5显著提高SOC达27.3%(<0.05)。秸秆还田3 a,仅秸秆高量还田对各因子有显著影响,但影响程度减弱。可见,秸秆一次性高量还田能够多年影响土壤环境因子,对SWC、SOC、TN、C/N的提高具有正效应,对SBD的增加具有负效应,对土壤pH则表现为前期显著降低后期显著提高。

表4 秸秆深埋还田对亚表层土壤主要环境因子的影响
2.2.2 土壤微生物群落PLFA与土壤环境因子的冗余分析
对20~40 cm亚表层土壤微生物群落PLFA与土壤环境因子进行冗余分析(图5),以揭示秸秆还田后引起微生物群落改变的重要原因。RDA分析表明,亚表层土壤环境因子对土壤微生物群落结构有重要影响,2016年,两个排序轴解释了总变异约80%,说明这两个排序轴在一定程度上能反映土壤环境因子对微生物群落影响的大部分信息,其中SWC、C/N(<0.05)、TN(<0.05)、pH(<0.05)和SBD(<0.05)是影响微生物群落结构的重要因素,且影响程度依次增大。2017年,两个排序轴解释了总变异约70%,其中TN(<0.05)、SBD(<0.01)、C/N(<0.01)、SOC(<0.01)和SWC(<0.01)是影响微生物群落的重要因素,且影响程度依次增大。2018年,2个排序轴对总变异的解释度不足50%,表明随着时间的延长,土壤环境因子对微生物群落结构的影响减弱,只有SOC对微生物群落结构有显著(<0.05)影响。可见,对微生物群落影响的主要环境因子随着还田时间而变化,初始阶段微生物受土壤通气性、酸碱性及C/N影响较大,中期受土壤水分、通气性及碳源状况影响较大,后期则受碳源数量影响大。

图5 2016、2017与2018年不同处理下亚表层土壤微生物群落结构与土壤环境因子的冗余分析
3 讨 论
3.1 不同秸秆还田方式对亚表层土壤微生物群落结构的影响
土壤亚表层位于心土层范围内,是经常被忽视的重要耕作层和根系分布层,研究其微生物菌群结构变化对于指导土壤生物学肥力的提高具有重要意义[7]。秸秆作为一种天然生物质资源,施入到土壤中为微生物提供了丰富的碳源和氮源,促进了微生物的生长和繁殖,必然引起微生物群落结构的变化[33],许多研究证实,秸秆翻埋较秸秆覆盖还田更能显著提高微生物生物量[34]。本研究中将秸秆深还至亚表层范围,同时以年为时间尺度研究发现,还田后第一年土壤微生物群落变化幅度最大,土壤磷脂脂肪酸(PLFA)总量显著提高,相比较而言,对真菌的影响幅度高于细菌,且真菌的变幅仅与秸秆形态有关,与秸秆用量无关,表现为切碎秸秆处理的土壤真菌摩尔百分数约为秸秆颗粒的2.5~3.5倍,这表明切碎秸秆在一定时期内更利于真菌生长,提高真菌:细菌比值。这主要有两方面原因,一是切碎秸秆体积较大,施入到土壤中后呈穿插分布状,形成更大的孔隙结构,使气相占比增加,而土壤大孔隙数量与真菌的相对丰度显著相关[35],通气性好的土壤环境更利于真菌的生长[36];二是玉米秸秆的表皮组织主要为硅细胞和木栓细胞,还有较多硅化物和蜡质[37],主要依赖于真菌进行分解[38],而秸秆颗粒的粉碎化程度高,表皮组织被高度粉碎,供真菌利用的碳源减少[39],导致颗粒处理下真菌占比未有显著提高。细菌的变幅不及真菌显著则主要是因为细菌主要出现在中、小孔隙中[40],多为好氧型或兼性厌氧型。秸秆还田2 a后高量还田较低量还田显著提高了土壤PLFA总量及细菌、真菌、革兰氏阳性菌(G+)与革兰氏阴性菌(G-)的摩尔百分数,高量还田优势突显,这说明成倍增加秸秆用量能够较长时间维持土壤微生物的活跃状态,因其延长了腐解期,提高了碳源供应量[14]。然而到秸秆还田第三年,各处理的菌群变化与CK差异不显著,表明如若没有外界的反复或长期刺激,微生物群落结构最终回归于扰动前的稳定状态,许多文献也表明,土壤微生物群落结构的明显改变往往发生在长期施肥或秸秆年年还田的处理中[19,28]。另外,本研究中虽然真菌摩尔百分数有提高,但仍未在亚表层中形成以真菌为优势种群的微生物群落,细菌仍为优势种群,孙冰洁[35]研究指出,长期免耕和垄作下不能形成真菌优势种群,但长期秋翻下5~10 cm和10~20 cm土层真菌的优势地位明显,这一方面是与秸秆残体处于不同的分解阶段有关[41],另一方面也受长期试验影响。秸秆深还田后普遍降低了放线菌PLFA含量,这可能与放线菌适宜较高的pH环境有关[42]。另外,秸秆还田虽然在一定程度上提高了细菌、真菌的摩尔百分数,但是对微生物群落多样性却未见显著提高,表5根据微生物各菌群摩尔百分数计算出香浓指数(shannon),以表征微生物群落物种丰富度[43],然而秸秆还田的shannon指数均低于CK,这是因为秸秆还田后,腐解秸秆的菌群相对增多,逐渐占据优势地位,从而使微生物群落多样性下降[44]。

表5 不同秸秆还田处理下亚表层土壤微生物群落物种丰富度(shannon指数)
3.2 亚表层土壤微生物群落结构变化的原因分析
秸秆还田在一定程度上改变了微生物的群落分布,在不同秸秆形态处理中,以切碎秸秆处理与CK差异较大;在不同秸秆用量处理中,以高量还田差异较大。这主要是因为不同秸秆还田处理引起土壤环境因子的改变,最终促使微生物群落分布特征出现差异[45]。本研究发现,秸秆还田对土壤环境因子的影响逐年改变,从而使影响微生物群落的主要要素发生更替。秸秆还田1 a,微生物群落结构的分异要素以秸秆形态为主,土壤容重(SBD)、pH、全氮(TN)与碳氮比(C/N)是影响微生物群落结构的显著因素(<0.05),该阶段碳源充足,腐解菌的增殖以及活性以通气状况和氮源为主要限制因素,秸秆翻埋进入亚表层改变了其孔隙结构,使亚表层半厌氧环境中的氧气增多,对于多数好氧的腐解菌群[46]来说利于其大量繁殖,然而玉米秸秆为高C/N植物残体,降解时易与土壤争夺氮素,故除能反映土壤孔隙结构的SBD外,TN也成为影响菌群分布的显著因素。pH在调节微生物群落结构及多样性上也具有重要作用[47],多数微生物适宜的pH在6.5~7.5,秸秆还田第1年土壤pH的降低以及可利用碳源的复杂性高均在一定程度上利于真菌生存[38-39]。切碎秸秆的土壤菌群PLFA数量最高,尤其是真菌数量的显著增加,表明切碎秸秆对微生物群落结构的调控能力更强,这与其对土壤理化因子的显著影响有关。秸秆还田2 a,微生物群落结构的分异要素以秸秆用量为主,土壤含水量(SWC)、土壤有机碳(SOC)、C/N与SBD是影响微生物群落结构的极显著因素(<0.01),TN为显著因素(<0.05),这主要是因为随着秸秆的腐解,其保水能力逐渐降低[48],水分逐渐成为菌群生长的限制因子;低量秸秆还田在第一年已腐解大部分,微生物可分解利用的新鲜碳源减少,而高量还田为微生物生命活动提供了充足碳源以及较高C/N,促使微生物结构的进一步改变。秸秆还田第三年,土壤微生物群落结构对土壤环境因子的响应不敏感,这与王晓玥等[43]的研究相似,这是因为3 a来的农机具压实、淋溶作用以及秸秆的腐解共同削弱了秸秆还田对土壤理化因子的影响,各处理的理化因子水平与CK差异缩小(表4),其中仅SOC仍具有显著影响(<0.05),表明了一次性秸秆高量还田后SOC的缓慢累积可能是导致后期真菌含量提升的主要原因。需要指出的是,前期试验证实秸秆颗粒虽然较切碎秸秆有更高的养分释放速率,但是本研究中发现其还至亚表层时对SOC、TN及微生物群落结构的调控能力不及切碎秸秆,这与在我们在黄淮海地区的研究[49]不一致,究其原因可能有二,一是黑土地区以雨养农业为主,降水量偏少,秸秆颗粒只有吸水后才能膨散开,才有利于养分释放;二是当地纬度较高,黑土亚表层冬季出现冻融现象,秸秆颗粒受冻融影响后不易膨散。由此看来,秸秆颗粒在黑土地区的施用可能更适宜于耕层浅还田,耕层土壤最先吸纳利用水分,更易发挥秸秆颗粒可大量还田以及快速释放养分的优势。
4 结 论
两种形态的玉米秸秆深还田可不同程度地提高亚表层土壤磷脂脂肪酸(PLFA)总量、细菌及真菌摩尔百分数,但对放线菌有降低作用。
切碎秸秆处理较颗粒秸秆处理更利于促进真菌群落的形成。随还田时间的增加,高量还田的革兰氏阳性菌(G+):革兰氏阴性菌(G-)提高更显著,利于长期维持生态系统稳定性。
土壤理化因子的改变是引起土壤微生物群落结构分异的重要原因。第1年,土壤容重(SBD)、pH、全氮(TN)与碳氮比(C/N)是引起微生物群落结构分异的显著性因子(<0.05);第2年,土壤含水量(SWC)、土壤有机碳(SOC)、C/N与SBD为极显著因子(<0.01);第3年,SOC为显著性因子(<0.05)。
总之,QS5处理对黑土亚表层理化因子的改善最为显著,对真菌群落结构的调控能力更强,更适宜于东北黑土亚表层土壤生物学肥力的改善。
[1] Breulmann M, Masyutenko N P, Kogut B M, et al. Short-term bioavailability of carbon in soil organic matter fractions of different particle sizes and densities in grassland ecosystems[J]. Science of Total Environment, 2014, 497: 29-37.
[2] Cusack D F, Silver W L, Torn M S, et al. Changes in microbial community characteristics and soil organic matter with nitrogen additions in two tropical forests[J]. Ecology, 2011, 92(3): 621-632.
[3] Garbeva P, Veen J A V, Elsas J D V. Microbial diversity in soil: selection of microbial populations by plant and soil type and implications for soil suppressiveness[J]. Annual Review of Phytopathology, 2004, 42: 243-270.
[4] Janvier C, Villeneuve F, Alabouvette C, et al. Soil health through soil disease suppression: which strategy from descriptors to indicators[J]. Soil Biology & Biochemistry, 2007, 39(1): 1-23.
[5] Allison V J, Miller R M, Jastrow J D, et al. Changes in soil microbial community structure in a tallgrass prairie chronosequence[J]. Soil Science Society of America Journal, 2005, 69(5): 1412.
[6] Buyer J S, Teasdale J R, Roberts D P, et al. Factors affecting soil microbial community structure in tomato cropping systems[J]. Soil Biology & Biochemistry, 2010, 42(5): 831-841.
[7] Kirkegaard J A, Lilley J M, Howe G N, et al. Impact of subsoil water use on wheat yield[J]. Australia Journal of Agriculture Research, 2007, 58(4): 303-315.
[8] 刘爽,何文清,严昌荣. 不同耕作措施对旱地农田土壤物理特性的影响[J]. 干旱地区农业研究,2010,28(2):65-69.
Liu Shuang, He Wenqing, Yan Changrong. Effects of different tillage managements on soil physical properties in dryland[J]. Agricultural Research in the Arid Areas, 2010, 28(2): 65-69. (in Chinese with English abstract)
[9] Liu Xiaobing, Han Xiaozeng, Song Chunyu, et al. Soil organic carbon dynamics in black soils of China under different agricultural management systems[J]. Communications in Soil Science and Plant Analysis, 2003, 34(7/8): 973-984.
[10] 龚子同,张之一,张甘霖. 草原土壤:分布、分类与演化[J]. 土壤,2009,41(4):505-511.
Gong Zitong, Zhang Zhiyi, Zhang Ganlin. Grassland soils: Distribution, classification and evolution[J]. Soils, 2009, 41(4): 505-511. (in Chinese with English abstract)
[11] 刘武仁,郑金玉,罗洋,等. 东北黑土区发展保护性耕作可行性分析[J]. 吉林农业科学,2008,33(3):3-4,13.
Liu Wuren, Zheng Jinyu, Luo Yang, et al. Feasible analysis of developing conservation tillage in black soil zone of Northeastern China[J]. Journal of Jilin Agricultural Sciences, 2008, 33(3): 3-4,13. (in Chinese with English abstract)
[12] 窦森. 玉米秸秆“富集深还”与土壤亚表层培肥[J]. 植物营养与肥料学报,2017,23(6):1670-1675.
Dou Sen. Improving subsoil fertility through a new technology of continuous in belt and deep incorporation of corn stover[J]. Journal of Plant Nutrition and Fertilizer, 2017, 23(6): 1670-1675. (in Chinese with English abstract)
[13] 韩晓增,邹文秀,王凤仙,等. 黑土肥沃耕层构建效应[J].应用生态学报,2009,20(12):2996-3002.
Han Xiaozeng, Zou Wenxiu, Wang Fengxian, et al. Construction effect of fertile cultivated layer in black soil[J]. Chinese Journal of Applied Ecology, 2009, 20(12): 2996-3002. (in Chinese with English abstract)
[14] 丛萍,李玉义,王婧,等. 不同用量秸秆深还对提高亚表层土壤肥力质量的影响[J]. 植物营养与肥料学报,2019. doi:10.11674/zwyf.19043
Cong Ping, Li Yuyi, Wang Jing, et al. The feasibility of improving the subsoil fertility quality by incremental-deep straw application[J]. Journal of Plant Nutrition and Fertilizer, 2019. doi:10.11674/zwyf.19043 (in Chinese with English abstract)
[15] 蔡丽君,张敬涛,盖志佳,等. 免耕条件下秸秆还田量对土壤酶活性的影响[J]. 土壤通报,2015,46(5):1127-1132.
Cai Lijun, Zhang Jingtao, Gai Zhijia, et al. Effect of the amount of stalk return to field on soil enzyme activities under no-tillage[J]. Chinese Journal of Soil Science, 2015, 46(5): 1127-1132. (in Chinese with English abstract)
[16] 陈冬林,易镇邪,周文新,等. 不同土壤耕作方式下秸秆还田量对晚稻土壤养分与微生物的影响[J]. 环境科学学报,2010,30(8):1722-1728.
Chen Donglin, Yi Zenxie, Zhou Wenxin, et al. Effects of straw return on soil nutrients and microorganisms in late rice under different soil tillage systems[J]. Acta Scientiae Circumstantiae, 2010, 30(8): 1722-1728. (in Chinese with English abstract)
[17] Koullas D P, Christakopoulos P, Kekos D, et al. Correlating the effect of pretreatment on the enzymatic hydrolysis of straw[J]. Biotechnology and Bioengineering, 1992, 39(1): 113-116.
[18] Wang Jingjing, Zhang Huiwen, Li Xinyu, et al. Effects of tillage and residue incorporation on composition and abundance of microbial communities of a fluvo-aquic soil[J]. European Journal of Soil Biology, 2014, 65: 70-78.
[19] Zhao Shicheng, Li Kejiang, Zhou Wei, et al. Changes in soil microbial community, enzyme activities and organic matter fractions under long-term straw return in north-central China[J]. Agriculture Ecology Environment, 2016, 216: 82-88.
[20] Guo Lijin, Zhang Zhisheng, Wang Dandan, et al. Effects of short-term conservation management practices on soil organic carbon fractions and microbial community composition under a rice-wheat rotation system[J]. Biology and Fertility of Soils, 2014, 51(1): 65-75.
[21] 王婧,张莉,逄焕成,等. 秸秆颗粒化还田加速腐解速率提高培肥效果[J]. 农业工程学报,2017,33(6):177-183.
Wang Jing, Zhang Li, Pang Huancheng, et al. Returning granulated straw for accelerating decomposition rate and improving soil fertility[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(6): 177-183. (in Chinese with English abstract)
[22] Zhang Li, Wang Jing, Pang Huancheng, et al. Effects of pelletized straw on soil nutrient properties in relation to crop yield[J]. Soil Use and Management, doi: 10.1111/sum.12450.
[23] 矫丽娜,李志洪,殷程程,等. 高量秸秆不同深度还田对黑土有机质组成和酶活性的影响[J]. 土壤学报,2015,52(3):665-672.
Jiao Lina, Li Zhihong, Yin Chengcheng, et al. Effect of incorporation of crop straw on composition of soil organic matter and enzyme activity in black soil relative to depth and rate of the incorporation[J]. Acta Pedologica Sinica, 2015, 52(3): 665-672. (in Chinese with English abstract)
[24] Ren Chengjie, Zhao Fazhu, Kang Di, et al. Linkages of C:N:P stoichiometry and bacterial community in soil following afforestation of former farmland[J]. Forest Ecology and Management, 2016, 376: 59-66.
[25] Frostegard A, Tunlid A, Baath E. Microbial biomass measured as total lipid phosphate in soils of different organic content[J]. Journal of Microbialogical Methods, 1991, 14(3): 151-163.
[26] Green C T, Scow K M. Analysis of phospholipid fatty acids (PLFA) to characterize microbial communities in aquifers[J]. Hydrogeology Journal, 2000, 8(1): 126-141.
[27] Ai Chao, Liang Guoqing, Sun Jingwen, et al. The alleviation of acid soil stress in rice by inorganic or organic ameliorants is associated with changes in soil enzyme activity and microbial community composition[J]. Biology and Fertility of Soils, 2015, 51(4): 465-477.
[28] 张倩. 长期施肥下稻麦轮作体系土壤团聚体碳氮转化特征[D]. 北京:中国农业科学院,2017.
Zhang Qian. Transformation of Carbon and Nitrogen in Soil Aggregates as Affected by Long-term Fertilization in a Rice-wheat Rotation System[D]. Beijing: Chinese Academy of Agricultural Science, 2017. (in Chinese with English abstract)
[29] De Vries F T, Hoffland E, Eekeren N V, et al. Fungal/bacterial ratios in grasslands with contrasting nitrogen management[J]. Soil Biology and Biochemistry, 2006, 38(8): 2092-2100.
[30] Fierer N, Schimel J P, Holden P A, et al. Variations in microbial community composition through two soil depth profiles[J]. Soil Biology and Biochemistry, 2003, 35(1): 167-176.
[31] 李倩,李晓秀,吴会军,等. 不同气候和施肥条件下保护性耕作对农田土壤碳氮储量的影响[J]. 植物营养与肥料学报,2018,24(6):1539-1549.
Li Qian, Li Xiaoxiu, Wu Huijun, et al. Effects of conservation tillage practices on soil carbon and nitrogen stocks in farmland under different climatic types and fertilization conditions[J]. Journal of Plant Nutrition and Fertilizers, 2018, 24(6): 1539-1549. (in Chinese with English abstract)
[32] Vestal J R, White D C. Lipid analys is in microbial eology: Quantitative approaches to the study of microbial communities[J]. Biology Seienee, 1989, 39: 535-541.
[33] Lou Yilai, Liang Wenju, Xu Minggang, et al. Straw coverage alleviates seasonal variability of the topsoil microbial biomass and activity[J]. Catena, 2011, 86(2): 117-120.
[34] 于寒,梁烜赫,张玉秋,等. 不同秸秆还田方式对玉米根际土壤微生物及酶活性的影响[J]. 农业资源与环境学报,2015,32(3):305-311.
Yu Han, Liang Xuanhe, Zhang Yuqiu, et al. Effects of different straw returning modes on the soil microorganism and enzyme activity on corn yield[J]. Journal of Agricultural Resources and Environment, 2015, 32(3): 305-311. (in Chinese with English abstract)
[35] 孙冰洁. 不同耕作方式下土壤微生物在黑土有机碳固定中的作用研究[D]. 沈阳:中国科学院研究生院(东北地理与农业生态研究所),2016.
Sun Bingjie. Effects of Soil Microorganisms on Organic Carbon Sequestration in Black Soil under Different Tillage Practices[D]. Shenyang: Northeast Institute of Geography and Agri-Ecology, Chinese Academy of Sciences, 2016. (in Chinese with English abstract)
[36] Nunan N, Wu K, Young I M, et al. Spatial distribution of bacterial communities and their relationships with the micro–architecture of soil[J]. FEMS Microbiology Ecology, 2003, 44(2): 203-215.
[37] 徐广印,沈胜强,胡建军,等. 秸秆冷态压缩成型微观结构变化的实验研究[J]. 太阳能学报,2010,31(3):273-278.
Xu Guangyin, Shen Shengqiang, Hu Jianjun, et al. Experimental study on the micro structure changes in the process of cold molding with straw[J]. Acta Energiae Solaris Sinica, 2010, 31(3): 273-278. (in Chinese with English abstract)
[38] Poll C, Marhan S, Ingwersen J, et al. Dynamics of litter carbon turnover and microbial abundance in a rye detritusphere[J]. Soil Biology & Biochemistry, 2008, 40(6): 1306-1321.
[39] Wei Meng, Hu Guoqing, Wang Hui, et al. 35 years of manure and chemical fertilizer application alters soil microbial community composition in a Fluvo-aquic soil in Northern China[J]. European Journal of Soil Biology, 2017, 82: 27-34.
[40] Badin A L, Mustafa T, Bertrand C, et al. Microbial communities of urban stormwater sediments: The phylogenetic structure of bacterial communities varies with porosity[J]. FEMS Microbiology Ecology, 2012, 81(2): 324-338.
[41] Helgason B L, Gregorich E G, Janzen H H, et al. Long–term microbial retention of residue C is site–specific and depends on residue placement[J]. Soil Biology & Biochemisty, 2014, 68: 231-240.
[42] 张斯童,兰雪,李哲,等. 微生物降解玉米秸秆的研究进展[J]. 吉林农业大学学报,2016,38(5):517-522.
Zhang Sitong, Lan Xue, Li Zhe, et al. Research progress of microbial degradation of corn straw[J]. Journal of Jilin Agricultural University, 2016, 38(5): 517-522. (in Chinese with English abstract)
[43] 王晓玥,蒋瑀霁,隋跃宇,等. 田间条件下小麦和玉米秸秆腐解过程中微生物群落的变化:BIOLOG分析[J]. 土壤学报,2012,49(5):1003-1011.
Wang Xiaoyue, Jiang Yuji, Sui Yueyu, et al. Changes of microbial communities during decomposition of wheat and maize straw: analysis by biology[J]. Acta Pedologica Sinica, 2012, 49(5): 1003-1011. (in Chinese with English abstract)
[44] 张红. 植物秸秆腐解特性及微生物多样性的响应研究[D].西安:西北农林科技大学,2017.
Zhang Hong. The Response of Plant Straws Decomposition Characteristics and Microbial Diversity[D]. Xi’an: Northeast A&F University, 2017. (in Chinese with English abstract)
[45] 王芳. 秸秆腐解的微生物群落演替过程研究[D]. 西安:西北农林科技大学,2019.
Wang Fang. The Study on the Microbial Community Succession of Straw Decomposition[D]. Xi’an: Northeast A&F University, 2019. (in Chinese with English abstract)
[46] 王秀红,李欣欣,史向远,等. 好氧堆肥微生物代谢多样性及其细菌群落结构[J]. 环境科学研究,2018,31(8):1457-1463.
Wang Xiuhong, Li Xinxin, Shi Xiangyuan, et al. Microbial metabolism diversity and bacterial flora structure during aerobic composting[J]. Research of Environmental Sciences, 2018, 31(8): 1457-1463. (in Chinese with English abstract)
[47] Merilä Päivi, MalmivaaraLämsä Minna, Spetz Peter, et al. Soil organic matter quality as a link between microbial community structure and vegetation composition along a successional gradient in a boreal forest[J]. Applied Soil Ecology, 2010, 46(2): 259-267.
[48] Xie Lihua, Liu Mingzhu, Ni Boli, et al. Utilization of wheat straw for the preparation of coated controlled-release fertilizer with the function of water retention[J]. Journal of Agricultural and Food Chemistry, 2012, 60(28): 6921-6928.
[49] 丛萍,李玉义,高志娟,等. 秸秆颗粒化高量还田快速提高土壤有机碳含量及小麦玉米产量[J]. 农业工程学报,2019,35(1):148-156.
Cong Ping, Li Yuyi, Gao Zhijuan, et al. High dosage of pelletized straw returning rapidly improving soil organic carbon content and wheat-maize yield[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(1): 148-156. (in Chinese with English abstract)
Effects and analysis of straw returning on subsoil microbial community structure in black soil
Cong Ping1,2, Wang Jing1, Dong Jianxin2, Li Yuyi1, Liu Na1, Pang Huancheng1※
(1.100081,; 2.266100,)
The subsoil layer is an important plow layer between topsoil and bottom soil. It is also an important crop root distribution area. However, long-term rotary tillage caused a thick plow pan in the subsoil layer of black soil in Northeast China, which seriously affected the operation of water, fertilizer, gas, and heat in the soil. As is known to all, straw returning is a win-win measure that can not only fertilize the soil but also ensure the utilization of waste resources. Chopped straw is a common way for local farmers to return to the field, while the pelletized straw return is a novel straw return management and is made of straw after highly comminuted and extruded. Our previous research proved that these two forms of deep straw return had a good effect on subsoil physicochemical properties. However, their effects on soil microbial community structure of the subsoil layer were still unknown. To clarified the effect of chopped straw and pelletized straw on soil microbial community structure in subsoil layer of the black soil, then, evaluated the effect of maize straw returning on fertilization of subsoil layer, a one-time deep straw returning experiment was conducted in the black soil of Northeast China from 2016 to 2018. There were five treatments in this experiment, including chopped straw with low dosage (QS1), chopped straw with high dosage (QS5), pelletized straw with low dosage (KL1), pelletized straw with high dosage (KL5), and no straw returning (CK). The contents of soil microbial flora phospholipid fatty acid, soil bulk density, soil water content, pH, soil organic carbon and total nitrogen were measured in the maize harvest season. The results showed that the microbial flora total phospholipid fatty acid content and fungi phospholipid fatty acid content were significantly increased by chopped straw treatments in the first year of straw returning, with a high dosage increasing up to 71.0% and 120.5%. The phospholipid fatty acid content of bacteria, Gram-positive bacteria and Gram-negative bacteria increased more significantly by pelletized treatment, with high dosage treatment up to 41.6%, 29.7% and 26.3%, and the phospholipid fatty acid content of fungi significantly increased in the second year. The phospholipid fatty acid content of each flora, especially the fungal phospholipid fatty acid content of chopped straw with high dosage treatment, was significantly higher than that of pelletized straw with high dosage treatment (21.0%), and only the flora with high dosage straw return had significant changes in the third year. Chopped straw treatment significantly increased the fungi-bacteria ratio in the early stage of straw returning, while low dosage straw returning increased the Gram-positive bacteria: Gram-negative bacteria ratio. With time increasing, the ratio of high dosage straw return increased more significantly, which was conducive to long-term maintenance of ecosystem stability. High dosage of straw returning could significantly change the level of soil physical and chemical factors, which was an important reason for the differentiation of microbial community structure. The significant soil factors changed with the years of straw returning. In the first year, the significant factors were soil bulk density, pH, total nitrogen and C:N ratio (<0.05), in the second year, the significant factors were soil water content, soil organic carbon, C:N ratio and soil bulk density (<0.01), and soil organic carbon was the only significant factor in the third year (<0.05). In conclusion, chopped straw with high dosage treatment had the most obvious difference between microbial community structure and CK, and had a stronger ability to regulate subsoil fungal community. It was more suitable for the improvement of the subsoil fertility of black soil and promoted the resource utilization of straw in Northeast China.
soils; straw; microbial community structure; deep returning; subsoil
丛 萍,王 婧,董建新,李玉义,刘 娜,逄焕成. 秸秆还田对黑土亚表层微生物群落结构的影响特征及原因分析[J]. 农业工程学报,2020,36(1):109-118.doi:10.11975/j.issn.1002-6819.2020.01.013 http://www.tcsae.org
Cong Ping, Wang Jing, Dong Jianxin, Li Yuyi, Liu Na, Pang Huancheng. Effects and analysis of straw returning on subsoil microbial community structure in black soil[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(1): 109-118. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.01.013 http://www.tcsae.org
2019-09-02
2019-12-23
国家重点研发计划2016YFD0300804,旱地保护性耕作及其农艺化机械作业技术(2016~2020)
丛 萍,助理研究员,博士,从事土壤耕作与培肥技术研究。Email:cpqdjz@126.com
逄焕成,研究员,博士,从事合理耕层构建以及盐碱地改良利用。Email:panghuancheng@caas.ac.cn
10.11975/j.issn.1002-6819.2020.01.013
S154.3
A
1002-6819(2020)-01-0109-10
