大孔树脂纯化黄精多酚及其抗氧化性与组成分析
2020-03-03巫永华张建萍赵节昌陈安徽刘恩岐
巫永华,张建萍,赵节昌,陈安徽,邵 颖,刘恩岐
大孔树脂纯化黄精多酚及其抗氧化性与组成分析
巫永华,张建萍,赵节昌,陈安徽,邵 颖,刘恩岐※
(徐州工程学院 江苏省食品资源开发与质量安全重点建设实验室,徐州 221018)
考察4种树脂对黄精多酚粗提物的吸附-解吸特性,筛选出最佳的纯化树脂,并研究其纯化工艺,分析黄精多酚的体外抗氧化活性、红外光谱特性和单酚组成。结果表明,AB-8型大孔树脂最适合于对黄精多酚粗提液的纯化,静态吸附5 h达到饱和,静态解吸3 h达到平衡;在室温下,用质量浓度为0.80 mg/mL 的黄精多酚粗提液以 0.8 mL/min 的流速上样;吸附平衡后以70%的乙醇为洗脱剂,在洗脱流速为1 mL/min时,大孔树脂纯化效果最好,经纯化后黄精多酚的纯度提高了3.37倍。黄精多酚具有较好的抗氧化能力,且具有良好的量效关系,纯化前后黄精多酚总还原能力的IC50值分别为(27.48±1.93)、(19.01±1.48)g/mL,清除DPPH•的IC50值依次为(5.21±0.48)、(4.00±0.26)g/mL,清除ABTS+•的IC50值依次为(4.89±0.82)、(4.21±0.53)g/mL,经纯化后黄精多酚的抗氧化活性明显增强。红外光谱分析表明其具有多酚和黄酮的特征峰;HPLC-DAD分析表明,黄精多酚主要含绿源酸,阿魏酸,芦丁和熊果酸。
多酚;树脂;纯化;黄精;抗氧化活性;组成分析
0 引 言
黄精()作为中国传统的一种药食同源植物,具有补气滋阴,补肾,益脾,润肺等功效[1]。研究人员从黄精中获得了多糖、黄酮类、皂苷类、生物碱、木质素和氨基酸等活性成分[2],大量研究表明黄精的抗氧化、抗疲劳、降血糖、降血脂、延缓衰老、改善记忆力和抗病毒、提高免疫力、抗肿瘤、促进成骨细胞分化和促进睡眠等功能与其活性物质密切相关[3-7]。课题组前期研究发现黄精中含有一定量的多酚类化合物,并优化了闪式提取法提取黄精多酚的工艺,抗氧化试验显示其多酚粗提物具有较好的抗氧化能力[8-9]。但由于多酚粗提液中含有大量的糖类和少量的蛋白质、生物碱等杂质,对其生理活性的评价往往准确性不够,无法判断其生物活性的构效关系和作用机制,因此探讨合适的方式分离纯化以获得纯度较高的目标组分,并评价其生理功能和结构鉴定是重要的研究方向。
在对天然活性化合物的分离纯化中,大孔吸附树脂因其具有良好的吸附选择性和稳定性,不易受酸碱和杂质的影响,同时还有吸附量大、吸附解吸条件温和、操作简单、安全性好和可回收再生、使用周期长、有利于大规模生产等优点而被国内外学者所关注[10-11]。众多研究表明,不同的大孔吸附树脂对不同来源的多酚物质有吸附选择性,Guo等[12]研究表明猕猴桃果皮提取物中多酚类物质经NKA-II树脂纯化后纯度由33.2% 提高到了55.26%。Gao等[13]考察大孔吸附树脂纯化野樱莓多酚时,发现XAD-7树脂的纯化效果最好。张卉等[14]优化了XAD-7树脂纯化黑果腺肋花楸多酚的工艺条件,经纯化后多酚纯度由9.56%提高到了74.26%。王艳丽等[15]研究表明AB-8树脂可以较好地纯化酸浆果实多酚。采用大孔吸附树脂对黄精多酚类化合物的研究未见报道,试验考察4种大孔吸附树脂对黄精粗多酚的纯化效果,筛选最佳的纯化树脂,并进行纯化工艺优化,分析纯化后黄精多酚的抗氧化活性、红外光谱特性和多酚组成,为黄精多酚类物质生物活性的构效分析和在功能性食品、药品和化妆品中的利用提供一定的科学依据。
1 材料与方法
1.1 材料与试剂
黄精,安徽亳州千草药业有限公司提供;AB-8树脂,天津波鸿树脂科技有限公司;NKA-9树脂,天津浩聚树脂科技有限公司;抗坏血酸、SP-825、XAD-2树脂,上海源叶生物科技有限公司;DPPH,美国sigma公司;ABTS,Amresco公司;溴化钾(光谱纯),美国Acros Organics公司;其余试剂均为分析纯。
1.2 仪器与设备
ZHBE-50T闪式提取器,河南智晶生物科技发展有限公司;R206旋转蒸发仪,上海申生科技有限公司;1260Ⅱ高效液相色谱仪,美国安捷伦科技有限公司;HH-1恒流泵,上海嘉鹏科技有限公司;BSZ-100自动部分收集器,上海沪西分析仪器厂;TU-1810紫外分光光度计,北京普析通用有限公司;L550离心机,湖南湘仪离心机仪器有限公司;Nicolet iS10傅里叶红外光谱仪,美国Thermo fisher公司。
1.3 试验方法
1.3.1 黄精粗多酚的制备
用粉碎机将黄精粉碎,过80目筛,用自封袋包装,置于干燥器中保存,备用。参照课题组前期获得的方法制备黄精多酚[9]。取适量的黄精粉于提取罐,按质量体积比为1:20(g/mL),加入50%乙醇,在电压为150 V下提取35 s,抽滤,滤渣再重复提取一次,合并2次滤液后真空浓缩至一定体积后加入无水乙醇至醇浓度为80%,4 ℃下静置过夜后离心,上清液浓缩后冷冻干燥,得到黄精粗多酚粉,置于−20 ℃下保存,备用。
1.3.2 大孔树脂的预处理
参照陈纯[16]的方法并稍作修改,将AB-8、NKA-9、SP-825和XAD-2 4种不同的大孔树脂分别置于无水乙醇中浸泡24 h后,用纯水淋洗至无乙醇味,再用5%NaOH溶液浸泡6 h,用纯水洗至洗出液为中性,最后用5%HCl溶液浸泡6 h,再用纯水洗至中性,抽滤,备用。
1.3.3 最佳纯化树脂的筛选
参照吴兰兰[17]报道的方法略有改动,通过静态吸附、解吸试验筛选出对黄精多酚分离性能良好的树脂。准确称取上述树脂各10.00 g,分别加入200 mL质量浓度为1.5 mg/mL的黄精多酚粗提液,于25 ℃、100 r/min下振荡24 h,使其吸附饱和,测定上清液中的总酚含量。抽滤去除上清液后,加入100 mL、70%的乙醇,同样条件下洗脱24 h,测定上清液中的总酚含量。按公式(1)和(2)计算树脂的吸附、解吸率:
吸附率/%=(0−1)/0×100%(1)
解吸率/%=2/(0−1)×100%(2)
式中0为初始多酚质量浓度,mg/mL;1为吸附后上清液中的多酚质量浓度,mg/mL;2:解吸后洗脱液中多酚的质量浓度,mg/mL。
1.3.4 AB-8树脂静态吸附-解吸试验
1)AB-8树脂吸附和解吸时间的确定
取10.00 g预处理好的AB-8树脂,加入质量浓度为1.5 mg/mL的样品液200 mL,在25 ℃、100 r/min下水浴振荡,每隔1 h测上清液的多酚含量,至浓度无明显变化为止。倒去上清液,加入70%的乙醇200 mL,在25 ℃、100 r/min下水浴振荡,每隔1 h测定洗脱液中的多酚含量,至浓度无明显变化为止,分别计算吸附和解吸率,确定最佳的吸附和解吸时间。
2)多酚初始浓度对树脂吸附效果的影响
取10.00 g预处理好的AB-8树脂7份,分别加入200 mL的质量浓度为0.4、0.6、0.8、1.0、1.2、1.4、1.6 mg/mL的黄精粗多酚溶液,在25 ℃、100 r/min下水浴振荡2 h,测定上清液中多酚的含量,计算吸附率。
3)乙醇浓度对树脂解吸效果的影响
取10.00 g预处理好的AB-8树脂5份,分别加入质量浓度为0.8 mg/mL的样品液200 mL,在25 ℃、100 r/min下水浴振荡2 h,测定上清液中多酚的含量。抽滤去除上清液后分别加入50%、60%、70%、80%、90%的乙醇200 mL,在25 ℃、100 r/min下水浴振荡3 h,测定洗脱液中的多酚含量,计算解吸率。
1.3.5 AB-8树脂动态吸附-解吸试验
1)上样流速对树脂吸附效果的影响
称取适量经处理好的AB-8树脂,采用湿法装柱的方式装入玻璃层析柱(2.0 cm×50 cm),以1 mL/min速度泵入纯水1h,待树脂柱平衡后,将质量浓度为0.8 mg/mL 的样液分别以0.4、0.8、2.4 mL/min的流速上柱,使用自动收集器以每10 mL为一管收集流出液,测定流出液中的多酚浓度。
2)洗脱速度对树脂解吸效果的影响
在多酚质量浓度为0.8 mg/mL上样速度为0.8 mL/min条件下上样40 mL,吸附2 h后,用70%的乙醇在洗脱速度分别为0.5、1.0、1.5 mL/min下洗脱,每6 mL为一管收集流出液,测定其多酚浓度。
1.3.6 总酚含量的测定
参考文献[9]的方法。配制质量浓度为0.10 mg/mL的没食子酸标准液,分别吸取0、0.5、1.0、1.5、2.0、2和5 mL标准溶液于25 mL棕色容量瓶中,分别加入纯水10 mL和福林-酚试剂1 mL后,摇匀,再加入7%的Na2CO3溶液10 mL,漩涡振荡混匀后定容,在室温、黑暗条件下放置30 min,测定765nm下的吸光值,绘制标准曲线,其回归方程为=0.0921+0.0346,2= 0.9983。
1.3.7 黄精多酚抗氧化活性的研究
1)还原能力的测定
参考文献[9]的方法。在预试验的基础上,取不同质量浓度的样品溶液1 mL,分别加入0.2 moL/L磷酸缓冲溶液(pH 值6.6) 1 mL和1%的铁氰化钾溶液1 mL,漩涡振荡混匀后于50 ℃下反应20min,加入10%三氯乙酸溶液1 mL,混匀后3000 r/min离心10 min,取上清液2.5 mL,加入纯水2.5 mL和0.1%氯化亚铁溶液0.5 mL,混匀后测定700 nm处的吸光度,并以抗坏血酸作阳性对照。
2)DPPH•清除能力的测定
参考文献[9]的方法。在预试验的基础上,取不同质量浓度的样品溶液2 mL,分别加入质量浓度为0.025 mg/mL的DPPH溶液2.0 mL,在室温、黑暗条件下放置30 min后,于4000 r/min离心10 min,于517 nm处测定上清液吸光值,按式(3)计算DPPH•清除率,并以抗坏血酸作阳性对照。
DPPH•清除率/%=[1−(1−2)/0]×100%(3)
式中0为2 mL乙醇与2 mL DPPH溶液混合液的吸光值;1为2 mL样品溶液与2 mL DPPH溶液混合液的吸光值;2为2 mL样品溶液与2 mL乙醇混合液的吸光值
3)ABTS+•清除能力的测定
参考文献[9]的方法。在预试验的基础上,取不同质量浓度的样品溶液0.2 mL,分别加入ABTS溶液4.8 mL,在室温、黑暗条件下放置15 min后,测定734 nm处的吸光值。按式(4)计算ABTS+•清除率,并以抗坏血酸作阳性对照。
ABTS+•清除率/%=[1−(1−2)/0]×100%(4)
式中0为0.2 mL乙醇与4.8 mL ABTS溶液混合液的吸光值;1为0.2 mL样品溶液与4.8 mL ABTS溶液混合液的吸光值;2为0.2 mL样品溶液与4.8 mL乙醇混合液的吸光值。
1.3.8 黄精多酚的FT-IR分析
取黄精多酚纯化物冻干粉1~2 mg与200 mg烘干后的溴化钾混合均匀,用玛瑙研钵研磨至粒径小于2m。用压片机压成均匀透明的薄片后,在波长4000~400 cm-1范围内扫描,获得FT-IR图。
1.3.9 高效液相色谱法分析黄精多酚单酚组分及含量
分别用称取20 mg的没食子酸、儿茶素、绿原酸、咖啡酸、表儿茶素、阿魏酸、芦丁、槲皮素、山奈酚和熊果酸,用甲醇溶解,配成质量浓度为0.5 mg/mL的单一标准液,各取120L混合配成10种物质的混合标准品,分别用0.22m 滤膜过滤后用于HPLC检测。样品用甲醇溶解后,用0.22m滤膜过滤后检测。
分析条件:采用安捷伦1260ⅡHPLC 系统,二极管阵列(DAD)检测器,自动进样器进样,Agilent C18色谱柱(250 mm×4.6 mm,5m)。参考史斌斌[18]的方法,并根据预试验结果稍作修改,流动向A为0.8%乙酸,B为甲醇,柱温28 ℃,进样量20L,流速0.9 mL/min。流动相洗脱方法见表1所示。

表1 流动相梯度洗脱比例
1.3.10 数据处理与统计分析
所有试验均重复3次以上,数据处理、绘图采用Excel 2010软件,数据差异性分析使用SPSS 18.0 软件;IC50值由曲线增长阶段拟合线性方程后计算。
2 结果与分析
2.1 4种大孔树脂对黄精多酚吸附和解吸性能的比较
不同的大孔树脂由于其极性、比表面积和孔径等不同,对天然产物会表现出不同的吸附和解吸性能。图1显示所选的4种大孔吸附树脂对黄精多酚的吸附解吸效果,由图可知,AB-8树脂对黄精多酚粗提液的吸附率为85.72%,显著高于其他型号树脂(<0.05)。解吸试验表明AB-8树脂的解吸效果显著高于NKA-9和SP-825(<0.05),与XAD-2无显著差异。可能是AB-8树脂具有较大的比表面积,更适宜吸附黄精多酚类分子,同时AB-8树脂为弱极性,可以更好的把黄精多酚从柱子上解吸下来。由于多酚类化合物的分子中含有多个酚羟基结构,其分子的极性不高,所以弱极性或非极性的树脂吸附效果较好[19]。因此,选择AB-8大孔树脂作为分离纯化黄精多酚的最佳树脂。刘军伟报道认为AB-8树脂对生姜多酚具有较好的纯化方式[20];马双双[21]对莲子壳多酚的纯化研究和尚丹对香蕉皮多酚的纯化[22]也得出了相同结果。不同的是艾志录等[23]认为NKA-9树脂能更好的富集纯化苹果多酚;陶莎等[24]研究认为HPD 600树脂对红小豆多酚纯化效果较佳,不同的结果可能是由于多酚的来源不同,其结构性质不一样导致的。
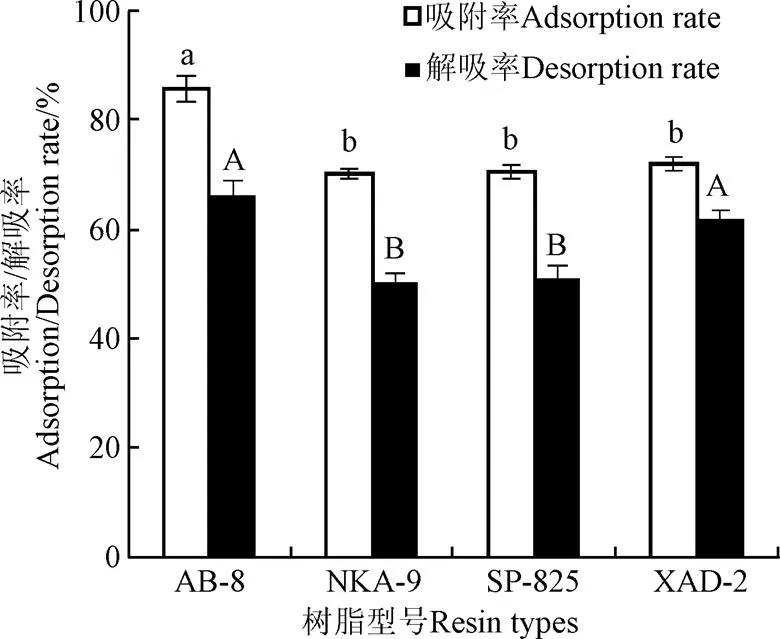
注:同一指标不同字母代表差异显著,下同
2.2 AB-8树脂静态吸附—解吸试验结果
2.2.1 树脂吸附和解吸时间的确定
1)吸附时间的确定
大孔树脂的吸附是利用树脂多孔网状结构和高比表面积形成的分子筛作用,也与树脂和目标物之间的范德华引力或氢键缔合能力有关[25],吸附时间会影响其吸附效果。由图2a可见,在吸附开始的2 h内,多酚的吸附率迅速上升至(76.43±1.67)%,随后3 h缓慢上升至吸附饱和状态,其吸附率为(84.25±1.02)%,随后吸附率无明显变化。故选择5 h为最佳吸附时间。
2)解吸时间的确定
由图2b可见,在解吸开始的3 h 内,多酚的解吸率迅速上升,随后逐渐趋于平稳。故认为在解吸3 h时解吸达到平衡。而在解吸的后期,解吸率出现轻微降低,结果与郑翠萍报道的相似[26]。可能是由于过长的解吸时间,树脂出现了复吸现象。
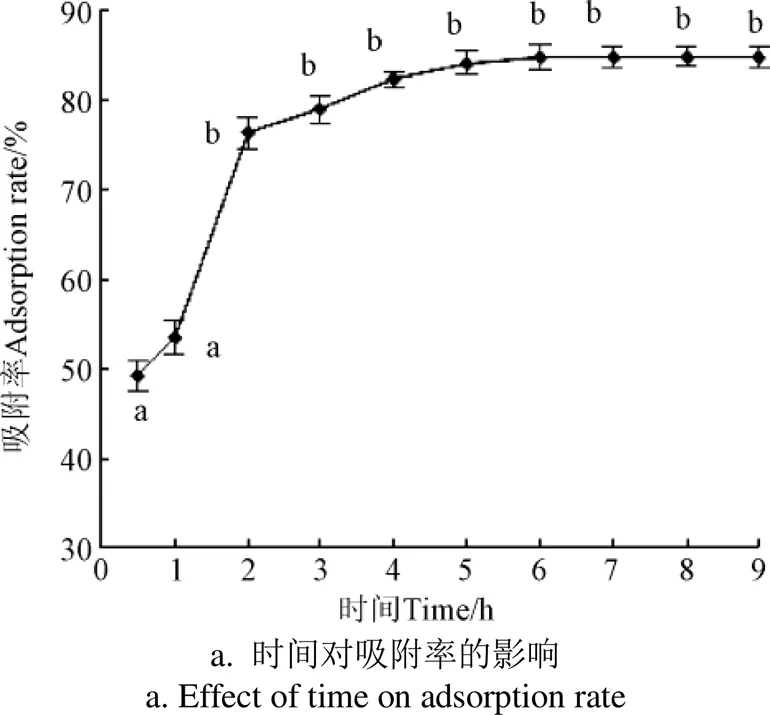
2.2.2 多酚初始浓度对树脂吸附效果的影响
由图3可见,在多酚浓度较低时,AB-8吸附多酚的能力随着上样浓度的增加而增加,至0.8 mg/mL达到最大。当上样浓度超过0.8 mg/mL时,AB-8吸附多酚的能力随着上样浓度的增加而降低。可能是低浓度时,大孔树脂吸附多酚的能力未达到饱和,还有吸附位点剩余,此时上样浓度增加,吸附率也会相应增加;在较高的浓度时,多酚与杂质争夺吸附位点,多酚吸附率降低。此外,浓度增大时,上样液会有絮凝、沉淀等现象,同时溶液粘度也会随溶液浓度的增加而增大,传质阻力增大,进而导致吸附率的降低[27]。因此,初始黄精多酚浓度为0.8 mg/mL时最佳。

图3 上样浓度对吸附率的影响
2.2.3 乙醇浓度对树脂解吸效果的影响
考察不同溶度乙醇对吸附饱和的树脂进行解吸,结果见图4所示。由图可知,随着乙醇浓度的增加,解吸率也得以提高。当乙醇浓度为70%时,解吸率达到61.8%;当乙醇浓度继续增加时,解吸率随之下降。可能是由于乙醇浓度较低时,树脂和多酚之间形成的氢键未被充分的破坏[19],导致多酚解吸率低;而当乙醇浓度继续增大时,此时溶液的极性与多酚的极性相差也随之增大,根据相似相溶原理,黄精多酚在乙醇溶液中的溶解度变低,解吸不完全导致多酚解吸率下降。因此,乙醇浓度为70%时最适宜。周跃勇[28]在对猕猴桃多酚进行纯化和何婷等[29]纯化龙眼核多酚时也获得了相似的结果。
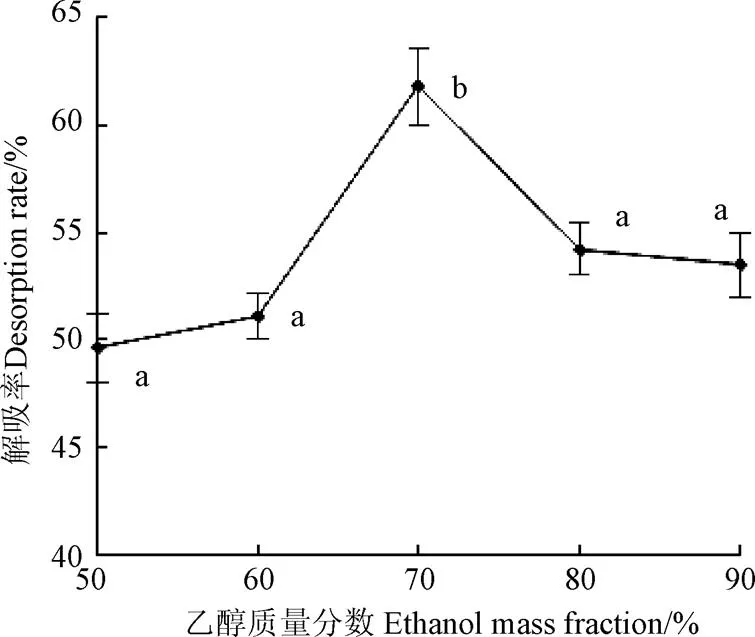
图4 乙醇质量分数对解吸率的影响
2.3 AB-8树脂静态吸附—解吸试验结果
2.3.1 上样流速对树脂吸附效果的影响
当流出液多酚的质量浓度为初始上样液多酚浓度的10%时,是树脂的泄漏点,该点可以用来选择合适的上样流速[26]。由图5可见,随着流出液体积的增大,流出液中的多酚物质在逐渐增多,说明黄精多酚的吸附率在慢慢地降低;在不同的上样流速下,相同流出液体积的多酚吸附率不同,上样流速越大,吸附率越低。可能是因为上样流速较大时,多酚物质不能与树脂充分接触、吸附,从而造成树脂对提取液中多酚物质吸附率的下降[14];当上样液流速较小时,多酚物质可以充分被树脂吸附,吸附效果就会较好,但如果流速太小,生产效率就会降低,就会延长生产的周期,提高生产的成本。因此,综合考虑,上样流速为0.8 mL/min时比较适宜,此流速条件下最佳上样量为40 mL。

图5 上样流速对吸附效果的影响
2.3.2 洗脱速度对树脂解吸效果的影响
洗脱速度对树脂解吸效果的见图6所示。随着洗脱液流速变大,洗脱带加宽,拖尾现象越来越明显。可能是由于洗脱液流速加快时,洗脱液与被树脂吸附的多酚没来得及进行充分的解吸作用,因而不能将其从树脂的吸附位点上置换下来,进而造成洗脱效果较差。但如果洗脱液流速过慢,解吸时间随之会延长,同时被洗脱下来的多酚可能会被重新吸附,树脂与多酚物质间会重新建立动态平衡,降低解吸量[30],另外,也会使生产周期延长,生产成本增加。因此,综合考虑1 mL/min作为洗脱液的洗脱流速,洗脱液体积为108 mL。在此条件下经AB-8树脂纯化后,黄精多酚的回收率为76.52%。
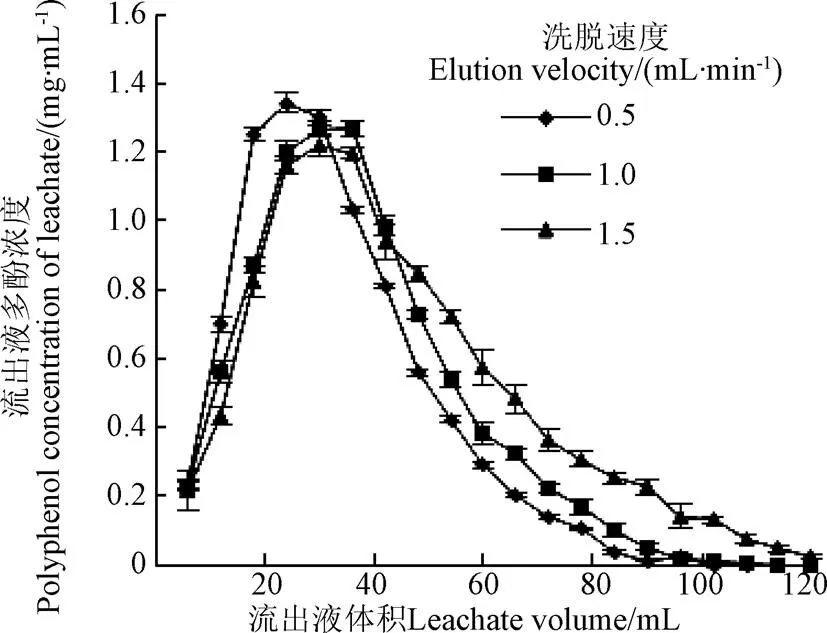
图6 洗脱流速对解吸效果的影响
2.4 黄精多酚纯化前后抗氧化试验结果
黄精多酚粗提物、纯化物和Vc的总还原能力和对DPPH•、ABTS+•清除能力的结果见图7~图9及表2所示,总体而言,随着粗提物、纯化物和对照品Vc浓度增加,其总还原能力和对DPPH•、ABTS+自由基清除能力也逐渐增强,并呈现明显的浓度依赖关系。其中纯化液在质量浓度为10g/mL时,清除率DPPH•和ABTS+•的能力达到了97.25%和92.63%,说明黄精多酚中含有一定的供氢体,能提供氧质子,能够还原高度氧化性的自由基,进而终止自由基的连锁反应,起到一定的抑制或清除自由基的效果[25]。由表2可知,经AB-8大孔树脂纯化后黄精多酚的纯度由(15.65±1.24)%,提高到了(68.38±1.98)%,提高了3.37倍,表明经AB-8大孔树脂纯化后,黄精粗多酚中蛋白、糖类和色素等杂质得到了有效的去除,实现了黄精多酚组分的富集、纯化,提示AB-8树脂较适于黄精多酚粗提物的分离纯化。纯化后多酚的总还原力和清除DPPH•的IC50值分为(19.01±1.48)和(4.00±0.20)g/mL,显著高于纯化前的多酚和Vc的相应值(<0.05);纯化后样品对ABTS+•清除能力要高于纯化前样品和Vc的清除能力,但没有显著差异,结果表明黄精多酚具有较好的抗氧化能力,且纯化后其抗氧化能力进一步提高。许多研究表明[31-33],经过大孔树脂纯化后,多酚类化合物的抗氧化活性会增强,可能是由于大孔树脂对多酚类物质起到了纯化和富集的作用,使得其纯度和总酚含量提高,从而增强了其抗氧化能力。但也有报道认为多酚的分子和酚羟基的数量及其所在的位置会影响其抗氧化特性[34]。

图7 总还原能力对比
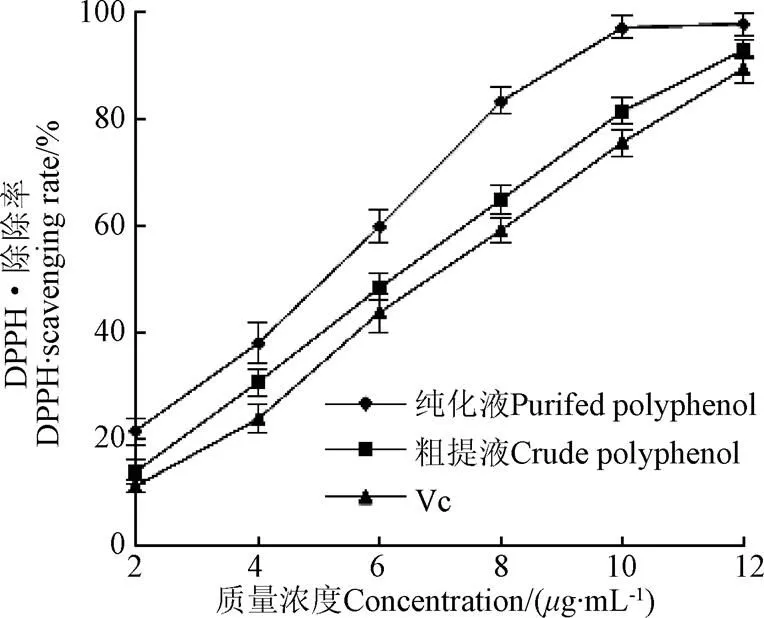
图8 黄精多酚对DPPH•的清除能力

图9 黄精多酚对ABTS+•的清除能力

表2 黄精多酚对不同抗氧化反应体系抗氧化效果的比较(IC50值)
注:同一指标不同字母上标表示差异显著。
Note: Significant differences between different superscripts in the same index.
2.5 黄精多酚的红外光谱分析
黄精多酚纯化物的红外光谱测定结果见图10,其中在3 408.56 cm-1波数处出现的吸收峰是由于O-H的伸缩振动而引起的,是酚类物质的重要特征[35];在2 918.87 cm-1波数处的吸收峰是-CH2-的C-H伸缩振动引起的[36];波数在2 000~1 400 cm-1范围的吸收峰表明该化合物具有芳香族特性[37],1 758.33 cm-1波数处的峰是羰基C═O伸缩振动引起的,该峰归属于黄酮类物质,表明黄精多酚中含有黄酮类化合物;在1 628.66 cm-1处出现吸收峰,进一步表明黄精多酚中含有黄酮类物质[38]。1 581.98和1 445.65 cm-1出现的峰是苯环上的C=C伸缩振动引起的;1 384.32 cm-1是由于C-H弯曲振动而引起的吸收峰;1 130.22 cm-1受到C-H面内弯曲振动影响;952.38、885.74及758.36 cm-1出现的吸收峰是C-H面外弯曲振动引起的。

图10 黄精多酚纯化物的红外光谱图
2.6 黄精黄精多酚组成及含量分析
采用单一标准品分别确定其出峰时间,并以10种单体酚为混合标样,采用HPLC-DAD测定黄精多酚纯化物的组成成分,并对其含量进行测定。由图11和表3可知,黄精多酚纯化物中绿原酸,阿魏酸,芦丁和熊果酸的出峰时间与标准品的时间一致,可以初步认为其含有这4种单酚成分,其中熊果酸和芦丁的含量较高,分别为(57.24±1.24)和(23.17±0.79)g/mL,这也可能是黄精多酚具有较高的抗氧化能力的原因。但同时也发现,在保留时间为8.46、11.35、29.34 min处有3未知个峰,需要进一步分析。

1.没食子酸 2.儿茶素 3.绿原酸 4.咖啡酸 5.表儿茶素 6.阿魏酸 7.芦丁 8.槲皮素 9.山奈酚 10.熊果酸
1.Gallic acid 2.Catechins 3.Chlorogenic acid 4.Caffeic acid 5.Epicatechins 6.Ferulic acid 7.Rutin 8.Quercetin 9.Kaempferol 10.Ursolic acid
图11 多酚标准品和纯化后黄精多酚的HPLC图
Fig.11 HPLC results of polyphenols standard and purified polygonatum polyphenols

表3 山楂叶多酚纯化后单体酚种类及含量
3 结 论
采用大孔树脂对黄精多酚粗提液进行纯化,通过测定其总还原能力、对DPPH•和ABTS+•的清除能力来分析纯化前后黄精多酚的抗氧化活性。试验确定了AB-8大孔树脂为对黄精多酚的最佳纯化树脂,其纯化工艺为,静态吸附5 h达到饱和,静态解析3 h达到平衡;以质量浓度为0.8 mg/mL的黄精多酚粗提液在流速为0.8 mL/min时上样40 mL,吸附平衡后采用70%的乙醇作为洗脱剂,在洗脱流速为1 mL/min下洗脱108 min,经AB-8大孔树脂纯化后的黄精多酚回收率为76.52%,纯化前后黄精多酚的纯度由(15.65±1.24)%,提高到了(68.38±1.98)%,提高了3.37倍。抗氧化试验结果表明,黄精多酚的抗氧化能力与其浓度具有较强的量效关系,黄精多酚经纯化后的总还原能力和对DPPH•及ABTS+•的IC50值分别为(19.01±1.48)、(4.00±0.26)、(4.21±0.53)g/mL,抗氧化活性明显优于粗提物和Vc,表明AB-8树脂多黄精多酚具有较好的纯化和富集作用。红外光谱分析表明其具有多酚和黄酮的特征峰。HPLC分析表明黄精多酚主要含绿原酸,阿魏酸,芦丁和熊果酸。试验结果为黄精多酚类物质的进一步研究和在保健食品方面的利用提供了基础试验数据。后续研究会对其在经过高速逆流、制备色谱等技术纯化后,采用质谱、核磁共振等技术进行鉴定分析。
[1]柳威,林懋怡,刘晋杰,等. 滇黄精研究进展及黄精研究现状[J]. 中国实验方剂学杂志,2017,23(14):226-234.
Liu Wei, Lin Maoyi, Liu Jinjie, et al. Progress in study of polygonatum kingianum and research status of polygonati rhizoma[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2017, 23(14): 226-234.(in Chinese with English abstract)
[2]Liu N, Dong Z H, Zhu X S, et al. Characterization and protective effect of polygonatum sibiricum, polysaccharide against cyclophosphamide-induced immunosuppression in Balb/c mice[J]. International Journal of Biological Macromolecules, 2017,107(Pt A): 796-802.
[3]Cui X W, Wang Y S, Cao H, et al. A Review: The bioactivities and pharmacological applications of polygonatum sibiricum polysaccharides[J]. Molecules, 2018, 23(5): 1170-1182.
[4]Jo K, Kim H, Choi H S, et al. Isolation of a sleep-promoting compound from polygonatum sibiricum rhizome[J]. Food Science and Biotechnology, 2018,27(6): 1833-1842.
[5]Jo K, Joo S H, Choi H S. Polygonatum sibiricum rhizome promotes sleep by regulating non-rapid eye movement and GABAergic/serotonergic receptors in rodent models[J]. Biomedicine & Pharmacotherapy, 2018, 105: 167-175.
[6]Long T T, Liu Z J, Shang J C, et al. Polygonatum sibiricum polysaccharides play anti-cancer effect through TLR4-MAPK/NF-κB signaling pathways[J]. International Journal of Biological Macromolecules, 2018, 111: 813-821.
[7]Zhang H Y, Hu W C, Ma G X, et al. A new steroidal saponin from polygonatum sibiricum[J]. Journal of Asian Natural Products Research, 2017, 20(6): 1-7.
[8]杨阳,巫永华,陈安徽,等. 黄精提取物不同极性组分的体外抗氧化活性研究[J]. 食品工业,2016,28(4):269-272.
Yang Yang, Wu Yonghua, Chen Anhui, et al. In vitro antioxidant activities of the different polarity fractions of extracts from polygonatum sibiricum redoute[J]. Food Industry, 2016, 28(4): 269-272. (in Chinese with English abstract)
[9]巫永华,刘恩岐,张建萍,等. 黄精多酚的闪式提取及抗氧化活性研究[J]. 食品科技,2017,42(8):231-236.
Wu Yonghua, Liu Enqi, Zhang Jianping, et al. Extraction of polyphenols from polygonatum and its antioxidant activities[J]. Food Science and Technology, 2017,42 (8): 231-236. (in Chinese with English abstract)
[10]李斌,高凝轩,刘辉,等. 大孔树脂纯化黑果腺肋花楸多酚的工艺优化[J]. 食品科学,2016,37(16):69-74.
Li Bin, Gao Ningxuan, Liu Hui, et al. Macroporous adsorption resin for the purification of polyphenols from aronia melanocarpa berries[J]. Food Science, 2016, 37(16): 69-74. (in Chinese with English abstract)
[11]杨希娟,党斌,张杰,等. 黑青稞麸皮结合态酚类物质大孔树脂分离纯化工艺优化[J]. 农业工程学报,2018,34(21):295-303.
Yang Xijuan, Dang Bin, Zhang Jie, et al. Process optimization on separation and purification of bound polyphenol in black highland barley bran by macroporous resin[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(21): 295-303. (in Chinese with English abstract)
[12]Guo C X, Qiao J P, Zhang S W, et al. Purification of polyphenols from kiwi fruit peel extracts using macroporous resins and high-performance liquid chromatography analysis[J]. International Journal of Food Science & Technology, 2018, 53(6): 1486-1493.
[13]Gao N X, Wang Y H, Jiao X Y, et al. Preparative purification of polyphenols from aronia melanocarpa (chokeberry) with cellular antioxidant and antiproliferative activity[J]. Molecules, 2018, 23(1): 139-153.
[14]张卉,王亚茹,刘洋峰. XAD-7型大孔树脂纯化黑果腺肋花楸多酚条件优化[J]. 食品研究与开发,2019,40(8):159-163.
Zhang Hui, Wang Yaru, Liu Yangfeng. The condition of XAD-7 macroporous resin for the purification of polyphenol from aronia melanocarpa[J]. Food Research and Development, 2019, 40(8): 159-163. (in Chinese with English abstract)
[15]王艳丽,许惠芳,郭瑜,等. 大孔树脂纯化酸浆果实多酚及其生物活性研究[J]. 食品研究与开发,2018,39(2):13-20.
Wang Yanli, Xu Huifang, Guo Yu, et al. Research of macroporous resin purification and biological activity of polyphenols from physalis alkekengi fruit[J]. Food Research and Development, 2018, 39(2): 13-20. (in Chinese with English abstract)
[16]陈纯. 甘蔗皮多酚的提取、分离鉴定及抗氧化活性研究[D]. 杭州:浙江大学,2013.
Chen Chun. Extraction, Isolation, Identification and Antioxidant Activity of Polyphenols From Sugarcane Peel[D]. Hangzhou: Zhejiang University, 2013. (in Chinese with English abstract)
[17]吴兰兰. 龙眼核多酚的分离纯化及其结构和抗氧化活性研究[D]. 厦门:集美大学,2010.
Wu Lanlan. Isolation, Purification and Structure, Anti-Oxidation of Polyphenols From Longan Seed[D]. Xiamen: Jimei University, 2010. (in Chinese with English abstract)
[18]史斌斌. 铁核桃多酚类物质含量与抗氧化活性、代谢相关酶活性的关系[D]. 贵阳:贵州大学,2017.
Shi Binbin. Evaluation for the Relationship of Phenolics Content, Antioxidant Activity and Metabolic Enzymes Activity of Juglans Sigillata Dode[D]. Guiyang: Guizhou University, 2017. (in Chinese with English abstract)
[19]谢碧秀,马建英,杨泽身,等. 油橄榄果渣多酚分离纯化及抗氧化活性[J]. 江苏农业科学,2017,45(5):178-182.
Xie Bixiu, Ma Jianying, Yang Zeshen, et al. Separation, purification and antioxidant activity of polyphenols from olive pomace [J]. Jiangsu Agricultural Science, 2017, 45(5): 178-182. (in Chinese with English abstract)
[20]刘军伟,李啸晨,侯婴惠,等. 大孔树脂纯化生姜多酚的研究[J]. 食品研究与开发,2017,38(17):45-49.
Liu Junwei, Li Xiaochen, Hou Yinghui, et al. Purification of polyphenols from ginger by macroporous resin[J]. Food Research and Development, 2017,38(17): 45-49. (in Chinese with English abstract)
[21]马双双,刘莹,陈中惠,等. 老熟莲子壳多酚的树脂法纯化及稳定性研究[J]. 天然产物研究与开发,2014,26(2):238-243.
Ma Shuangshuang, Liu Ying, Chen Zhonghui, et al. Purification and stability of polyphenols from ageing lotus seed epicarp[J]. Natural Product Research and Development, 2014, 26(2): 238-243. (in Chinese with English abstract)
[22]尚丹. 香蕉皮中多酚和果胶物质分步提取纯化的工艺研究[D]. 无锡:江南大学,2009.
Shang Dan. Study on the Extraction and Purification of Polyphenols and Pectin from Banana Peel[D]. Wuxi: Jiangnan University, 2009. (in Chinese with English abstract)
[23]艾志录,王育红,王海,等. 大孔树脂对苹果渣中多酚物质的吸附研究[J]. 农业工程学报,2007,23(8):245-248.
Ai Zhilu, Wang Yuhong, Wang Hai, et al. Adsorption of polyphenols from apple pomace by macroporous resin absorbent resins[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2007, 23(8): 245-248. (in Chinese with English abstract)
[24]陶莎,黄英,康玉凡,等. 大孔吸附树脂分离纯化红小豆多酚工艺及效果[J]. 农业工程学报,2013,29(23):276-285.
Tao Sha, Huang Ying, Kang Yufan, et al. Technology of separation and purification and its efficiency of adzuki bean polyphenols with macroporous adsorption resins[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2013, 29(23): 276-285. (in Chinese with English abstract)
[25]甘芝霖,倪元颖,郭悦,等. 大孔树脂分离纯化玫瑰果多酚及其抗氧化性[J]. 农业工程学报,2015,31(24):298-306.
Gan Zhilin, Ni Yuanying, Guo Yue, et al. Separation and purification of rosehip polyphenols by macroporous resin and its antioxidant activity[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(24): 298-306. (in Chinese with English abstract)
[26]郑翠萍,田呈瑞,马婷婷,等. 大孔树脂纯化苦菜多酚及其组成分析[J]. 食品与机械,2016,32(4):176-180,186.
Zheng Cuiping, Tian Chengrui, Ma Tingting, et al. Purification and composition analysis of polyphenols from bitter vegetable by macroporous resin[J]. Food and Machinery, 2016,32(4): 176-180. (in Chinese with English abstract)
[27]刘长江,栾云峰,王菲,等. 大孔吸附树脂分离纯化软枣猕猴桃总黄酮[J]. 食品科学,2011,32(12):145-149.
Liu Changjiang, Luan Yunfeng, Wang Fei, et al. Macroporous resin adsorption for purification of total flavonoids from Actinidia arguta fruits[J]. Food Science, 2011, 32(12): 145-149. (in Chinese with English abstract)
[28]周跃勇. 猕猴桃中多酚类物质的提取及纯化研究[D]. 郑州:河南工业大学,2007.
Zhou Yueyong. Extraction and Purification of Polyphenols From Kiwifruit[D]. Zhengzhou: Henan University of Technology, 2007. (in Chinese with English abstract)
[29]何婷,王凯,赵雷,等. 大孔树脂纯化龙眼核多酚及其组分分析[J/OL]. 食品工业科技:1-11[2019-08-28]. http://kns. cnki.net/ kcms/detail/11.1759.TS.20190328. 1520.025.html.
He Ting, Wang Kai, Zhao Lei, et al. Purification of longan nucleus polyphenols by macroporous resin and analysis of their components [J/OL]. Science and Technology of Food Industry: 1-11[2019-08-28]. http://kns. cnki.net/ kcms/ detail/11.1759.TS.20190328.1520.025.html. (in Chinese with English abstract)
[30]马乐,韩军岐,白欢欢,等. 采用大孔树脂分离纯化核桃青皮中多酚[J]. 食品与发酵工业,2016,42(3):237-242.
Ma Le, Han Junqi, Bai Huanhuan, et al. Separation and purification of polyphenols from walnut green husk by macroporous resin[J]. Food and Fermentation Industries, 2016, 42(3): 237-242. (in Chinese with English abstract)
[31]Xi L S, Mu T H, Sun H N. Preparative purification of polyphenols from sweet potato () leaves by AB-8 macroporous resins[J]. Food Chemistry, 2015, 172: 166-174.
[32]朱洁,王红宝,孔佳君,等. 梨幼果多酚的纯化及其抗氧化性[J]. 食品科学,2017,38(5):24-30.
Zhu Jie, Wang Hongbao, Kong Jiajun, et al. Purification and antioxidant activity of polyphenols from young pear fruits[J]. Food Science, 2017, 38(5): 14-20. (in Chinese with English abstract)
[33]王国良,李建科,吴晓霞,等. 水麻果多酚的提取纯化及其抗氧化、抗肿瘤活性作用[J]. 天然产物研究与开发,2019,31(1):4-12.
Wang Guoliang, Li Jianke, Wu Xiaoxia, et al. Extraction, purification and antioxidant and antineoplastic activities of polyphenols from saccharomyces fructus[J]. Natural Product Research and Development, 2019, 31(1): 4-12. (in Chinese with English abstract)
[34]石晓峰,沈薇,宁红霞,等. 雪松松针总多酚的纯化工艺和抗氧化活性研究[J]. 天然产物研究与开发,2016,28(8):1325-1331.
Shi Xiaofeng, Shen Wei, Ning Hongxia, et al. Purification and antioxidant activity of polyphenols from pine needles of cedrus[J]. Natural Product Research and development, 2016,28(8): 1325-1331. (in Chinese with English abstract)
[35]康超,李燕,段振华,等. 芒果核多酚纯化物成分分析及其抗氧化研究[J]. 食品研究与开发,2017,38(22):15-22.
Kang Chao, Li Yan, Duan Zhenhua, et al. Component analysis of polyphenol from mango kernel seeds and its evaluation of antioxidative activity[J]. Food Research and Development, 2017,38(22): 15-22. (in Chinese with English abstract)
[36]Chupin L, Motillon C, Bouhtoury C E, et al. Characterisation of maritime pine () bark tannins extracted under different conditions by spectroscopic methods, FTIR and HPLC[J]. Industrial Crops & Products, 2013, 49(7): 897-903.
[37]Soto R , Freer J , Baeza J . Evidence of chemical reactions between di- and poly-glycidyl ether resins and tannins isolated from Pinus radiata D. Don bark[J]. Bioresource Technology, 2005, 96(1): 95-101.
[38]旷慧. 红树莓多酚的提取、分离纯化、组分分析和抗氧化活性研究[D]. 哈尔滨:东北林业大学,2017.
Kuang Hui. Extraction, Separation and Purification, Compound Analysis and Antioxidant Activity of Red Raspberry Polyphenols[D]. Harbin: Northeast Forestry University, 2017. (in Chinese with English abstract)
Antioxidantion and composition analysis of purified polygonatum sibiricum polyphenols using macroporous resin
Wu Yonghua, Zhang Jianping, Zhao Jiechang, Chen Anhui, Shao Ying, Liu Enqi※
(,,, 221018,)
becomes generally used as a sort of traditional medicinal herbs for thousands of years in China. This herbs contains a large number of active ingredients, such as polysaccharides, flavonoids, polyphenols, to cure many physiological functions including antioxidant, anti-fatigue, hypoglycemic, hypolipidemic, anti-cancer etc. This present work focused on the purification processing of the rawpolyphenols by using the specific macroporous resin. A sort of resin, named AB-8, was chosen as the ideal adsorbent due to the best adsorption and the desorption rate forpolyphenols, after the comparison test for the adsorption-desorption characteristics of four different types of resins (AB-8, NKA-9, SP-825 and XAD-2) for crudepolyphenols. In the static/dynamic adsorption and desorption experiments, the sample concentration, flow velocity of samples, ethanol concentration and flow velocity of desorption showed great influence on the macroporous resin in the process of separating and purifying thepolyphenols. The ideal purification parameters for the resin of AB-8 were as follows, at room temperature, the concentration of crude polyphenol was 0.80 mg/mL with the flow velocity of 0.8 mL/min, and 70% ethanol was used as the eluent solvent with the elution flow rate of 1 mL/min. The Folin-phenol reagent method was adopted to determine the total phenol content during the purification. The results showed that the purity ofpolyphenols after purification by AB-8 resin increased by 3.37 times than the crude polyphenol extract indicating that AB-8 resin has great adsorption and enrichment effect forpolyphenols. The total reduction capacity, scavenging capacity of DPPH• and ABTS+• were measured to investigate the antioxidant capacity of crude and purifiedpolyphenols. The obtained results showed thatpolyphenols possessed good antioxidant capacity with the dose-effect relationship. IC50values of total reduction capacity ofpolyphenols before and after purification were (27.48+1.93)g/mL, (19.01+1.48)g/mL, IC50values of DPPH• scavenging activities were (5.21+0.48)g/mL, (4.00+0.26)g/mL, and IC50values of ABTS+• scavenging activities were (4.89+0.82)g/mL and(4.21±0.53)g/mL, respectively. Obviously, the antioxidant activity ofpolyphenols was significantly enhanced after purification. The infrared spectrum and HPLC were also used to analyze the structure characteristics and compositions of the purified products. The characteristic peaks of some polyphenols and flavones can be detected, wherepolyphenols mainly contains green source acid, ferulic acid, rutin and ursolic acid. The present study can provide a scientific basis for the structure-activity analysis ofpolyphenols and their promising utilization in the functional food, medicine and cosmetics.
polyphenols; resins; purification;; antioxidant activity; composition analysis
巫永华,张建萍,赵节昌,陈安徽,邵 颖,刘恩岐. 大孔树脂纯化黄精多酚及其抗氧化性与组成分析[J]. 农业工程学报,2020,36(1):318-326.doi:10.11975/j.issn.1002-6819.2020.01.038 http://www.tcsae.org
Wu Yonghua, Zhang Jianping, Zhao Jiechang, Chen Anhui, Shao Ying, Liu Enqi. Antioxidantion and composition analysis of purified polygonatum sibiricum polyphenols using macroporous resin[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(1): 318-326. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.01.038 http://www.tcsae.org
2019-08-26
2019-09-24
徐州工程学院科研项目(XKY2017240);安徽省科技重大专项(17030801019);国家自然基金项目(31701566);江苏省重点研发计划项目(BE2017352)联合资助
巫永华,实验师,主要从事食品资源开发与利用研究。Email:yonghuawu2006@163.com
刘恩岐,教授,博士,主要从事食品资源开发与利用研究。Email:xiaoyaohai777@163.com
10.11975/j.issn.1002-6819.2020.01.038
TS206.4
A
1002-6819(2020)-01-0318-09
