叶酸修饰载丹参酮ⅡA 纳米结构脂质载体的制备及其理化表征
2020-03-03刘静静李新悦吴玉梅刘志东李佳玮
刘静静,李新悦,吴玉梅,马 丽,张 兵,刘志东,李佳玮
(1.天津中医药大学,现代中药发现与制剂技术教育部工程中心,天津 301617;2.天津中医药大学,天津市现代中药重点实验室-省部共建国家重点实验室培育基地,天津 301617)
丹参为唇形科植物丹参(Salvia miltiorrhiza Bge.)的干燥根和根茎,是临床常用中药之一,其主要功能为活血化瘀、通经止痛、清心除烦、凉血消痈,主治胸痹心痛、脘腹胁痛、癥瘕积聚和热痹疼痛等,为中药中的妇科要药。丹参酮ⅡA(TanⅡA)为丹参中提取的主要脂溶性有效成分之一,其对心血管系统具有较强的药理作用[1-3],临床上得到了广泛应用。近几年,TanⅡA 的抗肿瘤作用颇受关注[4-5],有研究表明,TanⅡA 可抑制多种妇科恶性肿瘤细胞的生长,同时具有杀伤以及促进肿瘤细胞凋亡的作用,比如:乳腺癌、宫颈癌、卵巢癌等[6-9]。但是,由于TanⅡA 水溶性极差,生物利用度低,光、热不稳定性等问题,极大的限制了其在临床上的应用。
纳米结构脂质载体(NLC)是继固体结构脂质载体(SLN)后发展的第二代新型脂质纳米给药系统,其中液态脂质的加入,破坏了原本规整有序的晶格结构,避免形成完整晶格的脂质将药物排挤出来,使药物有了更大的存储空间,改善了SLN 易泄露的弊端,极大的提高了药物的溶解性以及制剂的包封率,同时具有较高的药物保护作用,有利于药物的长期保存。
叶酸受体是一种单链跨膜糖蛋白,其在大多肿瘤细胞表面过度表达,而在正常细胞表面的表达极为保守甚至不表达[10],这一特点使其成为肿瘤靶向递药系统领域的研究热点,同时叶酸及其衍生物与叶酸受之间的高度亲和力,使其两者可特异性结合形成复合物,从而实现对肿瘤的主动靶向作用。
本实验采用乳化蒸发-低温固化法制备叶酸靶向修饰的载丹参酮ⅡA 纳米结构脂质载体(FA-TanⅡA-NLC),增加了丹参酮ⅡA 的溶解性,采用超滤离心-HPLC 法对其包封率进行测定,同时考察制剂的粒径和电位,采用透射电子显微镜(TEM)观察制剂外观形态,差示扫描热量法(DSC)以及X 射线衍射法(XRD)验证TanⅡA 于纳米结构脂质载体中的存在状态。
1 材料与试剂
1.1 仪器 1260 型高效液相色谱仪(美国安捷伦公司);Nano ZS 型激光散射粒径分析仪(Malvern);EMS-8B 型磁力加热搅拌器(天津欧诺仪器仪表有限责任公司);BPll0S 型分析天平(德国Sartorius 公司);XP205 型电子天平(METTLER TOLEDO);SB-3200D型数控超声波清洗器(宁波新芝生物科技股份有限公司);台式通用冷冻离心机(Thermo Fisher);Milli-Q型超纯水系统(Millipore)。
1.2 材料 丹参酮ⅡA(南京泽朗生物科技有限公司,纯度>98%);DSPE-PEG2000-FA(上海艾韦特医药科技有限公司);大豆磷脂(Lipoid S-100,上海东尚实业有限公司);聚氧乙烯(40)硬脂酸酯(Myrj 52,南京威尔化工有限公司);辛酸/癸酸三甘油酯(Miglyol 812,北京凤礼精求商贸有限公司);单硬脂酸甘油酯[GMS,博欧特(天津)化工贸易有限公司);三氯甲烷、乙醇(分析纯,天津康科德科技有限公司);甲醇、乙腈(色谱纯,天津康科德科技有限公司),去离子水自制。
2 方法与结果
2.1 TanⅡA-NLC 的制备 TanⅡA-NLC 的制备采用的是乳化蒸发-低温固化法。精密称定处方量的Myrj 52,溶于去离子水中,水浴74~75 ℃磁力搅拌溶解,作为水相;精密称定处方量大豆磷脂溶于无水乙醇中,超声溶解,丹参酮ⅡA、GMS 和Miglyol 812 溶于氯仿中,将乙醇溶液在水浴74~75 ℃中与氯仿溶液混合均匀,作为有机相。水浴74~75 ℃中,将有机相缓慢加入水相中,600 rpm 磁力搅拌至澄清后,转速降为300 rpm,挥发有机溶剂至溶液体积为10 mL,4 ℃冷却2 h 后,过孔径为0.22 μm 滤膜即得TanⅡA-NLC 溶液。
2.2 FA-TanⅡA-NLC 的制备 将DSPE-PEG2000-FA 同TanⅡA、GMS 以及Miglyol 812 共同加入氯仿中溶解,按“2.1”项下方法制备FA-TanⅡA-NLC。
2.3 粒径和Zeta 电位的测定 取适量制剂,加入去离子水稀释至适宜浓度,使用马尔文激光粒度测定仪测定其粒径、PDI 和电位,结果见图1~3,TanⅡA-NLC 粒径为(14.21±0.24)nm,PDI 为0.199±0.02,电位为(-8.91±0.94)mV;FA-TanⅡA-NLC 粒径为(19.14±0.43)nm,PDI 为0.424±0.01,电位为(-11.67±0.25)mV。
2.4 包封率(EE)的测定
由图2可知,以综合滋味得分3分(y值)为接受临界点,确定镀铝袋脆口萝卜产品各储存温度的货架期(保质期):35 ℃产品货架期=Qs(35)=(5-3)/0.0173=115.61天;45 ℃产品货架期=Qs(45)=(5.084-3)/0.0357=58.38天;Q10value=Qs(35)/Qs(45)=115.61/58.38=1.98;推算产品流通货架期为Qs(25)=Q10value×Qs(35)=1.98×115.61=228.91天,即镀铝袋脆口萝卜产品货架期(保质期)为229天。

图1 Blank-NLC 粒径、电位
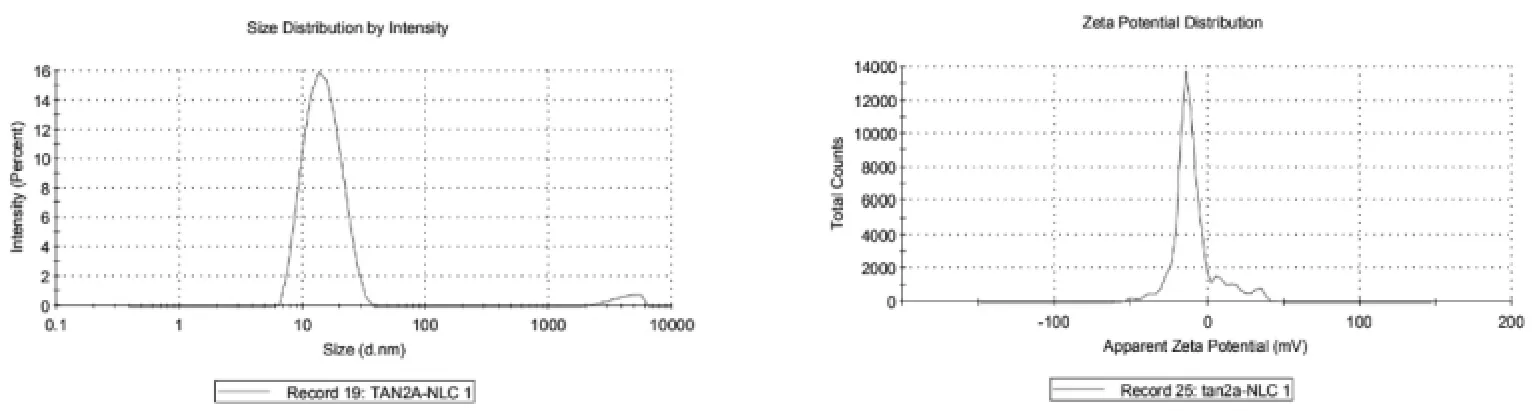
图2 TanⅡA-NLC 粒径、电位
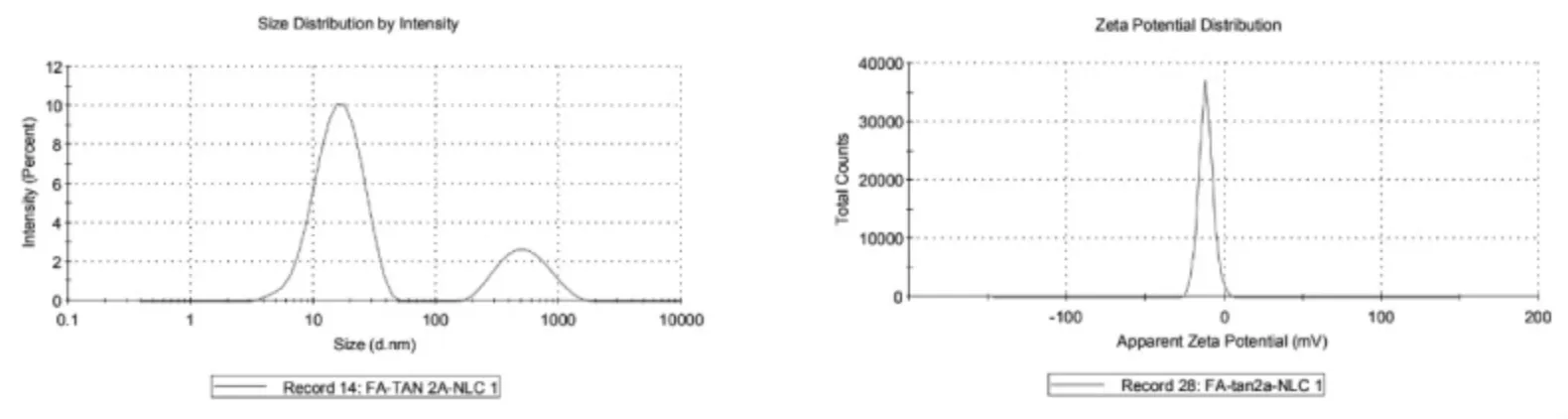
图3 FA-TanⅡA-NLC 粒径、电位
2.4.1 色谱条件 色谱柱为Waters C18RP(250 mm×4.6 mm,5 μm),流动相为乙腈∶水=90∶10,检测波长为269 nm,流速为1 mL/min,柱温为30 ℃,进样量为10 μL。
2.4.2 专属性实验 分别取甲醇、TanⅡA 对照品以及空白NLC 进样,在上述色谱条件下测定。TanⅡA 出峰位置处,甲醇及空白NLC 在此处无吸收峰,由此表明溶剂及辅料对丹参酮ⅡA 的测定无影响,该方法专属性良好。见图4。
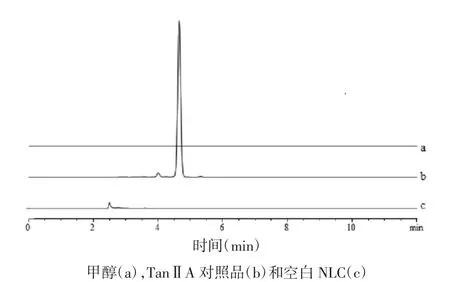
图4 测定甲醇中TanⅡA 含量专属性色谱图
2.4.3 标准曲线的制备 精密称取TanⅡA 对照品5 mg,以甲醇溶解于50 mL 容量瓶中,配制成100 μg/mL 的TanⅡA 储备液。分别取TanⅡA 储备液适量用甲醇稀释至每1 mL 含有1、2、4、10、20 和50 μg TanⅡA 的系列溶液,按“2.4.1”项下测定,以峰面积(A)对质量浓度(C)做回归曲线,得回归方程为A=55.873C-6.907 7,R2=0.999 8,由结果可知TanⅡA 标准溶液在1.02~50.80 μg/mL 的浓度范围内线性关系良好。
2.4.4 精密度实验 取浓度分别为2、10 和20 μg/mL的高、中、低3 个浓度的TanⅡA 溶液,于1 d 内按“2.4.1”项下测定方法测定3 次,计算日内精密度,连续测定2 d,计算日间精密度。由结果可知,高、中、低3 个浓度的日内精密度RSD 分别为0.14%、0.32%、0.17%,日间精密度为0.28%、0.13%、0.02%,RSD 均小于2%,表明仪器精密度符合要求,此方法用于丹参酮ⅡA 的含量测定准确可靠。
2.4.5 重复性实验 按“2.1”项下方法制备TanⅡA-NLC,取0.5 mL 制剂,加入甲醇及1%氯化钠超声破乳后,过孔径为0.22 μm 的滤膜,平行制备6 份样品,续滤液按“2.4.1”项下测定方法进行测定得峰面积,计算RSD。TanⅡA 重复性RSD 为1.25%,说明样品测定方法符合要求,重复性良好。
2.4.6 稳定性实验 按“2.1”项下方法制备TanⅡA-NLC 样品溶液0.5 mL,加入甲醇及1%氯化钠超声破乳后,过孔径为0.22 μm 的滤膜,取续滤液按“2.4.1”项下测定方法分别在0、2、4、6、8、12 和24 h进行测定,通过测得的峰面积,计算RSD。结果稳定性RSD 为1.19%,表明样品在24 h 内稳定。
2.4.7 TanⅡA-NLC 包封率的测定 本实验采用超滤离心-HPLC 法测定制剂包封率。取制剂0.5 mL加去离子水稀释至3 mL 于50 KD 超滤离心管中,5 000 rpm/min 离心20 min 后取外管溶液过孔径0.22 μm 滤膜后,样品按“2.4.1”项下测定方法进行测定,结果记为W 游离。另取制剂0.5 mL 于10 mL容量瓶内,加甲醇及1%氯化钠超声40 min 破乳后定容,过0.22 μm 滤膜后,样品按“2.4.1”项下测定方法进行测定,结果记为W总。
包封率E%=(1-W总/W游离)×100%
根据公式得TanⅡA-NLC 中TanⅡA 的包封率为99%以上。
2.5 FA-TanⅡA-NLC 理化表征
2.5.1 透射电镜检测(TEM) 分别取TanⅡANLC、FA-TanⅡA-NLC 适量置于铜网上,2%磷钨酸染色后自然干燥。利用TEM 对制剂形态进行观察并拍照。结果如图5 所示,制剂多呈圆球状,外观完整,分散均匀。

图5 TanⅡA-NLC(a)和FA-TanⅡA-NLC(b)透射电镜图
2.5.2 差示扫描量热法(DSC) 分别取TanⅡA 对照品、空白NLC 冻干粉、TanⅡA-NLC 冻干粉、FATanⅡA-NLC 冻干粉、TanⅡA 对照品与空白NLC冻干粉的物理混合物(2∶1)适量于坩埚中进行DSC检测。以空白铝锅作为对照,设置仪器参数如下:加热速率为10 ℃/min,扫描范围30 ℃~300 ℃,记录数据与图谱。
根据图中各样品的DSC 图谱可初步判断药物在制剂中的存在形式。见图6a 为TanⅡA 对照品,可见其在218.44°C 处出现一个吸热峰;b 为空白NLC 冻干粉,其吸热峰出现在47.61°C 处;e 为取TanⅡA 对照品与空白NLC 冻干粉的物理混合物,均存在上述单标的特征吸热峰;c、d 分别为TanⅡA-NLC 冻干粉和FA-TanⅡA-NLC 冻干粉,其图谱中只存在制剂特征吸热峰,而无TanⅡA 药物峰出现,说明TanⅡA 以分子形式被包裹于制剂中,而不是以晶体形式存在。
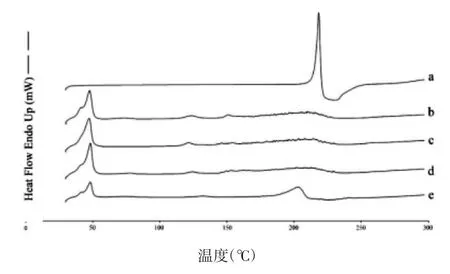
图6 TanⅡA(a),Blank-NLC(b),TanⅡA-NLC(c),FATanⅡA-NLC(d)与物理混合物(e)的差示扫描量热图
2.5.3 X 射线衍射法(XRD) 精密称取TanⅡA 对照品,Blank-NLC 冻干粉,TanⅡA-NLC 冻干粉,FA-TanⅡA-NLC 冻干粉及物理混合物(丹参酮IIA对照品:空白纳米结构脂质载体冻干粉=2∶1)进行测定。
测定条件:Ni-滤液器,Cu-Kɑ 射线,波长为1.540 56d魡,40 kW 电压和400 mA 电流,在5°~80°的2θ 范围内进行扫描,分别绘制X 射线衍射图。见图7。结果如图所示,Tan IIA(a)在7.04°~14.25°有特征峰,而Tan IIA-NLC 冻干粉(c)以及FA-TanⅡA-NLC 冻干粉(d)中无此特征峰,这与DSC 结果一致,即Tan IIA 以分子状态被包裹于纳米结构脂质载体中,而不是以晶体状态存在。
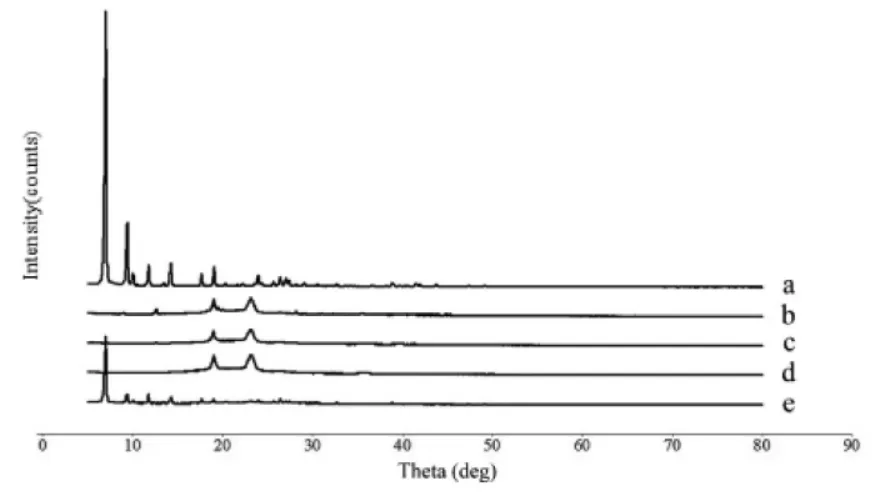
图7 TanⅡA(a),Blank-NLC(b),TanⅡA-NLC(c),FATanⅡA-NLC(d)与物理混合物(e)的X 射线衍射图
3 讨论
本实验选择丹参酮IIA 作为治疗药物,但是丹参酮IIA 水溶性极差,对于药物本身而言,良好的溶解性是其发挥药效作用的基础。因此研究丹参酮IIA 新剂型,改善其溶解度使其更好的发挥药理作用是目前开发丹参酮IIA 抗肿瘤药物所面临的一大问题。
随着对纳米药物载体的不断深入研究,利用载体包载药物使其进入体内为丹参酮IIA 新剂型的研发提供了新思路。纳米结构脂质载体中的脂质材料具有良好的生物相容性及生物可降解性,可提高药物的生物利用度,具有良好的缓释效果,其渗透滞留效应可使药物高浓度聚集分布在肿瘤部位,同时通过连接配体,可实现药物制剂的肿瘤主动靶向性,为临床抗肿瘤药物剂型提供了又一重要选择。本实验笔者选用纳米结构脂质载体包载丹参酮IIA,改善丹参酮IIA 的溶解性,同时在制剂表面修饰含有叶酸的PEG 链配体,利用叶酸与肿瘤细胞表面高度表达的叶酸受体之间的高度亲和力,实现药物制剂的主动肿瘤靶向作用。
在制剂制备过程中,笔者对其处方进行了筛选,以制剂状态、粒径、电位、稳定性等为指标,选出最优处方。对固态脂质种类[山嵛酸甘油酯(Com pritol(R) 888 ATO)、单硬脂酸甘油酯(GMS)]、液态脂质种类[辛酸/癸酸甘油酯(Miglyol 812)、大豆油、花生油]、固液脂质比(1∶2、1∶1、2∶1)、投药量(2、2.5、3 mg)、温度(70、75、80 ℃)等进行了考察,最终确定最优处方为:选用固态脂质GMS,液态脂质Miglyol 812,固液脂质比1∶1,投药量2.5 mg,温度75 ℃。以最优处方制备的制剂,外观澄清透明,粒径均一,分散较好,于4 ℃环境下保存,制剂较为稳定。
另外在包封率的测定过程中,由于制备的制剂粒径较小,葡聚糖凝胶色谱法以及高速离心法无法实现游离药物以及制剂的有效分离,因此,笔者选用超滤离心法,通过低温高速离心,将制剂截留于超滤内管中,游离药物被超滤到外管中,直接检测游离药物浓度,此方法方便可行,具有良好的重现性。同时采用传统的甲醇超声破乳方法,无法使制剂中的药物完全游离出来,因此,笔者对破乳试剂进行了考察,分别测定加入甲醇、乙醇、甲醇+1%氯化钠后超声破乳的制剂药物浓度,最终选择甲醇+1%氯化钠作为破乳试剂,在此方法下,制剂破乳完全。
后期实验中,笔者将进一步考察TanⅡA-NLC、FA-TanⅡA-NLC 制剂对肿瘤细胞的体外抑制作用,并深入考察TanⅡA-NLC、FA-Tan ⅡA-NLC 制剂的体内抗肿瘤药效作用以及生物组织分布研究,为后期TanⅡA-NLC、FA-TanⅡA-NLC 抗肿瘤作用的临床应用提供全面可靠的实验依据。
