帕金森病患者睡眠障碍特点及其影响因素分析*
2020-02-29司慧丽纪别克赵鸿雁宋阳庄艳华朱倩倩曹辉苏俊红张庆梅
司慧丽, 纪别克, 赵鸿雁, 宋阳, 庄艳华, 朱倩倩, 曹辉, 苏俊红, 张庆梅
石河子市人民医院神经内科一病区(新疆石河子 832000)
帕金森病(Parkinson′s disease)是继阿尔茨海默病之后第二常见的神经退行性疾病[1]。65岁以上发病率为1%~2%,80岁以上的发病率可达到5%[2]。帕金森病最常见且显而易见的是静止性震颤、运动迟缓、姿势步态异常等运动症状,同时也包括自主神经、神经精神、睡眠障碍等非运动症状。有研究发现,随疾病的发生、发展,非运动症状在PD患者的生活质量中发挥着重要角色[3],并有研究发现睡眠障碍可能是帕金森病最早出现的临床症状[4]。多数研究集中于帕金森病睡眠障碍特点[5-6],对血脂、尿酸、同型半胱氨酸等对帕金森病睡眠障碍的影响因素分析较少。本研究通过睡眠量表及视频多导睡眠图监测(video polysomnography,v-PSG)等主观结合客观的方式分析帕金森病患者睡眠障碍特点,并进一步探讨血脂、尿酸等与帕金森病睡眠障碍的相关性及其影响因素,为帕金森病患者的早期诊治、预防、生活质量的改善提供依据。
1 资料与方法
1.1 一般资料 选取2018年6月至2019年6月就诊于石河子市人民医院神经内科病区或门诊的帕金森病患者65例,其中男35例,女30例,所有患者均符合2016年中国帕金森病的诊断标准,即必备运动迟缓和至少存在静止性震颤或肌强直2项中的1项,并需要至少存在2条支持标准,不存在绝对排除标准以及没有警示现象[7]。排除标准:(1)颅内感染、药物毒物、血管性、外伤等所致的帕金森综合征以及帕金森叠加综合征;(2)有危及生命的疾病或不能完成量表测定者;(3)不愿参加本研究者;(4)本研究经石河子市人民医院伦理委员会审核批准,并征得患者或其家属同意,签署知情同意书。
1.2 研究方法
1.2.1 一般资料 记录患者的性别、年龄、受教育水平及病程,并收集患者的血脂[总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)]、尿酸、同型半胱氨酸(Hcy)、血糖、多巴丝肼等效剂量等一般资料。
1.2.2 量表测定 采用帕金森病睡眠量表(Parkinson′s disease sleep scale,PDSS)对帕金森病患者的总体睡眠质量进行评价,并采用爱泼沃斯嗜睡量表(Epworth Sleeping Scale,ESS)评估患者日间思睡程度。采用汉密尔顿焦虑抑郁量表(HAMD、HAMA)评估患者的焦虑抑郁状况。采用简易精神状态检查量表(MMSE)评估患者的认知功能。采用改良霍亚(Hoehn-Yahr,H-Y)分级评估患者疾病严重程度。
1.2.3 多导睡眠图仪 应用美国尼高力公司的Nicoletone视频多导睡眠图仪监测帕金森病患者的睡眠结构、睡眠效率、醒觉指数和睡眠中周期性肢动情况等客观指标。于监测前1周停服兴奋、催眠类药物。
1.2.4 睡眠障碍的诊断标准 PDSS总分≤90分为睡眠障碍;ESS总分>7分为存在嗜睡。PSG监测入睡时间>30 min为入睡困难;呼吸暂停低通气指数>5次/h为存在睡眠呼吸暂停(SAHS);周期性肢体运动指数≥5次/h为存在周期性腿动(PLMS)。符合上诉任一诊断标准者均判为有睡眠障碍。此项评估由我科2名高年资神经内科医师共同完成。根据帕金森病相关量表及多导睡眠监测进行分组,分为睡眠障碍组(40例)及非睡眠障碍组(25例)。

2 结果
2.1 两组间v-PSG参数比较 完成v-PSG监测的帕金森病患者共53例,其中睡眠障碍组31例,非睡眠障碍组22例。睡眠障碍组总睡眠时间、睡眠效率、N3期比例、快速动眼睡眠(REM)期比例低于非睡眠障碍组,而周期性肢动指数、N1期比例、N2期比例高于非睡眠障碍组,差异均有统计学意义(P<0.01)。见表1。
2.2 两组基本资料比较 睡眠障碍组多巴丝肼片等效剂量、HAMA、HAMD、ESS、Hcy水平高于非睡眠障碍组,而PDSS、TG、TC、尿酸水平低于非睡眠障碍组,差异均有统计学意义(P<0.05)。见表2。
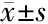
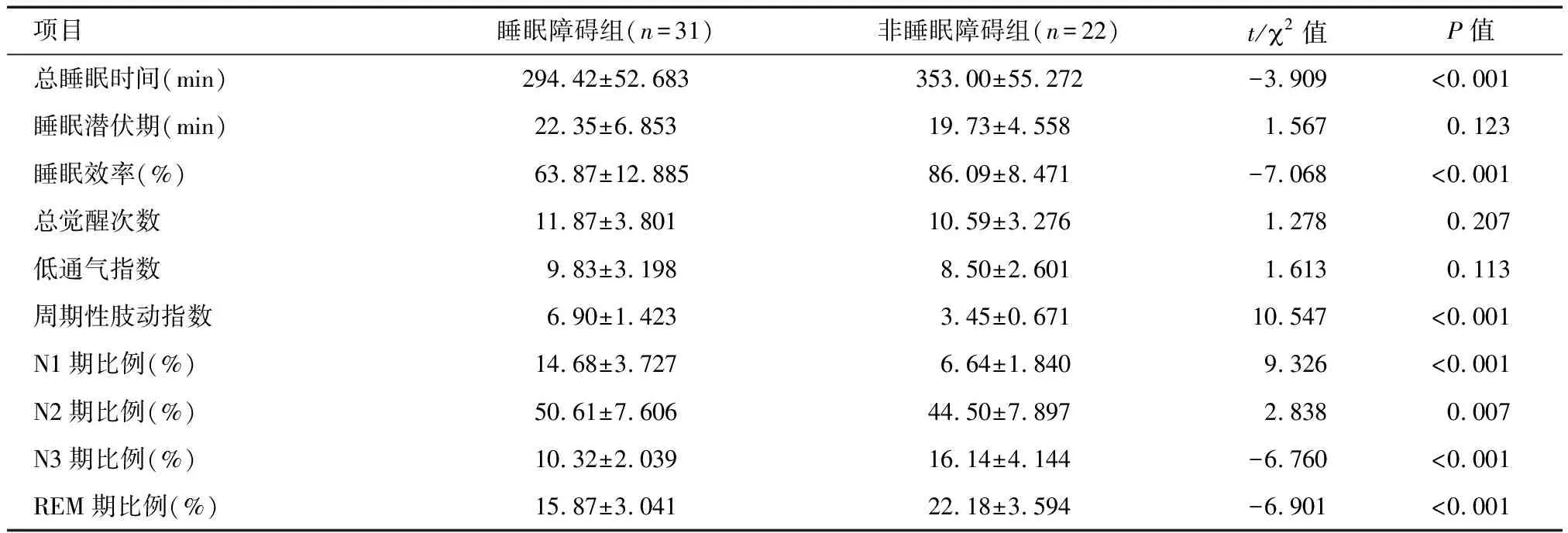
项目睡眠障碍组(n=31)非睡眠障碍组(n=22)t/2值P值总睡眠时间(min)294.42±52.683353.00±55.272-3.909<0.001睡眠潜伏期(min)22.35±6.85319.73±4.5581.5670.123睡眠效率(%)63.87±12.88586.09±8.471-7.068<0.001总觉醒次数11.87±3.80110.59±3.2761.2780.207低通气指数9.83±3.1988.50±2.6011.6130.113周期性肢动指数6.90±1.4233.45±0.67110.547<0.001N1期比例(%)14.68±3.7276.64±1.8409.326<0.001N2期比例(%)50.61±7.60644.50±7.8972.8380.007N3期比例(%)10.32±2.03916.14±4.144-6.760<0.001REM期比例(%)15.87±3.04122.18±3.594-6.901<0.001
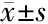
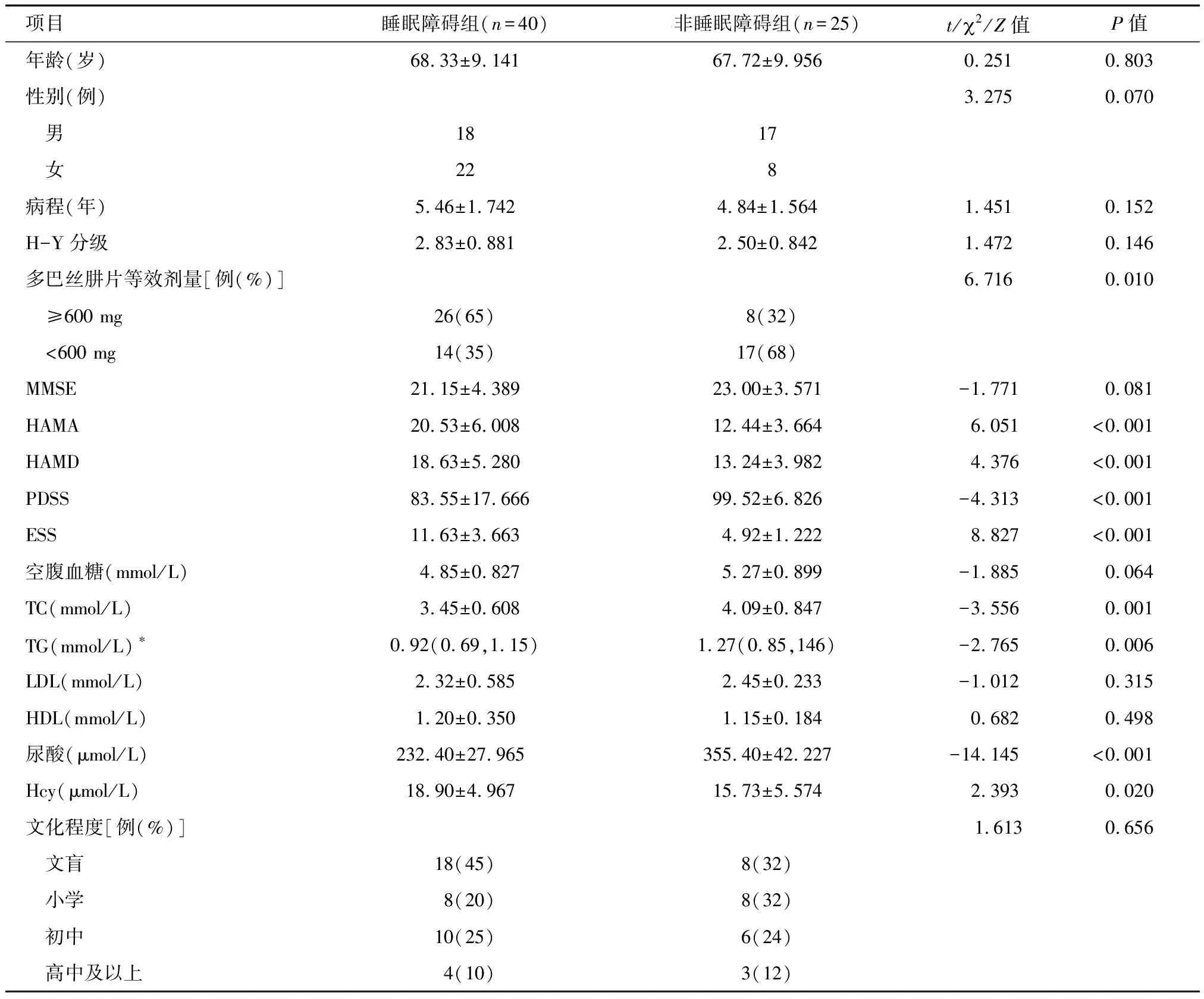
项目睡眠障碍组(n=40)非睡眠障碍组(n=25)t/2/Z值P值年龄(岁)68.33±9.14167.72±9.9560.2510.803性别(例)3.2750.070 男1817 女228病程(年)5.46±1.7424.84±1.5641.4510.152H-Y分级2.83±0.8812.50±0.8421.4720.146多巴丝肼片等效剂量[例(%)]6.7160.010 ≥600 mg26(65)8(32) <600 mg14(35)17(68)MMSE21.15±4.38923.00±3.571-1.7710.081HAMA20.53±6.00812.44±3.6646.051<0.001HAMD18.63±5.28013.24±3.9824.376<0.001PDSS83.55±17.66699.52±6.826-4.313<0.001ESS11.63±3.6634.92±1.2228.827<0.001空腹血糖(mmol/L)4.85±0.8275.27±0.899-1.8850.064TC(mmol/L)3.45±0.6084.09±0.847-3.5560.001TG(mmol/L)∗0.92(0.69,1.15)1.27(0.85,146)-2.7650.006LDL(mmol/L)2.32±0.5852.45±0.233-1.0120.315HDL(mmol/L)1.20±0.3501.15±0.1840.6820.498尿酸(μmol/L)232.40±27.965355.40±42.227-14.145<0.001Hcy(μmol/L)18.90±4.96715.73±5.5742.3930.020文化程度[例(%)] 1.6130.656 文盲18(45)8(32) 小学8(20)8(32) 初中10(25)6(24) 高中及以上4(10)3(12)
*M(P25,P75)
2.3 TG、TC、尿酸、Hcy、多巴丝肼片等效剂量、HAMA、HAMD与睡眠障碍的相关性 TG、TC、尿酸水平与睡眠障碍呈负相关(r=-0.346、-0.379、-0.839,P<0.01),多巴丝肼片等效剂量、Hcy、HAMA、HAMD水平与睡眠障碍呈正相关(r=0.321、0.287、0.615、0.445,P<0.05)。见表3。
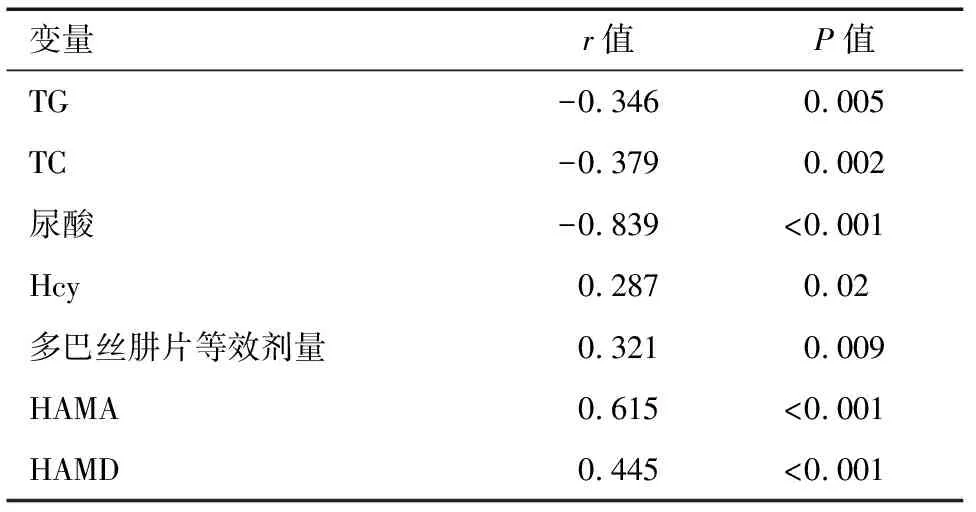
表3 各因素与睡眠障碍的相关性分析
2.4 影响睡眠障碍相关因素logistic回归分析 多巴丝肼片等效剂量、HAMA、HAMD的水平增高可能是睡眠障碍发生的危险因素,尿酸、TG、TC降低可能是睡眠障碍发生的保护因素。见表4。
3 讨论
睡眠障碍在帕金森病患者中的发生率极高,影响60%~98%的患者[8],且其表现形式多样,包括失眠、白日嗜睡、快动眼睡眠行为障碍、周期性肢动等。研究发现帕金森病患者的睡眠障碍的发生不仅仅是病理学的改变,而是多因素共同作用的结果[9]。多导睡眠图能客观反映患者睡眠结构、效率以及睡眠中的异常行为特点,在睡眠障碍的诊断中被认为是评价睡眠障碍的金标准[10]。
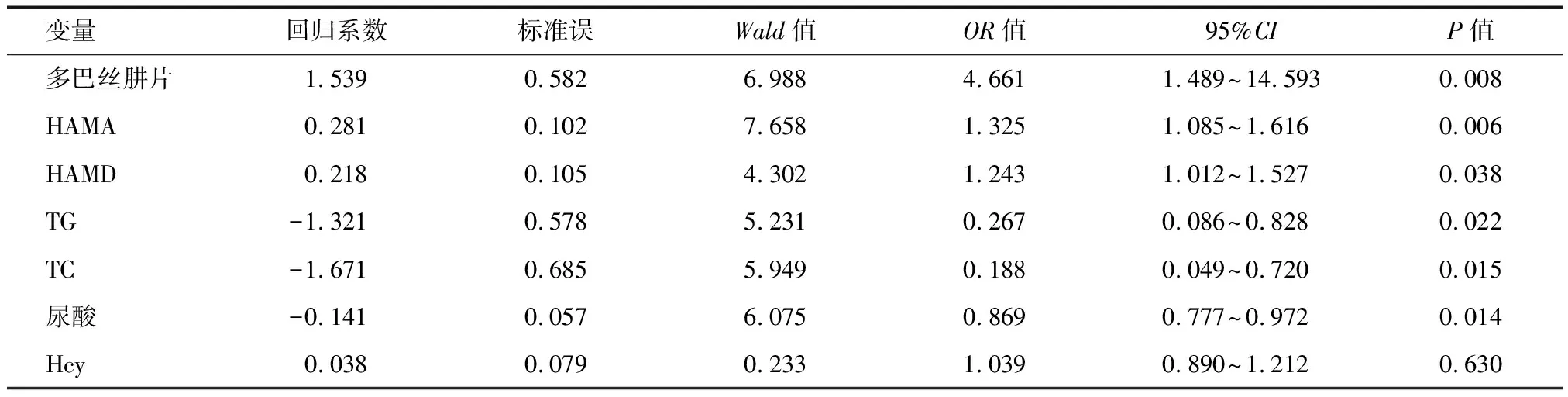
表4 睡眠障碍相关影响因素logistic回归分析
本研究通过睡眠量表及视频多导睡眠图监测的方式发现石河子地区61.5%的帕金森病患者患有睡眠障碍。通过多导睡眠图监测发现帕金森病睡眠障碍患者睡眠结构是紊乱的,睡眠障碍组的总睡眠时间、睡眠效率、N3期比例、REM期比例低于非睡眠障碍组,而周期性肢动指数、N1期比例、N2期比例高于非睡眠障碍组。同时睡眠障碍组患者PDSS评分明显降低,而ESS得分明显升高,提示帕金森病患者睡眠障碍具有睡眠质量下降和白日嗜睡并存的特点,其原因可能与帕金森病患者蓝斑、黑质等神经核变性有关。本研究发现非睡眠障碍组与睡眠障碍组病程、H-Y分级比较并无差异,这与郭鹏等[6]研究一致,提示睡眠障碍可能于疾病的早期已经发生,对睡眠障碍的早期防治有可能预防及延缓帕金森病的发生发展。
进一步对帕金森病睡眠障碍影响因素分析,显示多巴丝肼片等效剂量、HAMA、HAMD、Hcy与睡眠障碍呈正相关,TG、TC、尿酸与睡眠障碍呈负相关。同时多因素logistic回归分析发现多巴丝肼片等效剂量、HAMA、HAMD的水平增高可能是睡眠障碍发生的危险因素,而尿酸、TG、TC可能是睡眠障碍发生的保护因素。其中与多巴丝肼片等效剂量<600 mg相比,多巴丝肼片等效剂量≥600 mg者发生睡眠障碍的风险增加4.661倍。有研究发现多巴胺能药物对睡眠起到双向调节作用,小剂量使用可改善睡眠,而大剂量会引起睡眠破裂及潜伏期的延长[11],小剂量使用多巴丝肼片将有助于改善帕金森病患者睡眠,但其具体界值有待于大数据研究证实。
同样在帕金森病睡眠障碍患者中发现HAMA、HAMD评分高于非睡眠障碍组,HAMA、HAMD评分升高是帕金森患者睡眠障碍发生的危险因素。考虑其可能与多巴胺、去甲肾上腺素和5-羟色胺等神经递质改变以及患者对自身疾病的心因性反应有关[12]。且严重的睡眠障碍会进一步加重焦虑抑郁,两者互相影响,因此早期发现患者的焦虑抑郁情绪,将有助于睡眠障碍的改善。
尿酸、血脂水平增高被认为是心脑血管的危险因素,但近年发现尿酸是一种天然的抗氧化剂,对多巴胺能神经元具有保护作用[13]。并发现血脂水平的稳定是神经元发挥正常功能的关键因素之一,血脂代谢平衡障碍可能是帕金森病的危险因素[14]。在本研究中发现,尿酸、血脂与帕金森病患者睡眠障碍的发生有密切关系,logistic回归分析显示尿酸、TC、TG是帕金森病睡眠障碍发生的保护因素,其可能有助于防止帕金森病的发生,有望成为间接预测帕金森病及其睡眠障碍发生的生物标志物[15-16]。
综上所述,多巴丝肼片等效剂量、HAMA、HAMD的水平升高可能是帕金森病睡眠障碍发生的危险因素,而尿酸、TG、TC水平升高可能是帕金森病睡眠障碍发生的保护因素,因此低剂量使用多巴丝肼片、控制焦虑抑郁情绪有助于控制或延缓帕金森病睡眠障碍的发生、发展,尿酸、TC、TG可能有助于防止帕金森病的发生。因本研究样本量少,且为单中心研究,尚需进一步大量研究证实。
