别嘌醇抑制黄嘌呤氧化酶对缺氧和高氧大鼠心率变异性的影响*
2020-02-29黄永跃宋迎婧
黄永跃, 宋迎婧
1临海市第一人民医院心内科(浙江台州 317000); 2临海市中医院心内科(浙江台州 317000)
心率变异性(HRV) 是目前基于临床方法定量评价自主神经功能的一种无创性指标,它能够客观地反映交感神经、迷走神经的活性变化及两者的均衡性及其对心血管活动的影响。虽然HRV参数的生理意义尚未完全阐明[1],但传统的心率变异时域和频域分析方法为测量迷走神经张力和交感神经放电量提供了可靠的手段[1-2]。研究表明活性氧在动脉氧压方面起巨大作用,且能够影响心脏的自主调节[3]。而黄嘌呤氧化酶(XO)在嘌呤新陈代谢中扮演重要角色,且是活性氧的主要内源性来源,在缺氧状态下其含量将会上升,从而引起氧化应激。别嘌醇抑制XO活性可以减少氧化应激,防止氧化应激引起的细胞损伤以及缺血性并发症[4]。已有研究表明别嘌醇可以缓解血管损伤、炎症、心力衰竭和缺血心肌[4-6]。但别嘌醇对大鼠HRV的影响及XO如何抑制心率神经源性的调节尚不明确。为此,2018年2月至2019年2月期间,本研究基于HRV分析技术,探讨别嘌醇标准常压条件下,以及控制在缺氧和高氧条件下激活或抑制外周化学反射时对大鼠HRV的影响。
1 材料与方法
1.1 实验动物 健康雄性Wistar大鼠(350 g) 16只。自由摄食饮水,标准的大气条件下保持12 h∶12 h的明暗循环。自适应实验环境饲养1周,戊巴比妥钠 (50 mg/kg)腹腔麻醉大鼠。
1.2 大鼠缺氧、高氧控制 大鼠置于明聚碳酸酯室内,通过自动可调压力调节器创造低压缺氧或高氧的条件。由PowerLab 26T压力传感器监测室内的压力。通过高阻气流PE-10管与外部环境连接(Clay-Adams, Parsippany, USA)给实验中聚碳酸酯室提供稳定的CO2张力。上述大鼠连续3 d接受了4个阶段的实验(4 h):(1)常压常氧(即基线条件),大鼠置于标准大气压条件下保持良好通风的室中1 h;(2)低压缺氧(激活化学反射和唤起氧化应激),大鼠置于可控制的低压缺氧条件1 h;(3)常压高氧(抑制化学反射反应),大鼠置于常压高氧条件1 h,室内氧气浓度至少充满90%;(4)复氧(标准常压条件下恢复),大鼠重新置于室内通风、常压常氧条件下1 h。
1.3 分组 大鼠随机分为对照组和别嘌醇组,每组8只。别嘌醇组注射二甲基亚砜(DMSO, Sigma, St. Louis, USA;别嘌醇溶剂),置于聚碳酸酯室内,接受上述4 h的实验后,进行心率变异性(HRV)分析后,腹腔注射XO抑制剂别嘌醇(50 mg/kg)。次日,开始实验前注射相同溶剂,而对照组则给予等体积的生理盐水,进行HRV分析。每次给药前,在DMSO中重新配置别嘌醇。
1.4 血浆蛋白氧化试验 蛋白质羰基含量使用2,4-二硝基苯肼(DNPH)比色法测定。将血浆样本(100 μL)与100 μL 与含2,4-二硝基苯肼的 HCl 溶液(20 mmol/L) 混合后室温孵育60 min后再添加500 μL 20%三氯乙酸震荡以1 000×g离心7 min,弃上清。由上述过程所得的蛋白沉淀物用1 mL体积比为1∶1的乙醇、乙酸乙酯混合溶液洗涤3次并再次离心。去上清液后用1 mL,10 mmol/L的磷酸钠缓冲液(pH 6.5,含6 mol/L盐酸胍)重新配制,将混合物在50℃条件下连续振荡至颗粒溶解后,分别在280 nm 和360 nm波长下测定蛋白质和羰基含量。
1.5 血脂过氧化试验 血浆8-异前列腺素F2α(8-ios-PGF2α)浓度测定则根据说明书使用抗原竞争ELISA 试剂盒(Cayman Chemicals, Ann Arbor, USA)检测。
1.6 抗氧化酶活性测定 根据说明书,分别使用Cayman检测试剂盒对XO、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)和过氧化氢酶(CAT) 进行活性评估。
1.7 HRV分析 使用PowerLab 26T记录高分辨率(4 kHz)心电图(ECG)对所有QRS复合波进行检查。采用心电自动r峰检测进行RR间期(RRi)鉴定。由专用软件Kubios Pro 2.0进行自动纠正RR间隔或零星的伪峰值相差超过3个标准差的数值。采用λ=2 000的HRV光谱,以此来分析之前的滤波数据集。校正 RRi-时间序列后,得到正常的RR区间,使用KubiosPro 2.0软件和Microsoft Excel进行HRV分析,得到心率变异的时域指标RR间期标准差(SDNN)和相邻RR间期差的均方根(rMSSD)和频域指标的低频(LF)、高频(HF)和总功率谱(TSP)及低高频比(LF/HF)值。
1.8 统计学方法 采用Statistica 12和GraphPad Prism 5进行统计分析。所有数据均以平均值±标准差表示,采用Shapiro-Wilk检验对所有数据组进行正态检验,依据数据呈正态或非正态分布,采用Mann-Whitney、Wilcoxon检验和t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 别嘌醇对抗氧化酶活性的影响 在注射别嘌醇(50 mg/kg)的大鼠体内,XO活性与对照组相比降低了87%,见表1。与对照组相比,别嘌醇组SOD活性显著升高(P=0.038),别嘌醇组CAT或GPx活性增加趋势差异无统计学意义(P=0.117,P=0.058)。
2.2 别嘌醇对氧化应激标志物的影响 别嘌醇组较对照组血浆中8-ios-PGF2α浓度显著降低(P=0.008),然而XO抑制并未导致血浆蛋白羰基的相关变化(P=0.147)。见表1。
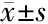
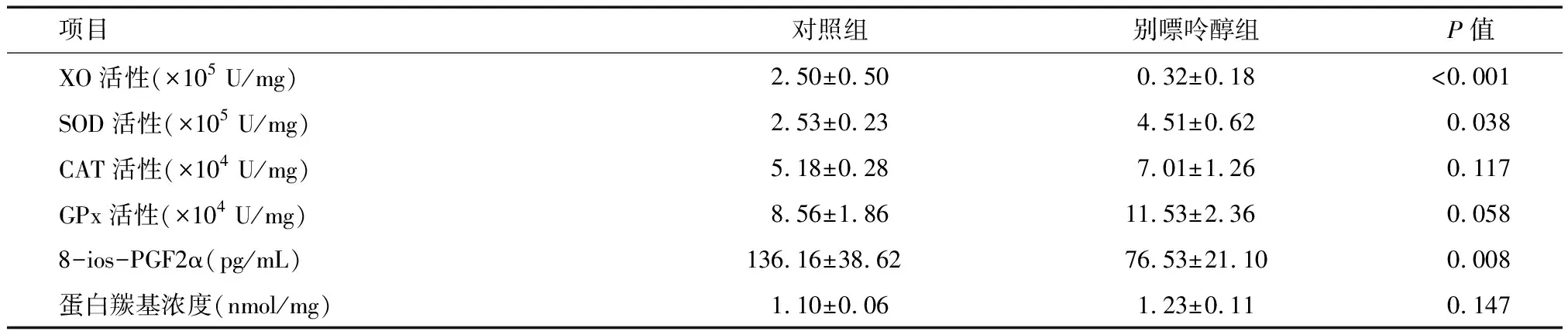
项目对照组别嘌呤醇组P值XO活性(×105 U/mg)2.50±0.500.32±0.18<0.001SOD活性(×105 U/mg)2.53±0.234.51±0.620.038CAT活性(×104 U/mg)5.18±0.287.01±1.260.117GPx活性(×104 U/mg)8.56±1.8611.53±2.360.0588-ios-PGF2α(pg/mL)136.16±38.6276.53±21.100.008蛋白羰基浓度(nmol/mg)1.10±0.061.23±0.110.147
2.3 缺氧或高氧对具有XO活性大鼠的HRV的影响 在别嘌醇给药前,对照组与作为别嘌醇溶剂的DMSO组的HRV对缺氧、高氧或恢复正常氧的反应相似,差异无统计学意义(P>0.05)。观察到缺氧和高氧都会影响大鼠的HRV,缺氧后迷走神经放电增强,rMSSD显著升高(P<0.05), HF显著升高(P<0.05),接下来的高氧状态下rMSSD和HF均低于缺氧水平(P<0.05)。在缺氧或高氧时,交感迷走神经平衡的时域SDNN/rMSSD或频域指标LF/HF均有轻微下降,但差异无统计学意义(P>0.05)。见表2。
2.4 别嘌醇的调节作用 在缺氧或高氧情况下,别嘌醇增强了整体自主神经活性,表现在SDNN、TSP和LF较别嘌醇给药前显著增加(P<0.05,P<0.01),副交感神经驱动也增强,rMSSD和HF增加(P<0.05)。自主平衡指标LH/HF和SDNN/rMSSD则差异无统计学意义(P>0.05)。
3 讨论
本研究发现在控制的低压缺氧和高氧条件下,抑制XO能显著影响心律的神经源性调节。别嘌醇组整体自主控制显著增加,包括在缺氧条件下迷走神经驱动的增加,以及在随后的高氧状态下下降。因为这种调节反应能够控制广泛迷走神经放电的固有窦房结起搏器优势神经源性,而后者是稳定心律的先决条件,且可预防室性心律失常[7-8]。
HRV分析已经在人类研究和临床实践中广泛应用[3],大多数研究都关注心脏神经源性调节的非侵入性评价,仅有少数研究关注抗氧化剂的调节作用。大鼠的HRV光谱与人类的相似,显示出两个主要的频率成分:低频和高频[9]。在本研究中,HRV在时域和频域的分析表明XO抑制对缺氧和高氧刺激引起的HRV变化的方向是相同的。在对照组中,SDNN和TSP在缺氧状态下升高,而在高氧状态下降低,而XO抑制后较对照组在缺氧和高氧中呈现相同上升趋势。虽然缺氧和缺氧后高氧均可诱导氧化应激[10-11],但在缺氧或高氧状态下HRV变化的不同方向与缺氧化学感受器激活后的高氧抑制一致[12]。高TSP或SDNN表明心脏可以很容易地应对循环需求的改变,如血压升高、运动等[13]。整体HRV较低与心血管预后不良有关,这表明心律控制松散,高度依赖于局部固有的自律细胞以随机模式放电。与以SDNN和TSP为代表的整体HRV的变化相似,别嘌醇在缺氧时显著增加副交感神经活动的rMSSD和HF,在高氧时也有增加。XO抑制对缺氧和高氧的交感迷走神经均没有显著影响,它并没有影响HRV指标 LF/HF和SDNN/rMSSD。
RRi的进一步增加表明迷走神经对窦房结起搏点的支配性增强,与LF/HF和SDNN/rMSSD比值的适度增加有关,这与交感神经增益相反。这种不一致的可能解释是在交感神经和迷走神经传出物同时显著激活的情况下,从HRV数据来看(LF和HF均显著增加),交感神经对心率的影响可以忽略不计。这与之前的一项研究相一致,清醒大鼠的缺氧并未引起腰神经活动的相关变化[14]。早期的报道有关大鼠对缺氧的心率反应并不一致,有文献记载大鼠缺氧后心率升高或无变化或降低[15-16]。而动物实验报道大鼠对缺氧的心率反应大多来自于手术后应激、麻醉或相对较高的基础交感神经张力[17]。
本研究结果表明抑制XO可减少氧化应激,但对蛋白羰基无影响,表明血浆蛋白不是XO衍生ROS的主要靶点。另一方面,在大鼠模型上已证实异丙肾上腺素起源的氧化应激会导致心肌损伤与糖尿病[18],别嘌醇可能同时影响脂类的结构以及后续血清和心脏中的脂类和蛋白质的功能。由于本研究主要关注的是神经源性调节机制,而不是心脏起搏器的内在活动,因此实验主要关注与血浆相关的氧化应激。在缺氧/高氧实验后,XO抑制剂引起了酶抗氧化防御作用的增加。SOD、CAT和GPx是细胞抗氧化防御系统的重要酶,大鼠在注射别嘌醇后SOD、CAT和GPx活性都呈增加趋势,与最近关于别嘌醇对接受缺血性再灌注损伤大鼠的影响的相关研究一致[19]。
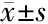

项目常氧缺氧高氧复氧RRi(ms) 对照组190±7.72206±10.12222±4.76∗ 209±4.25∗ DMSO(别嘌醇注射前)181±5.58 211±8.35∗217±7.41∗∗203±9.90∗ 别嘌醇组185±4.45 239±5.96∗∗△219±4.04∗∗210±4.92∗∗△SDNN(ms) 对照组4.03±0.354.41±0.803.16±0.37∗4.98±0.60 DMSO(别嘌醇注射前)4.23±0.696.08±1.122.72±0.40∗4.11±0.60 别嘌醇组4.13±0.3511.36±0.66∗△4.94±0.25△#4.55±0.40rMSSD(ms) 对照组3.53±0.354.14±0.742.84±0.434.63±0.80 DMSO(别嘌醇注射前)3.29±0.455.39±0.59∗2.58±0.313.73±0.59 别嘌醇组3.41±0.267.76±0.46∗△4.71±0.24∗△4.18±0.46SDNN/rMSSD 对照组1.17±0.091.09±0.091.17±0.131.18±0.14 DMSO(别嘌醇注射前)1.26±0.051.10±0.131.04±0.041.13±0.06 别嘌醇组1.32±0.041.19±0.071.11±0.06∗1.16±0.07TSP(ms2) 对照组16.15±2.1119.44±6.647.81±1.23∗∗20.67±3.51 DMSO(别嘌醇注射前)19.72±7.2029.94±7.026.90±2.3114.42±3.95 别嘌醇组17.94±3.42138.34±14.57∗∗△15.35±1.19△19.04±2.42LF(ms2) 对照组2.43±0.132.55±0.981.25±0.35∗4.06±0.90 DMSO(别嘌醇注射前)4.18±1.635.75±1.841.68±0.684.65±1.15 别嘌醇组3.30±0.7738.56±4.03△△2.86±0.35∗∗△4.36±0.66HF(ms2) 对照组3.73±0.744.16±1.242.32±0.646.53±1.76 DMSO(别嘌醇注射前)3.52±1.206.37±1.091.66±0.315.04±1.48 别嘌醇组3.62±0.6418.27±1.80∗∗△6.99±0.33△#5.79±1.05LF/HF 对照组0.84±0.180.64±0.140.81±0.370.87±0.25 DMSO(别嘌醇注射前)1.17±0.131.03±0.430.90±0.231.18±0.30 别嘌醇组1.28±0.311.54±0.711.16±0.201.13±0.18
注:与常氧状态比较 *P<0.05,**P<0.01;与DMSO(别嘌醇注射前)比较 △P<0.05,△△P<0.01; #与高氧状态比较P<0.05
大鼠基础XO活性远高于人类,但其作为氧化剂的破坏性作用也远高于人类[20]。然而,研究数据表明,在缺血或缺血后再灌注期间,XO产生的ROS迅速增多,因此XO被认为是氧化应激的重要触发因素。综上所述,别嘌醇可降低意识不受约束大鼠缺氧和缺氧后高氧引起的氧化应激。在标准的常氧条件下,XO抑制作用可能不干扰神经源性心脏调节。然而别嘌醇作为氧化剂干扰氧传感激活化学反射的概念并没有得到相关数据的支持。此外,在缺氧条件下,当化学反射被激活时,XO抑制剂别嘌醇增强了自主神经对心率的影响,增加了迷走神经的作用,为在缺氧条件下使用XO抑制剂提供了依据。
