响应面法优化黄浆水发酵液制备工艺及其抗氧化活性研究
2020-02-29王珊珊孙晓琦马玉洁李娜周德庆
王珊珊,孙晓琦,马玉洁,李娜,周德庆,2,*
(1.中国水产科学研究院黄海水产研究所,山东青岛266071;2.青岛海洋科学与技术试点国家实验室海洋药物与生物制品功能实验室,山东青岛266000)
豆腐作为一种常见的餐桌食物,距今已有近2 000 年的历史。豆腐具有口感嫩滑、豆香浓郁、营养价值高、种类丰富且易于消化吸收等诸多优点,深受世界各国人民的欢迎[1]。一般豆腐的制作主要由浸泡、磨浆、过滤、煮浆、点脑、蹲脑、破脑、压榨成型等几个环节组成[2]。黄浆水是豆腐在压榨成型时产生的乳清废水,产量大,成分复杂,含有较多有益于人体的大豆异黄酮、蛋白质、皂苷、低聚糖等生物活性成分,具有较高的开发利用价值。据统计,每加工1 t 大豆可排放2 t~5 t 黄浆水[3-4]。由于豆制品加工厂大多规模较小,受加工工艺和设备的制约,大部分黄浆水被当成废水简单处理后排放,造成资源的极大浪费。
近年来,对大豆黄浆水进行绿色、经济、高效的综合利用开始引起人们的重视。张瑞等采用脱腥、酶解和配制方式进行新型黄浆水配制酱油的研制,所得产品在色泽、香气和滋味上均与市面酿造产品无显著性差异[5];邓丽华等采用正交试验对黄浆水进行醋酸发酵制醋,在经过培养7 d 后即达到酸度>3.5%[6];李丽梅等采用脱臭、澄清、调配等工艺研制黄浆水红枣复合饮料,制得的产品口感柔和、组织状态均匀一致[7]。但目前利用乳酸菌发酵提高黄浆水抗氧化活性的研究报道相对较少。前期试验表明,植物乳杆菌、清酒乳杆菌和嗜酸乳杆菌均可在黄浆水中生长产酸,3 种菌株组合发酵后黄浆水的抗氧化活性有显著提高[8]。本试验在前期研究基础上,通过单因素试验及响应面法对黄浆水发酵液制备工艺进行优化,为进一步开发黄浆水发酵饮料提供技术支持。
1 材料与方法
1.1 材料与试剂
黄浆水:青岛三聚成有限公司;植物乳杆菌CICC 20265(Lactobacillus plantarum)、嗜酸乳杆菌 CICC 22162(Lactobacillus acidophilus)、清酒乳杆菌 CICC 6245(Lactobacillus sakei):中国工业微生物菌种保藏中心;总抗氧化能力检测试剂盒(ABTS 法):南京建成生物工程研究所;MRS 培养基:北京陆桥技术股份有限公司;其它试剂均为国产分析纯。
1.2 仪器与设备
UV1102Ⅱ紫外/可见分光光度计:上海天美科学仪器有限公司;HCB-1300V 垂直层流洁净工作台:青岛海尔医疗有限公司;Neofuge 15R 高速冷冻离心机:力康生物医疗科技控股有限公司;FD5 真空冷冻干燥机:金西盟公司;RE-52AA 旋转蒸发仪:上海亚荣仪器有限公司。
1.3 方法
1.3.1 发酵组合菌种的准备
将植物乳杆菌、嗜酸乳杆菌和清酒乳杆菌分别置于MRS 固体培养基上,于37 ℃条件下活化培养20 h,再以10%接种量接种于MRS 液体培养基。37 ℃培养20 h 后,4 000 r/min 离心5 min,用无菌生理盐水洗涤乳酸菌两次后制备菌悬液,使其浓度为8 log cfu/mL。将植物乳杆菌、嗜酸乳杆菌和清酒乳杆菌的菌悬液按照1 ∶1 ∶1 的体积比混合作为发酵组合菌种,接种量以待接种的黄浆水体积计算[9]。
1.3.2 黄浆水发酵液的制备
向100 mL 黄浆水中添加5%葡萄糖和5%脱脂奶粉,混匀后于115 ℃条件下灭菌10 min。然后在无菌条件下接入1%活化后的发酵组合菌种,37 ℃恒温发酵,测定发酵液提取物的DPPH 自由基清除率。
1.3.3 提取物的制备
分别取100 mL 发酵前后的黄浆水,40 ℃下旋蒸浓缩至10 mL,加入100 mL 80%乙醇,超声辅助提取40 min 后,离心(10 000 r/min,4 ℃,10 min)取上清液,40 ℃旋蒸浓缩后,真空冷冻干燥得到提取物。用80%乙醇配成不同浓度梯度的待测样品液,用于抗氧化活性的测定。
1.3.4 DPPH 自由基清除率的测定
取2 mL 不同浓度梯度待测样品液,加入2 mL 0.2 mmol/L DPPH·乙醇溶液,混匀后避光静置30 min,于 517 nm 处测吸光值[10]。
DPPH 自由基清除率/%=[(1-(A样液-A空白)/A对照)]×100
式中:A样液为2 mL 待测样品液与等体积DPPH·乙醇溶液混合反应后的吸光值;A空白为2 mL 待测样品液与等体积无水乙醇混合后的吸光值;A对照为2 mL无水乙醇与等体积DPPH·乙醇溶液混合后的吸光值。
1.3.5 单因素试验
固定发酵温度37 ℃、发酵时间24 h、脱脂乳粉添加量5%、葡萄糖添加量5%、接种量1%为基本条件,以DPPH 自由基清除率为测定指标,进一步探究发酵温度(28、31、34、37、40、43 ℃)、发酵时间(12、24、36、48、60、72 h)、脱脂乳粉添加量(1%、3%、5%、7%、9%、11%)、葡萄糖添加量(0.5%、1%、2%、3%、4%、5%、6%)及接种量(0.5%、1%、2%、3%、4%、5%)对发酵液提取物DPPH 自由基清除率的影响。
1.3.6 响应面试验设计
在单因素试验的基础上,以DPPH 自由基清除率为指标,以发酵时间(A)、脱脂乳粉添加量(B)、葡萄糖添加量(C)三个因素为自变量,根据Box-Behnken 试验设计原理,采用软件Design-Expert V8.0.6.1 设计三因素三水平的响应面分析试验,因素与水平设计如表1 所示。
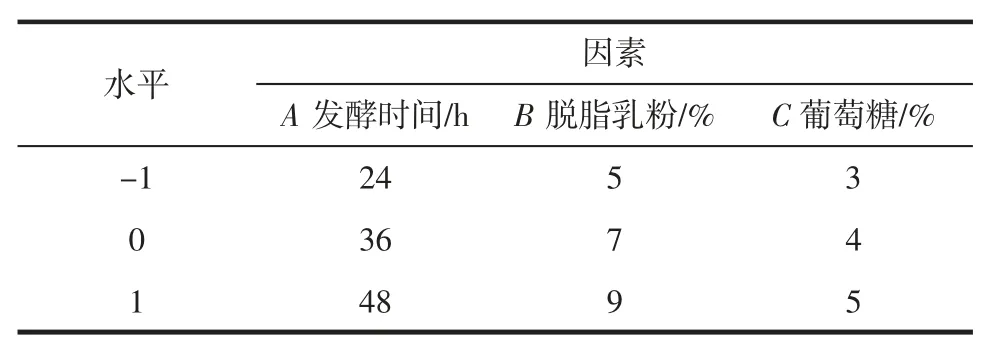
表1 响应面优化试验因素与水平Table 1 Factors and their coded values used in response surface analysis
1.3.7 对羟自由基清除率的测定
取1 mL 不同浓度的待测样品液,依次加入0.5 mL 2 mmol/L EDTA-Fe2+溶液、1 mL 20 mmol/L 磷酸盐缓冲液(phosphate buffer saline,PBS,pH=7.4) 溶液、1 mL 360 μg/mL 番红花 T 溶液、1 mL 3 %H2O2溶液,混匀,37 ℃水浴 30 min,于 520 nm 处测吸光值[11]。
羟自由基清除率/%=[(A样液-A空白)/(A对照-A空白)]×100
式中:A样液为待测样液吸光值;A空白为 PBS 代替样液做空白对照的吸光值A对照为PBS 代替样液和H2O2的吸光值。
1.3.8 对ABTS 自由基清除率的测定
使用A015-2 试剂盒进行测定,具体操作方法与结果处理参见南京建成生物工程研究所相应说明书。
1.4 统计分析
每组试验重复3 次,测试结果以平均值±标准偏差的形式表示;使用SPSS 20.0 软件进行数据处理。
2 结果与分析
2.1 单因素验试结果
2.1.1 发酵温度对黄浆水发酵液DPPH 自由基清除率的影响
发酵温度对黄浆水发酵液DPPH 自由基清除率的影响见图1。
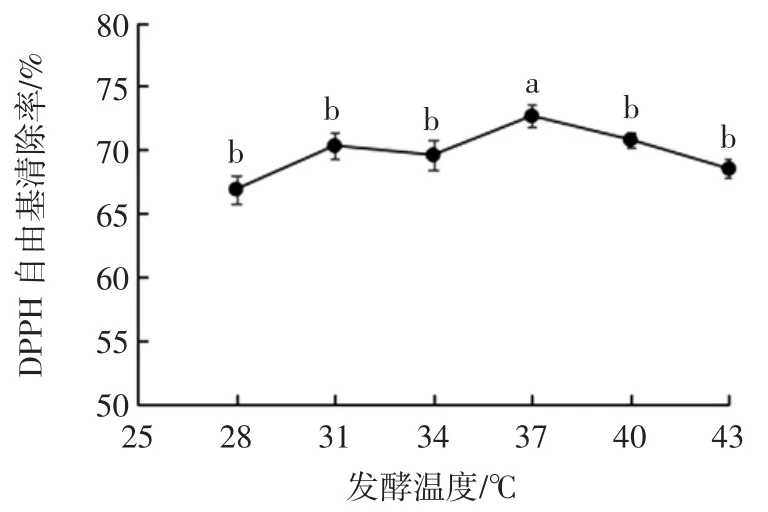
图1 发酵温度对黄浆水发酵液DPPH 自由基清除率的影响Fig.1 Effect of fermentation temperature on the DPPH radical scavenging rate
由图1 可知,在28 ℃~43 ℃的发酵温度范围内,黄浆水发酵液的DPPH 自由基清除率变化幅度较小。当发酵温度为37 ℃时,发酵液的DPPH 自由基清除率(72.67%)显著高于其他发酵温度(P<0.05)。因此确定37 ℃为发酵黄浆水的最佳温度。
2.1.2 发酵时间对黄浆水发酵液DPPH 自由基清除率的影响
发酵时间对黄浆水发酵液DPPH 自由基清除率的影响见图2。

图2 发酵时间对黄浆水发酵液DPPH 自由基清除率的影响Fig.2 Effect of fermentation time on the DPPH radical scavenging rate
由图2 可知,与未发酵黄浆水相比,发酵12 h 的黄浆水对DPPH 自由基的清除率从56.68 %升高到67.27%。此后随着发酵时间的延长,发酵液的DPPH自由基清除率持续升高,直到第36 h 达到最高(74.32%)。这可能是由于发酵过程中复杂的大分子酚类物质被逐渐转化为小分子游离酚类物质,小分子酚类物质易于给出H+,H+能够与DPPH 自由基发生共振杂化生成稳定产物[12-13]。第36 h~第60 h 时发酵液的DPPH 自由基清除率开始降低,这可能是由于发酵液中的小分子游离酚类等抗氧化物质被乳酸菌进一步分解,降低了发酵液总体的抗氧化活性。因此,适宜的发酵时间为36 h。
2.1.3 脱脂乳粉添加量对黄浆水发酵液DPPH 自由基清除率的影响
脱脂乳粉添加量对黄浆水发酵液DPPH 自由基清除率的影响见图3。

图3 脱脂乳粉添加量对黄浆水发酵液DPPH自由基清除率的影响Fig.3 Effect of skimmed milk powder content on the DPPH radical scavenging rate
由图3 可知,随着脱脂乳粉添加量的增加,黄浆水发酵液对DPPH 自由基的清除率呈现上升趋势,在脱脂乳粉添加量为7 %时,其DPPH 自由基清除率为75.38%。此后随着脱脂乳粉的添加量继续增加,发酵液的DPPH 自由基清除能力则有所降低。因此,适宜的脱脂乳粉添加量为7%。
2.1.4 葡萄糖添加量对黄浆水发酵液DPPH 自由基清除率的影响
葡萄糖添加量对黄浆水发酵液DPPH 自由基清除率的影响见图4。
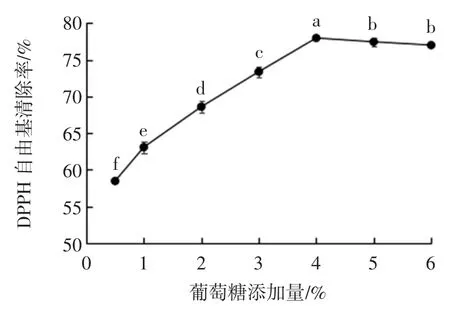
图4 葡萄糖添加量对黄浆水发酵液DPPH 自由基清除率的影响Fig.4 Effect of glucose content on the DPPH radical scavenging rate
由图4 可知,当葡萄糖添加量为0.5%~4%时,黄浆水发酵液的DPPH 自由基清除能力逐渐升高。当添加量为4%时,发酵液对DPPH 自由基的清除率达到最高(77.99%)。在此之后,黄浆水发酵液的抗氧化活性则逐步趋于稳定。因此,适宜的葡萄糖添加量为4%。
2.1.5 接种量对黄浆水发酵液DPPH 自由基清除率的影响
接种量对黄浆水发酵液DPPH 自由基清除率的影响见图5。
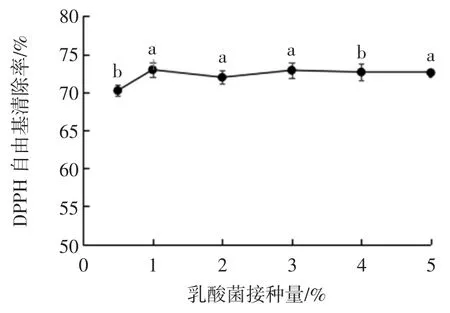
图5 接种量对黄浆水发酵液DPPH 自由基清除率的影响Fig.5 Effect of inoculum concentration on the DPPH radical scavenging rate
接种量的高低会影响发酵初期乳酸菌的生长速度,接种量过低时,乳酸菌生长的延滞期变长易导致杂菌污染,甚至发酵失败;接种量过高时,乳酸菌延滞期缩短并很快到达对数生长期,营养物质在此阶段被迅速消耗掉,不利于后期发酵的持续性进行,因此适宜的接种量有利于发酵过程的良好进行[14]。由图5 可知,当接种量为1%~5%时,发酵液的DPPH 自由基清除率无显著性差异,当接种量为0.5 %时,发酵液DPPH 自由基清除率则相对较低。考虑到经济等因素,将发酵黄浆水的最适接种量定为1%。
2.2 响应面分析法优化黄浆水发酵液制备工艺
2.2.1 响应面优化试验结果与分析
综合单因素试验结果,固定乳酸菌接种量1%,发酵温度37 ℃,选择发酵时间(A)、脱脂乳粉添加量(B)、葡萄糖添加量(C)3 个因素为自变量,以黄浆水发酵液提取物DPPH 自由基清除率为响应值,根据Box-Behnken 设计原理进行响应面试验,试验设计方案和结果如表2 所示,方差分析结果见表3。
回归模型方程:DPPH 自由基清除率/%=77.63+2.06A+3.90B+3.11C+2.57AB-0.34AC-0.60BC-11.63A2-3.29B2-1.46C2。由表3 可知,模型 P 值小于 0.000 1,表示该回归模型高度显著;失拟项P 值为0.106 9,显示该模型失拟不显著;模型相关系数R2值为0.988 7,值为0.974 2,初步说明该模型具有较好的拟合度,试验误差较小。回归方程各项的方差分析表明,A、C、AB、B2、C2均达到显著水平,B、A2为极显著水平。根据各因素F 值的大小可知,各因素主效应关系为:B(脱脂乳粉添加量)>C(葡萄糖添加量)>A(发酵时间)。
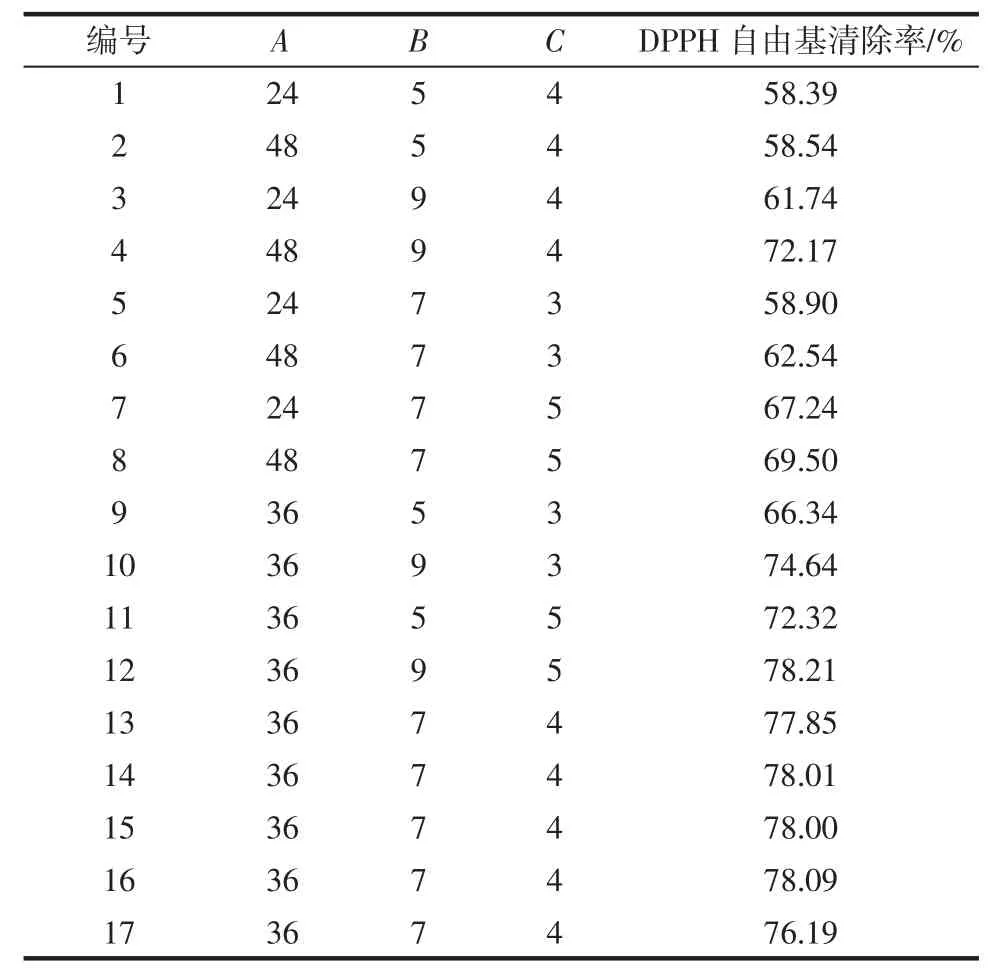
表2 Box-Behnken 响应面分析试验设计及结果Table 2 Experimental design and results of response surface

表3 方差分析结果Table 3 ANOVA for response surface
图6 是发酵时间(A)、脱脂乳粉添加量(B)和葡萄糖添加量(C)两两交互作用对黄浆水发酵液DPPH自由基清除率的三维响应面图,直观反映了各因素间的相互影响[15]。
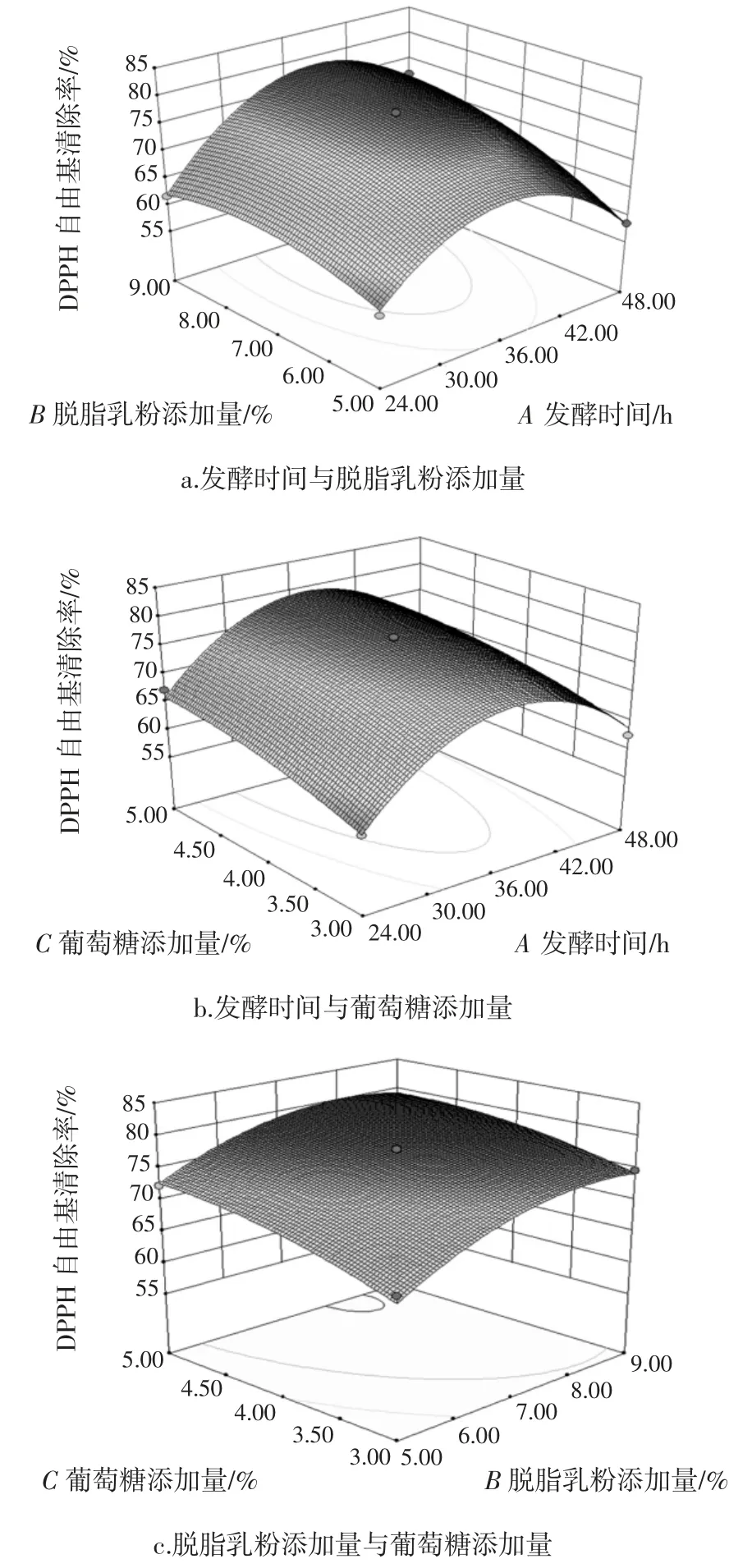
图6 三因素交互作用对DPPH 自由基清除率的影响Fig.6 Surface response plots showing the effect of three factors on the DPPH radical scavenging rate
图6(a)显示发酵时间和脱脂乳粉添加量有显著交互作用,黄浆水发酵液DPPH 自由基清除率随着两者的升高均呈现先增加后减少趋势。发酵时间与葡萄糖添加量的交互作用如图6(b)所示,在一定发酵时间内,黄浆水发酵液的DPPH 自由基清除能力随葡萄糖添加量的升高而升高,碳源的及时补充有利于发酵的正向进行,提高黄浆水发酵液的抗氧化活性。图6(c)为发酵36 h 时的脱脂乳粉与葡萄糖添加量的交互作用响应面图,葡萄糖可作为乳酸菌生长的碳源,其含量较低时,乳酸菌生长受限,而脱脂乳粉中含有蛋白质、小分子肽等乳酸菌生长所需的营养物质,能够促进乳酸菌生长,进而对黄浆水中的活性物质进行生物转化,提高发酵液的抗氧化活性。当葡萄糖添加量较高时,乳酸菌生长所需的碳源较为充足,能够较好地完成发酵,从而削弱了脱脂乳粉对黄浆水发酵液抗氧化活性的影响。
经统计分析优化得到最佳发酵条件为:发酵时间37.65 h,脱脂乳粉添加量8.12 %,葡萄糖添加量4.93 %,此时发酵液DPPH 自由基清除率的理论值达到80.31 %。
2.2.2 最佳发酵条件验证
结合实际可操作性,调整发酵条件为:发酵时间37.5 h,脱脂乳粉添加量8%,葡萄糖添加量5%,得到实际的发酵液DPPH 自由基清除率为(82.36±1.57)%,与预测值接近。由此可见该模型对黄浆水发酵工艺条件参数优化较为可靠,具有一定的实用价值。
2.3 黄浆水发酵液的体外抗氧化活性研究
优化发酵前后黄浆水提取物抗氧化活性见表4。

表4 优化发酵前后黄浆水提取物抗氧化活性的测定Table 4 Antioxidant activity of extracts from optimized fermented and unfermented tofu whey
如表4 所示,通过4 种不同的抗氧化体系来检测优化发酵前后黄浆水抗氧化能力的变化。在最优发酵条件下所制备的黄浆水发酵液清除DPPH 自由基、ABTS 自由基和羟自由基能力均得到显著提升。其中,发酵后黄浆水清除羟自由基的IC50值显著低于阳性对照抗坏血酸(P<0.05)。
研究表明,黄浆水发酵液的抗氧化效应是多种具有抗氧化活性的物质通过不同机制协同作用的结果。乳酸菌发酵提高黄浆水抗氧化活性可能与发酵过程中的蛋白水解、大分子酚类物质降解以及大豆异黄酮的生物转化有关[16-17]。一方面,乳酸菌胞外酶能够将外源大分子蛋白质逐步水解为具有抗氧化活性的多肽[18]。另一方面,发酵过程中复杂的大分子酚类物质被逐渐降解为小分子游离酚类物质,能够与自由基反应形成较为稳定的酚氧自由基,从而降低自由基的氧化损伤[19-20]。此外,研究表明乳酸菌发酵有利于大豆异黄酮抗氧化活性和生物利用度的提高,这是由于乳酸菌产生的β-葡萄糖苷酶将糖苷型异黄酮转化为游离苷元型异黄酮,苷元型异黄酮具有更强的抗氧化活性,且更易被肠道吸收[21-22]。
3 结论
在单因素试验基础上,以DPPH 自由基清除率为响应值,采用响应面法优化黄浆水发酵液制备条件。结果表明最佳发酵参数为:接种量1%、发酵温度37 ℃、发酵时间37.50 h、脱脂乳粉添加量8%、葡萄糖添加量5%。在此条件下制备的黄浆水发酵液DPPH 自由基清除率为82.36%,与预测值接近,说明通过响应面法建立的回归模型方程较为可靠。在最佳发酵条件下制备的黄浆水发酵液清除DPPH 自由基、ABTS 自由基以及羟自由基能力均得到显著提升,为进一步开发黄浆水发酵饮料提供理论基础。
