茯苓-丹参共发酵体系及其产物对糖尿病小鼠降血糖作用的影响
2020-02-29李梦颖杨晔董媛媛闫荣荣尹登科
李梦颖,杨晔,2,董媛媛,闫荣荣,尹登科,2,3,*
(1.安徽中医药大学药学院,安徽合肥230012;2.安徽省中医药科学院药物制剂研究所,安徽合肥230038;3.中药复方安徽省重点实验室,安徽合肥230012)
茯苓为多孔菌科真菌茯苓Poria cocos(Schw.)Wolf的干燥菌核,多寄生在马尾松或赤松的根部。茯苓是常用的药食两用植物,其食用价值和药用价值广泛,茯苓的多重功能也为发酵酒提供了丰富的营养价值[1]。茯苓中要含有多糖、三萜类化合物、甾醇类化合物、蛋白质[2-6]等,黄聪亮等[7]研究发现茯苓多糖能够有效的降低血糖,且能改善Ⅱ型糖尿病小鼠的糖耐量的异常,同时现代药理学研究表明,茯苓多糖具有抗肿瘤作用[8]、抗氧化作用[9]、防结石作用与其利尿作用[10]、免疫作用[11]、养心安神、健胃消食、降脂减肥、美容等药用价值及营养保健作用[12]等。
丹参为唇形科鼠尾草植物丹参Salvia miltiorrhiza Bunge 的干燥根及根茎[13],它是唇形科的最大属之一[14-15]。丹参发酵后制作饮片做丹参茶饮用,酸枣仁丹参茶饮可有效改善失眠患者的睡眠质量[16-17],同时中药保健品中加入丹参可以增强免疫力[18]。党竟兢等[19]研究发现由丹参组成的中药方剂对糖尿病小鼠有明显的治疗效果。
双向发酵又称共发酵,双向发酵是指采用具有一定生物活性的中药材,再将经过活化的菌种加入其中进行发酵[20]。其双向性体现在药性基质不仅满足了真菌的要求,又可被真菌的生长代谢所改变,从而改变自身的成分、产生新的性味功能等[21]。同时双向发酵能够增强药物的性质,提高吸收能力[22-24]。虞泓等[25]研究了茯苓与蛹虫草固体共发酵,共发酵后体系中虫草素、多糖、总多糖含量均明显升高。茯苓多糖和丹参均对糖尿病有一定的治疗作用,作者查阅文献,甚少有茯苓-丹参共发酵的报导,故进行此试验来研究茯苓-丹参共发酵对多糖和总黄酮含量的影响及共发酵体系对糖尿病小鼠降糖作用的影响。
1 材料与方法
1.1 材料
YM100 立式压力蒸汽灭菌锅:上海申安医疗器械厂;HERAcell240 恒温培养箱:美国 Thermo 公司;THZ-82A 气浴恒温震荡器:常州中诚仪器制造有限公司;SCW-CJ-2FD 型洁净工作台:苏州宏瑞净化科技有限公司;SCIENTZ-ⅡD 超声波细胞粉碎机:河北润联科技开发有限公司;UV-1000 紫外分光光度计:翱艺仪器(上海)有限公司;安稳型血糖仪:三诺传感股份有限公司。
茯苓菌:金寨县金山寨食(药)用菌种植专业合作社;丹参:购于安徽省亳州市亳州药市并经中药学教授鉴定合格;链脲佐菌素(streptozocin,STZ):美国 Sigma 公司;葡萄糖、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、磷酸氢二钾、七水硫酸镁、酵母膏、蛋白胨等(均为国产分析纯):北京奥博星生物技术有限责任公司。
实验动物:雄性 ICR 小鼠,SPF 级,体重 18 g~22 g,安徽医科大学。
1.2 方法
1.2.1 培养基
基础培养基[26]:葡萄糖30 g、酵母膏3.9 g、蛋白胨5.1 g、磷酸氢二钾1 g、七水硫酸镁0.5 g,加水至1L,初始 pH 6.7,121.3 ℃灭菌 30 min,冷却备用。
药性培养基:丹参粉末+基础培养基,初始pH 6.7,121.3 ℃灭菌 30 min,冷却备用。
1.2.2 茯苓生长曲线的测定
在超净台上接种茯苓菌块于装有240 mL 液体培养基的500 mL 锥形瓶中,摇床转速为120 r/min,在28 ℃条件下震荡培养,间隔 12 h 取样 4 mL 测定OD600。
1.2.3 各成分含量测定方法
采用硫酸-苯酚法测定总糖含量[27];采用3,5-二硝基水杨酸比色法(DNS 法)测定单糖糖含量[27];采用总糖-单糖=胞外多糖来计算胞外多糖含量;采用硝酸铝比色法测定总黄酮含量[28]。
1.2.4 发酵时间和丹参添加量对生物量和胞外多糖含量的影响试验
取500 mL 干净锥形瓶,分别加入120 mL 基础培养基,分别加入不同质量的丹参粉末形成药性培养基,接种体积分数为6%茯苓菌种子液,接种完毕后于摇床中震荡培养。培养条件:温度26 ℃,转速180 r/min。培养结束后真空抽滤分离得滤液和滤渣。将收集的各组滤渣60 ℃恒温干燥24 h 后称定质量M,减去原先加入的丹参量M0即得生物量(M-M0)。取滤液,加入3 倍量的体积分数为95 %乙醇,4 ℃放置12 h 后于6 000 r/min、4 ℃的条件下离心15 min,得沉淀和上清液,离心后的上清液测定总糖和单糖用来计算胞外多糖含量。同上操作,在基础培养基中加入丹参粉末形成质量浓度为1.0 g/mL 的药性培养基,分别于培养1、2、3、4、5、6、7、8、9、10 d 后计算生物量和胞外多糖含量。
1.2.5 茯苓-丹参共发酵对体系中胞内多糖和胞外多糖及总黄酮含量的影响试验
试验分为茯苓对照组、丹参对照组、茯苓-丹参共发酵组。接种体积分数为6%茯苓菌种子液,培养基中丹参质量浓度为1.0 g/mL。培养5 d 后,真空抽滤,分离得滤液和滤渣。取滤渣加水混匀超声破碎细胞后测胞内多糖含量;取滤液加入3 倍量的体积分数为95%乙醇,4 ℃放置 12 h 后于 6 000 r/min、4 ℃的条件下离心15 min,离心后的上清液测定总糖和单糖用来计算胞外多糖含量,沉淀加水混匀测定总黄酮含量。
1.2.6 糖尿病小鼠降血糖和糖耐量试验方法
1.2.6.1 糖尿病动物模型的建立
采用高糖高脂饲料+小剂量链脲佐菌素(streptozocin,STZ)方式诱导糖尿病动物模型。高糖高脂饲料(蔗糖∶猪油∶奶粉∶鸡蛋∶普通饲料质量比=30 ∶20 ∶4 ∶2 ∶63)饲喂小鼠 1 周。在第 1 周末,小鼠禁食 12 h,按照100 mg/kg 剂量一次性腹腔注射6 mg/mL STZ(pH 4.2,0.1 mol/L 柠檬酸缓冲液冰浴中新鲜配置),之后继续饲喂高糖高脂饲料喂养,小鼠禁食12 h 测空腹血糖,以血糖值大于11.1 mmol/L 为糖尿病模型建模成功。
1.2.6.2 发酵液的浓缩
各组发酵液真空抽滤,分离滤液,各组滤液于旋转蒸发仪45 ℃、40 r/min 条件下浓缩,浓缩前后的体积比为10 ∶1,用于降血糖和糖耐量试验小鼠灌胃。
1.2.6.3 动物分组与给药
建模成功后,选建模成功糖尿病小鼠,将其随机分成4 组,每组8 只,分别是:糖尿病模型对照组;阳性药灌胃组(二甲双胍,0.19 g/kg);茯苓对照组(0.1 mL/20 g);丹参对照组(0.1 mL/20 g);茯苓-丹参共发酵组(0.1 mL/20 g);另外,随机取8 只正常小鼠为正常对照组(等量生理盐水)。各组连续给药10 d。
1.2.6.4 血糖测定
小鼠在灌胃第5 天和第10 天后,分别在禁食12 h后,断尾取血,用血糖仪测定血糖值。小鼠在灌胃10 d后,分别在禁食12 h 后,各组小鼠口服葡萄糖,剂量为2.5 g/kg,断尾取血,用血糖仪分别测定 0、30、60、90、120 min 的血糖值。
1.2.7 统计学分析
通过SPSS 23.0 软件进行处理,组间比较采用单因素方差分析,以P<0.05 表示差异具有统计学意义。
2 结果与分析
2.1 茯苓生长曲线的测定
通过比浊法来测定OD600并绘制茯苓生长曲线,结果见图1。
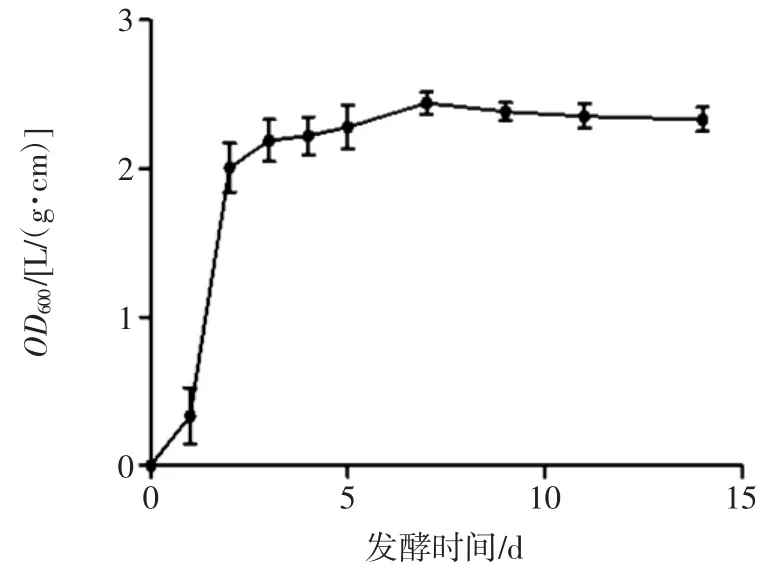
图1 茯苓的生长曲线Fig.1 Growth curve of Poria cocos
由图1 可知,茯苓发酵1 d 后OD600值迅速上升,直到第4 天的OD600达到2.347,表明该菌在此时间段处于对数生长期,生长活力最强。4 d 后曲线趋于一条直线,表明该菌一直处于一种平衡的状态,进入稳定期。因此,种子液应选择茯苓发酵1 d~2 d 内的发酵液,此时菌体生长迅速且活性强,适合接种,确定种子液的最佳培养时间为茯苓-丹参的双向发酵提供依据。
2.2 丹参添加量对共发酵体系胞外多糖含量和茯苓菌生物量的影响
丹参的添加量的变化对共发酵体系中的胞外多糖含量和茯苓菌生物量具有显著的影响,结果见图2。

图2 丹参添加量对胞外多糖和生物量的影响(n=3)Fig.2 Effect of the amount of Salvia miltiorrhiza on extracellular polysaccharides and biomass(n=3)
如图2 所示,随着培养基中丹参添加量的增加,胞外多糖的含量则表现为下降-上升-基本平衡的变化趋势,当培养基中丹参的质量浓度为1.0 g/L 或1.5 g/L时胞外多糖含量最大。但茯苓菌的生物量随着丹参质量浓度的增加而逐渐减小,说明丹参的加入会抑制茯苓菌丝体的生长。因此,为了保证茯苓的生长以及发酵体系具有较多的胞外多糖,选择培养基中丹参质量浓度为1.0 g/L 来进行后期试验。
丹参的添加量对共发酵体系中固体产物形态具有一定的影响,结果见图3。
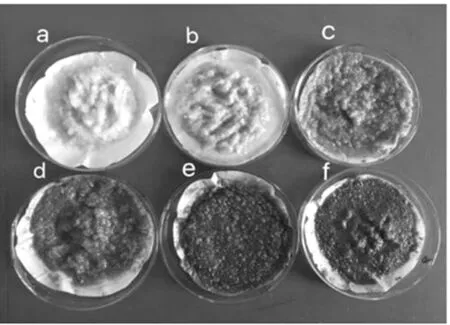
图3 丹参添加量对共发酵体系固体产物的影响Fig.3 Effect of the amount of Salvia miltiorrhiza on Cofermentation system solid product
由图3 可知,丹参的添加量对共发酵体系中固体产物形态具有一定的影响,未添加丹参组的菌丝颜色呈现乳白色,而随着丹参添加量的增加发酵体系固体产物中白色茯苓菌丝逐渐减少,与上述生物量试验结果一致。
2.3 发酵时间对共发酵体系中胞外多糖含量和生物量的影响
为了更好地确定最佳共发酵周期,在以丹参质量浓度1.0 g/mL 培养基中对茯苓-丹参共发酵的时间进行确定,结果见图4。
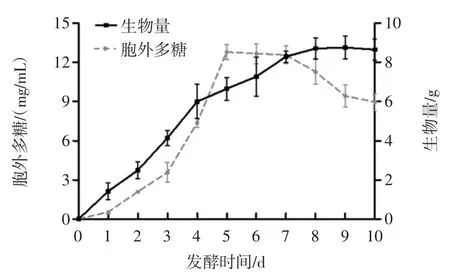
图4 发酵时间对胞外多糖和生物量的影响(n=3)Fig.4 Effect of fermentation time on extracellular polysaccharides and biomass(n=3)
由图4 所示,随着发酵时间的增加,生物量在不断增加,而在第7 天左右生物量的增加变慢并保持一定的水平,说明共发酵体系的菌丝生长进入了稳定期。与生物量的变化不同的是胞外多糖含量先增加再降低,在第5 天时胞外多糖含量达到最大,随后两天保持平稳,但随着发酵时间的继续增加,胞外多糖含量下降。为了保证发酵体系具有较多的胞外多糖,选取最佳共发酵时间为5 d。
2.4 茯苓-丹参共发酵对体系中胞内多糖和胞外多糖及总黄酮含量的影响
茯苓-丹参共发酵体系与单一体系中胞外多糖、胞内多糖和总黄酮的含量变化见表1。
表1 发酵液中胞外多糖、胞内多糖、总黄酮的含量(,n=3)Table 1 Content of extracellular polysaccharide,intracellular polysaccharide and total flavonoids in fermentation broth(,n=3)

表1 发酵液中胞外多糖、胞内多糖、总黄酮的含量(,n=3)Table 1 Content of extracellular polysaccharide,intracellular polysaccharide and total flavonoids in fermentation broth(,n=3)
注:与茯苓组相比,*表示P<0.05 差异显著;与丹参组相比,#表示P<0.05 差异显著。
总黄酮/(mg/mL)茯苓 4.01±0.36 4.16±0.38 0.21±0.06茯苓-丹参 15.74±0.04*# 1.26±0.06* 1.04±0.27#丹参 7.16±0.18 2.31±0.02 3.72±0.11分组 胞外多糖/(mg/mL)胞内多糖/(mg/mL)
崔培梧等[29]将茯苓菌与多种中药共发酵,结果表明茶叶、三七、葛根等表现出极强的胞外多糖合成促进能力;鹿衔草抑制茯苓胞外多糖的合成或分泌。如表1 所示,茯苓-丹参共发酵体系中胞外多糖含量与单一茯苓组、丹参组相比均显著升高(P<0.05),茯苓-丹参共发酵体系中胞内多糖含量与单一茯苓组相比显著降低(P<0.05),说明丹参的加入促进茯苓在生长代谢中向培养基/外界环境中分泌胞外多糖,可能与丹参中含有促进胞外多糖分泌的化学物质有关,但其机制并不明确,有待于进一步研究其作用机制。杨立启等[30]发现植物乳杆菌Lp15 发酵柑橘全果汁过程中总黄酮含量的变化基本是先发生下降而后呈现一定程度上的增加。茯苓-丹参共发酵体系中总黄酮含量与单一丹参组相比显著降低(P<0.05);与单一茯苓组相比显著升高(P<0.05),这可能是茯苓-丹参共发酵体系中茯苓菌的生长抑制了丹参总黄酮的溶出,也有可能是胞外多糖的增加影响了总黄酮的含量,具体原因还需要进一步探讨。将丹参加入到共发酵体系中提高了胞外多糖的含量,并且由于丹参的加入将共发酵体系中引入了总黄酮。
2.5 不同发酵体系对小鼠血糖和糖耐量的影响
不同发酵体系对小鼠血糖和糖耐量的影响不同,结果见图5。
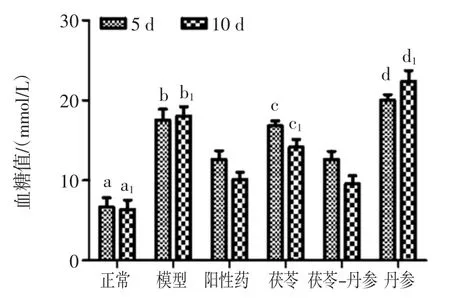
图5 各发酵体系对小鼠血糖值的影响Fig.5 Effect of various fermentation systems on blood glucose levels in mice
由图5 可以看出,灌胃5、10 d 后,茯苓-丹参组与正常组、模型组、茯苓组、丹参组的血糖值相比均有显著性差异(P<0.05),茯苓-丹参组与模型组、茯苓组、丹参组相比显著降低了小鼠血糖值(P<0.05),茯苓-丹参组与阳性药相比血糖值无显著性差异(P>0.05)。这表明共发酵体系能有效降低糖尿病小鼠的血糖,并且其效果接近达到阳性药二甲双胍的降血糖效果。
糖耐量试验(glucose tolerance test,OGTT)是检查机体血糖调节机能的一种方法,口服糖耐量试验在连续灌胃小鼠10 d 后进行,共发酵体系与单一体系对小鼠糖耐量的影响见表2。
如表2 所示,模型组小鼠血糖水平在给予葡萄糖后30 min 达到最大值,尽管30 min 后血糖开始持续下降,但120 min 后仍处于一个较高的水平;与模型组比较,茯苓-丹参组小鼠在90 min 和120 min 的血糖水平明显降低(P<0.05);与茯苓组和丹参组相比,茯苓-丹参组小鼠分别在 90、120 min 和 30、60、90、120 min 的血糖水平明显降低(P<0.05)。这表明共发酵体系的发酵液能提高糖尿病小鼠的葡萄糖耐受力,改善葡萄糖耐量的异常。共发酵体系浓缩发酵液中的主要成分为胞外多糖、胞内多糖、总黄酮、培养基。共发酵体系的浓缩发酵液能降低糖尿病小鼠的血糖、改善葡萄糖耐量的异常,这可能是由于共发酵体系中胞外多糖的含量较多,茯苓多糖能够有效的降低血糖,且能改善Ⅱ型糖尿病小鼠的糖耐量的异常[7]。丹参加入后,共发酵体系与单一茯苓发酵体系相比大大增加了胞外多糖的含量,因此,共发酵体系中的降血糖活性成分可能是茯苓胞外多糖。可考虑将茯苓-丹参共发酵制得的发酵液进一步开发成保健品,投入于市场。
表2 各发酵体系对小鼠糖耐量的影响(,n=6)Table 2 Effect of various fermentation systems on glucose tolerance in mice(,n=6) mmol/L
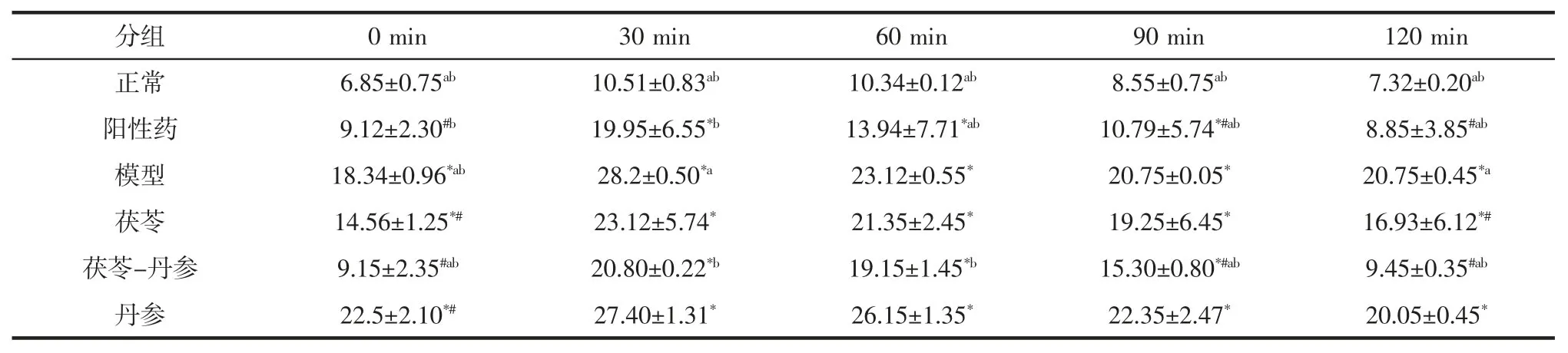
表2 各发酵体系对小鼠糖耐量的影响(,n=6)Table 2 Effect of various fermentation systems on glucose tolerance in mice(,n=6) mmol/L
注:与正常组相比,*表示P<0.05 差异显著;与模型组相比,#表示P<0.05 差异显著;与茯苓组相比,a 表示P<0.05 差异显著;与丹参组相比,b表示P<0.05 差异显著。
分组 0 min 30 min 60 min 90 min 120 min正常 6.85±0.75ab 10.51±0.83ab 10.34±0.12ab 8.55±0.75ab 7.32±0.20ab阳性药 9.12±2.30#b 19.95±6.55*b 13.94±7.71*ab 10.79±5.74*#ab 8.85±3.85#ab模型 18.34±0.96*ab 28.2±0.50*a 23.12±0.55* 20.75±0.05* 20.75±0.45*a茯苓 14.56±1.25*# 23.12±5.74* 21.35±2.45* 19.25±6.45* 16.93±6.12*#茯苓-丹参 9.15±2.35#ab 20.80±0.22*b 19.15±1.45*b 15.30±0.80*#ab 9.45±0.35#ab丹参 22.5±2.10*# 27.40±1.31* 26.15±1.35* 22.35±2.47* 20.05±0.45*
3 结论
本研究采用茯苓真菌作为发酵菌株,丹参作为药性基质,在基础发酵培养基中进行双向发酵试验。结果表明种子液的最佳培养时间为1 d~2 d,培养基中丹参最佳质量浓度为1 g/mL,最佳双向发酵时间为5 d。茯苓-丹参共发酵体系与单一茯苓体系相比发酵液中具有更多的胞外多糖、胞内多糖,并引入了总黄酮,共发酵的发酵液能有效降低糖尿病小鼠的血糖,提高糖尿病小鼠的葡萄糖耐受力。本试验制得的茯苓-丹参共发酵液具有潜在降血糖作用,具有进一步开发的价值,可对茯苓-丹参共发酵的条件进一步优化并考虑投入市场服务于养生保健事业。
