响应面优化紫果西番莲多糖提取工艺及抗氧化活性研究
2020-02-29贺银菊杨再波彭莘媚杨艳张旋俊
贺银菊,杨再波,彭莘媚,杨艳,张旋俊
(1.黔南民族师范学院化学化工学院,贵州都匀558000;2.贵州省高校民族药用植物资源开发工程研究中心,贵州都匀558000)
西番莲又称巴西果、热情果、鸡蛋果,是西番莲科多年木质藤本植物果实的通称,气味芳香浓郁,被称为“果汁之王”[1]。目前西番莲主要有黄果、紫果、紫红色果三个品种,其果实均由果皮和果肉两部分组成,其果肉呈黄色、味酸,含有丰富的矿物质元素、蛋白质、胡萝卜素、A 族B 族维生素、有机酸、维生素C、人体所需要的氨基酸和多糖[2-3]。多糖是一类高分子化合物,具有免疫调节[4]、抗癌[5]、抗肿瘤[6]、抗菌[7]、抗氧化[8]、抗病毒[9]、降血糖[10]等多种药理活性。常用的提取多糖的方法是水提法[11]和碱提法[12],但这两种方法提取率低、损失大,近年来微波法[13]、酶法[14]和超声辅助法[15]等提取方法的应用越来越多,其提取效果优于水提法和碱提法。超声辅助提取是指在声波产生高速、强烈的空化效应和搅拌作用下,破坏植物药材的细胞,使溶剂渗透到研究对象细胞,缩短超声时间,提高提取率,且提取工艺运行成本低,操作简单易行。本文以紫果西番莲为研究对象,以蒸馏水为提取剂,采用单因素试验和响应面优化试验优化紫果西番莲果肉多糖的提取工艺,并采用苯酚-硫酸法测定紫果西番莲果肉多糖提取量,并以清除DPPH 自由基和·OH 能力评价紫果西番莲果肉多糖的抗氧化活性,以期为紫果西番莲的价值提供理论依据。
1 材料与方法
1.1 试验材料
紫果西番莲:2018 年11 月采于贵州省平塘县塘边镇新街村,成熟后采摘,去皮取其果肉备用。葡萄糖标准品:中国食品药品检定研究院;苯酚、硫酸(分析纯):西安化玻试剂有限公司。DPPH、邻二氮菲:上海阿拉丁生化科技股份有限公司;无水乙醇、硫酸亚铁、双氧水、磷酸二氢钾等均为分析纯。
1.2 仪器设备
DZ-2A 型真空干燥箱、SHZ-D 循环水真空泵:郑州英峪予华仪器有限公司;TP-A200 电子天平:上海诺萱科学仪器有限公司;BS1105 电子天平:北赛多利斯天平有限公司;KQ-500DE 型数控超声波清洗器:昆山市超声仪器有限公司;TU-1901 型双光束紫外分光光度计:北京普析通用仪器有限责任公司。
1.3 试验方法
1.3.1 葡萄糖标准曲线的绘制
精确称取烘干至恒重的葡萄糖10.0 mg,加蒸馏水溶解后转入100 mL 容量瓶定容,得0.1 mg/mL 葡萄糖标准液备用。分别取 0.2、0.4、0.6、0.8、1.0 mL 的葡萄糖标准液于5 支具塞试管中,加水补足至1.0 mL 后摇匀,得浓度分别为 20、40、60、80、100 μg/mL 的葡萄糖标准液。在5 支具塞试管中加入1.0 mL 质量浓度为5%的苯酚,再在冰水浴条件下加入5.0 mL 的浓硫酸混匀,沸水浴加热30 min 后冷却至室温,在样品和标准品的最佳吸收波长488 nm 处测定吸光度值。以葡萄糖溶液的浓度为横坐标、吸光度值为纵坐标绘制标准曲线。
1.3.2 样品溶液多糖测定
称取5.00 g 备好的紫果西番莲果肉于250 mL 锥形瓶中,以蒸馏水为提取剂,按照单因素试验条件、响应面分析试验因素和水平进行试验,提取完成后抽滤,滤液转入50 mL 容量瓶后蒸馏水定容到刻度,即得样品溶液。用蒸馏水将样品溶液稀释100 倍后即得待测液,取1 mL 待测液的溶液于具塞试管中,按照1.3.1的方法测定其多糖提取量。

式中:C 为稀释后提取液多糖的浓度,μg/mL;V 为样品溶液的体积,mL;N 为总稀释倍数;m 为称取的紫果西番莲果肉的质量,g。
1.3.3 紫果西番莲果肉多糖提取单因素试验
按照1.3.2 中样品溶液的方法,将试验基本条件定为:液料比4 mL/g,超声时间15 min,超声功率300 W和超声温度 60 ℃,以液料比(2、3、4、5、6 mL/g)、超声时间(5、10、15、20、25 min)、超声功率(200、250、300、350、400 W)和超声温度(40、50、60、70、80 ℃)为单因素试验条件。改变其中一个试验条件分别考察液料比、超声时间、超声功率和超声温度对紫果西番莲果肉多糖提取的影响,按照1.3.2 的方法测定多糖提取量。
1.3.4 紫果西番莲果肉多糖提取响应面优化设计试验
根据单因素试验的结果和Box-Benhnken 的中心组合设计响应面优化试验,具体的试验因素及水平见表1。根据响应面优化设计试验结果进行验证性试验,并计算多糖提取量。

表1 响应面分析试验因素和水平Table 1 Levels and factors of response surface methodology
1.3.5 紫果西番莲果肉多糖抗氧化活性
1.3.5.1 多糖清除DPPH 自由基活性测定
按照文献[16]测定多糖清除DPPH 自由基能力:将DPPH 样品配制成浓度为2×10-4mol/L 的乙醇溶液,避光保存备用;配制不同浓度梯度的多糖样品溶液备用。准确吸取2.0 mL DPPH 乙醇溶液和2.0 mL 不同浓度的样品溶液于10 mL 比色管中,摇匀放置30 min,在517 nm 处测定其吸光度值为A1,按照同样的方法测定2.0 mL 乙醇溶液和2.0 mL 不同浓度的样品液的吸光度A2,2.0 mL 乙醇溶液和2.0 mL DPPH 溶液的吸光度A3。DPPH 自由基清除率计算公式如下:
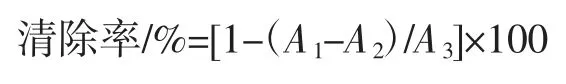
1.3.5.2 多糖清除·OH 活性测定
按照文献[16]测定多糖清除·OH 能力:取1.5 mL 5 mmol/L 的邻二氮菲溶液于10 mL 比色管中,加2.0 mL磷酸盐缓冲液混匀,再加1.0 mL 7.5 mmol/L 的FeSO4溶液混匀,蒸馏水定容至刻度,在37 ℃的水浴保温1 h,在510 nm 处测定吸光度得A0;取1.5 mL 5 mmol/L的邻二氮菲溶液于10 mL 比色管中,加2.0 mL 磷酸盐缓冲液混匀,再加7.5 mmol/L 的FeSO4溶液1.0 mL 混匀,加入1.0 mL 1.0 mL/L 的H2O2,蒸馏水定容至刻度,在37 ℃的水浴保温1 h,在510 nm 处测定吸光度得A1;取1.5 mL 5 mmol/L 的邻二氮菲溶液于10 mL 比色管中,加2.0 mL 磷酸盐缓冲液混匀,再加1.0 mL 7.5 mmol/L 的FeSO4溶液混匀,分别加入0.1 mL 不同浓度的多糖样品溶液,再加1.0 mL 1.0 mL/L 的H2O2,蒸馏水定容至刻度,37 ℃水浴保温1 h,在510 nm 处测定吸光度(此为样品吸光度)得A2。按下式计算·OH清除率:
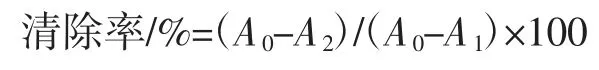
2 结果与分析
2.1 标准曲线的线性关系
根据1.3.1 葡萄糖浓度和吸光度值,用Origin8.0软件绘制标准曲线。结果如图1。

图1 葡萄糖标准曲线Fig.1 Glucose standard curve
由图1 可知,葡萄糖标准品在 20.0 μg/mL ~100.0 μg/mL 范围内吸光度A 与浓度呈良好的线性关系,回归方程为:y=0.011 26x+0.169 32,R2=0.999 4。
2.2 单因素对紫果西番莲果肉多糖提取的影响
2.2.1 液料比对紫果西番莲果肉多糖提取的影响
液料比对果肉多糖提取量的影响见图2。
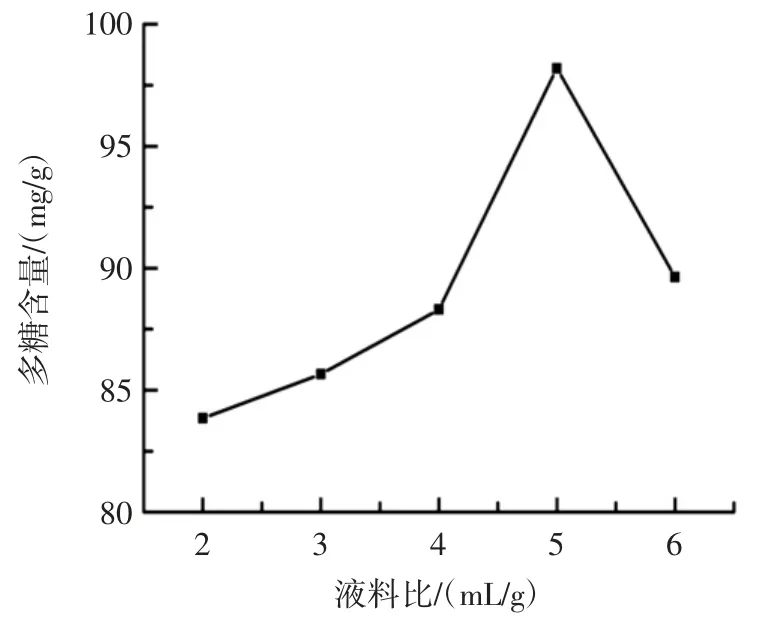
图2 液料比对紫果西番莲果肉多糖提取量的影响Fig.2 Effect of solvent to material ratio on extraction of polysaccharides from the purple passionfruit
由图2 可见,液料比为5 mL/g 时多糖提取量最高;液料比低于5 mL/g 时,随着液料比的增大,多糖提取量升高;液料比高于5 mL/g 时,随着液料比的增大,多糖提取量降低,因此较优液料比为5 mL/g,选择4、5、6 mL/g 作为响应面设计的3 个水平。
2.2.2 超声时间对紫果西番莲果肉多糖提取的影响
超声时间对果肉多糖提取量的影响见图3。

图3 超声时间对紫果西番莲果肉多糖提取量的影响Fig.3 Effect of ultrasonic time on extraction of polysaccharides from the purple passionfruit
由图3 可见,超声时间为20 min 时多糖提取量最高;超声时间少于20 min 时,随着超声时间的增加,多糖提取量升高;超声时间多于20 min 时,随着超声时间的增大,多糖提取量降低,因此较优超声时间为20 min,选择 15、20、25 min 作为响应面设计的 3 个水平。
2.2.3 超声功率对紫果西番莲果肉多糖提取的影响
江苏省作为国家综合医改试点省份之一,“两票制”已从2017年12月31日起正式开始实施[2]。“两票制”对于我省的药品批发企业而言,是一个全新的政策要求,为应对新的措施,企业必然要调整经营策略,改变经营思路。“两票制”的实施会给药品流通行业格局带来怎样的影响?企业在执行过程中会面临怎样的机遇与挑战、产生怎样的困难与问题?本文将通过上述问题的探讨,对药品批发企业执行“两票制”过程中遇到的问题及解决办法进行研析,为企业顺利应对政策变化、长期健康发展提供参考。
超声功率对果肉多糖提取量的影响见图4。

图4 超声功率对紫果西番莲果肉多糖提取量的影响Fig.4 Effect of ultrasonic power on extraction of polysaccharides from the purple passionfruit
由图4 可见,超声功率为300 W 时多糖提取量最高,超声功率低于300 W 时随着超声功率的增加,多糖提取量升高;超声功率高于300 W 时随着超声功率的增大,多糖提取量降低,因此较优超声功率为300 W,选择250、300、350 W 作为响应面设计的3 个水平。
2.2.4 超声温度对紫果西番莲果肉多糖提取的影响
超声温度对果肉多糖提取量的影响见图5。

图5 超声温度对紫果西番莲果肉多糖提取量的影响Fig.5 Effect of ultrasonic temperature rate of polysaccharides from the purple passionfruit
由图5 可见,超声温度为70 ℃时多糖提取量最高;超声温度低于70 ℃时,随着超声温度的增加,多糖提取量升高;超声温度高于70 ℃时,随着超声温度的增大,多糖提取量降低,因此较优超声温度为70 ℃,选择65、70、75 ℃作为响应面设计的3 个水平。
2.3 响应面试验优化
2.3.1 响应面试验设计及结果
根据Box-Benhnken 的中心组合原理设计四因素三水平的29 组试验,优化试验数据见表2。
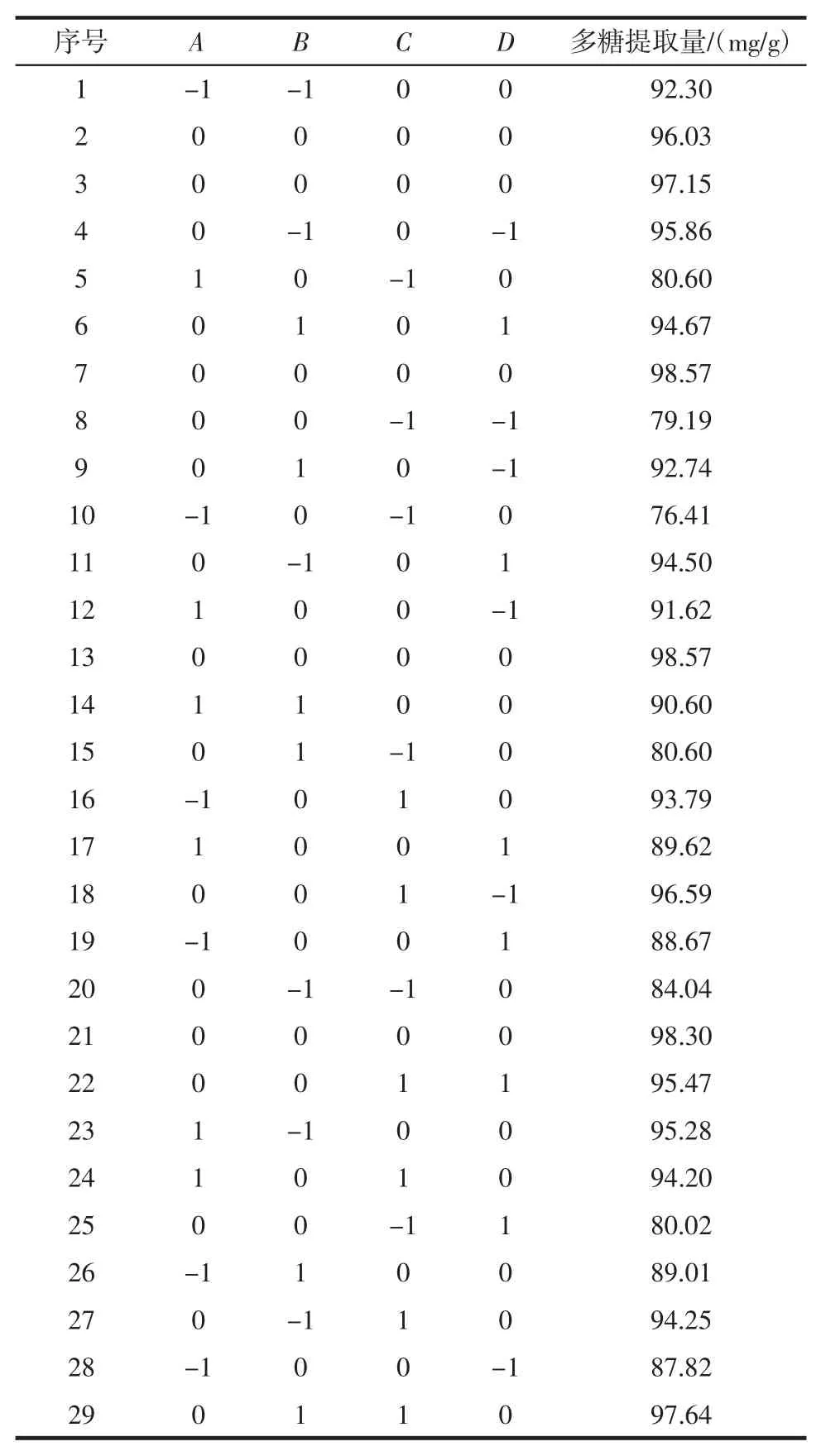
表2 响应面设计试验结果Table 2 Arrangement and results of response surface methodology
用design-expert 8.0.6 进行分析与拟合后,得紫果西番莲多糖提取量(Y)的回归方程:
Y(mg/g)=97.72+1.16A-0.91B+7.59C-0.072D-0.35AB-0.95AC-0.71AD+1.71BC+0.82BD-0.49CD-4.93A2-0.99B2-7.07C2-2.83D2(其中 A、B、C、D 为 4 个因素的编码)。
模型的方差分析见表3。
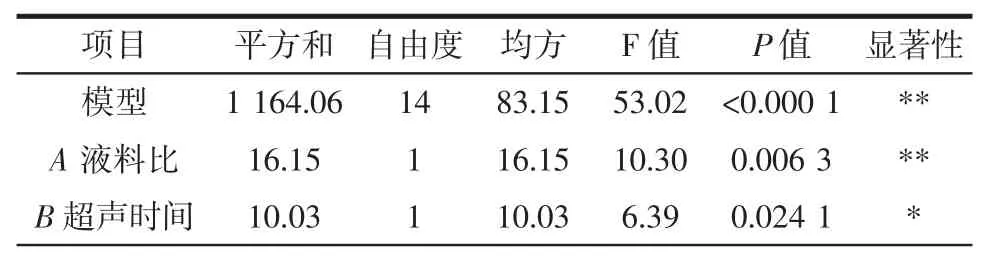
表3 模型的方差分析Table 3 Analysis of variance in model
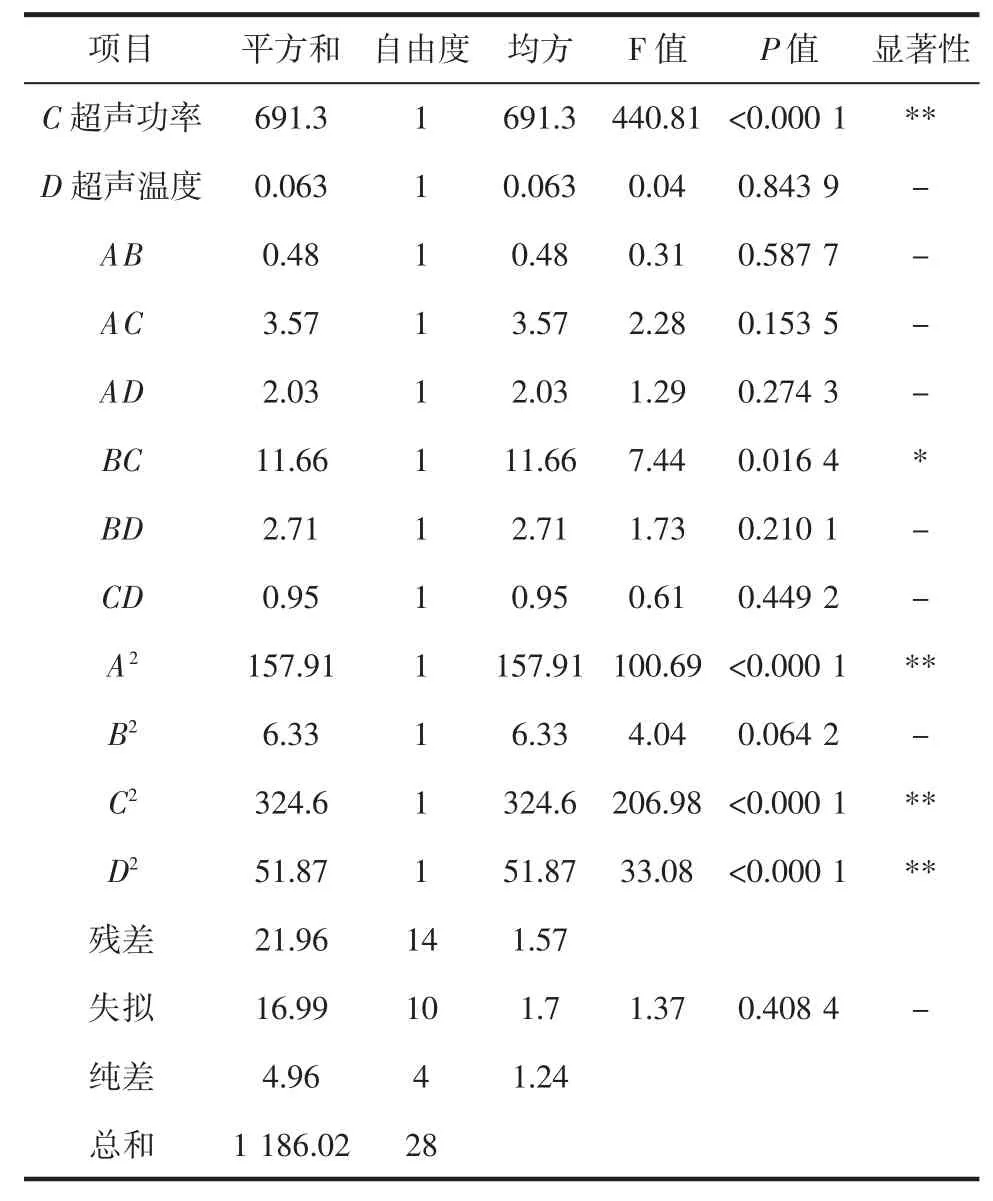
续表3 模型的方差分析Continue table 3 Analysis of variance in model
由表3 可见,模型的 F 值为 53.02,P 值小于 0.000 1,表明试验二次模型可信度高,能正确反映各因素与响应值之间的变化关系。确定系数R2=0.981 5,校正确定系数=0.963 0,变异系数CV=1.37%较小,失拟项大于0.05(0.408 4),说明模型拟合好,稳定、可靠。A、C、A2、C2、D2对多糖提取量影响极显著(P<0.01),B 及交互项BC 对多糖提取量影响显著(P<0.05),因素D、B2及交互项 AB、AC、AD、BD、CD 对多糖提取量没有显著性影响(P>0.05)。由因素 A、B、C、D 的 F 值(或者 P值)大小可以得出各因素对多糖提取量影响顺序为C>A>B>D。
两两因素交互作用响应面见图6。
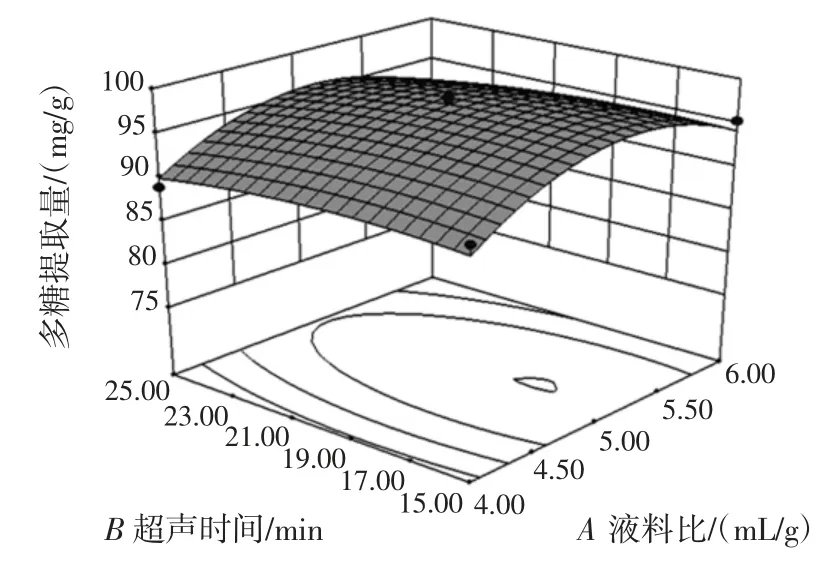
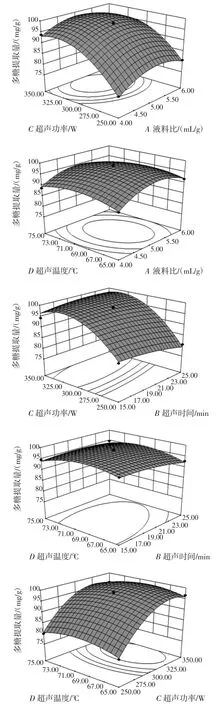
图6 两两因素交互作用的响应面Fig.6 Response surface of the effect interaction between two factors
由图6 可知,各因素相互作用对多糖提取量影响,即响应面对各因素的敏感程度,反映了在两个因素固定的条件下,另外两两因素对多糖提取量影响,响应面坡面越陡峭,则多糖提取量受试验因素影响就越大,反之响应面坡面越平缓,则多糖提取量受试验因素影响就越小。两两因素交互响应面坡面陡峭顺序为BC>AC>BD>AD>CD>AB,即超声时间和超声功率交互作用响应面最陡峭,表明超声时间和超声功率的交互作用对多糖提取量影响最大,而液料比和超声时间交互作用响应面最平缓,表明液料比和超声时间的交互作用对多糖提取量影响最小。
2.3.2 响应面试验优化及验证试验
通过design-expert 8.0.6 软件,根据回归模型预测紫果西番莲果肉多糖最佳提取工艺为:液料比5.07 mL/g、超声时间 19.75 min、超声功率 326.44 W 和超声温度69.63 ℃此时多糖理论提取量为99.7966 mg/g。根据预测条件和实际操作设计多糖提取条件为:液料比5 mL/g、超声时间20 min、超声功率330 W 和超声温度70 ℃,按此工艺进行平行试验,测得紫果西番莲果肉的平均多糖提取量为98.82 mg/g。实测结果和预测结果接近,表明模型拟合良好,参数准确可靠。
2.4 紫果西番莲果肉多糖抗氧化活性
2.4.1 清除DPPH 自由基活性
紫果西番莲果肉多糖对DPPH 自由基的清除活性如图7 所示。
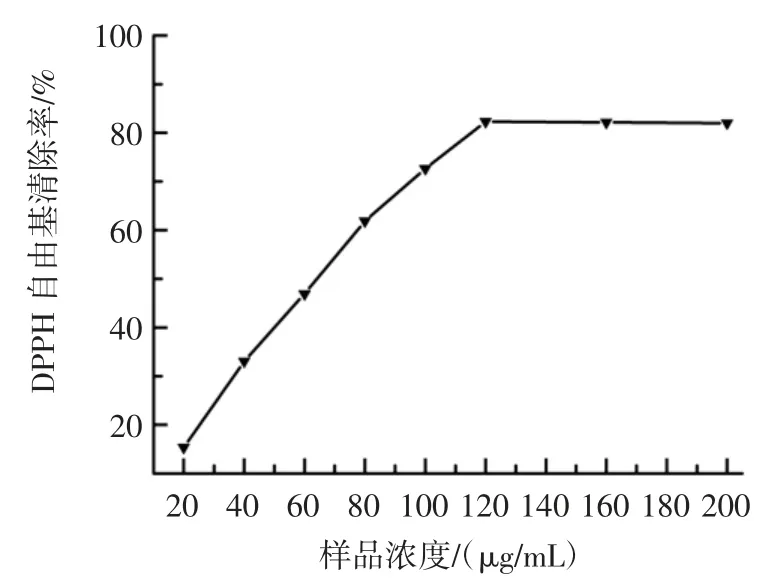
图7 紫果西番莲果肉多糖对DPPH 自由基的清除作用Fig.7 DPPH radical scavenging capacity of polysaccharides from the purple passionfruit
由图7 可知,紫果西番莲果肉多糖对DPPH 自由基具有较强的清除能力。浓度从20 μg/mL 升高到120 μg/mL 时,其多糖清除活性随着浓度的升高而增强,当质量浓度超过120 μg/mL,其多糖对DPPH 自由基的清除率趋于平缓,其清除活性在82%附近波动,经线性拟合,紫果西番莲果肉多糖对DPPH 自由基的IC50值为 66.97 μg/mL。
2.4.2 清除·OH 活性
紫果西番莲果肉多糖对·OH 的清除活性如图8所示。
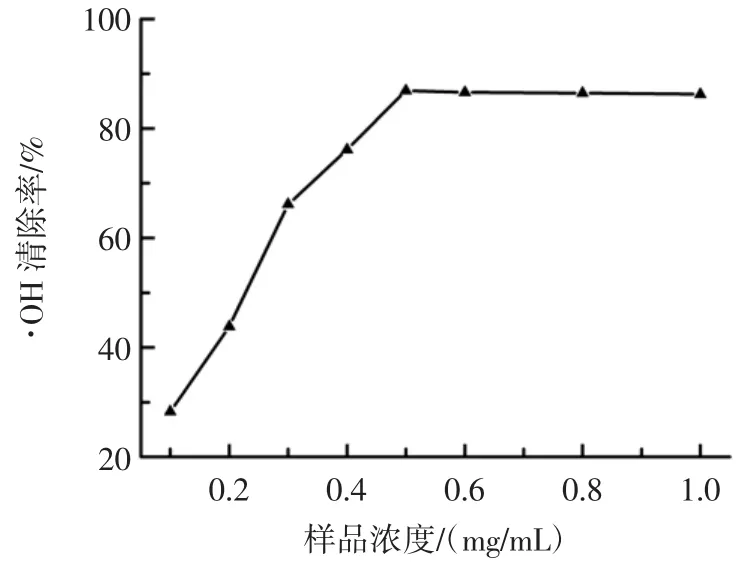
图8 紫果西番莲果肉多糖对·OH 的清除作用Fig.8 Hydroxyl radicals scavenging capacity of polysaccharides from the purple passionfruit
由图8 可知:紫果西番莲果肉多糖对·OH 具有较强的清除能力。浓度从0.1 mg/mL 升高0.5 mg/mL 范围时,其多糖清除活性随着浓度的升高而增强,当质量浓度超过0.5 mg/mL,其多糖对·OH 的清除率趋于平缓,其清除活性在86%附近波动,经线性拟合,紫果西番莲果肉多糖对·OH 的IC50值为0.23 mg/mL。
3 结论
通过最大吸收波长扫描确定多糖的检测波长为488 nm,响应面分析试验结果表明:二次模型是极显著的,准确性较高。4 个因素对多糖提取量影响顺序为C>A>B>D,即超声功率对多糖提取量影响最大,其次是液料比的影响,再次是超声时间的影响,超声温度对多糖提取量的影响最小。根据回归模型进行预测和验证性试验,建立了紫果西番莲果肉中多糖提取的最佳工艺:液料比5 mL/g、超声时间20 min、超声功率330 W 和超声温度70 ℃,紫果西番莲果肉多糖的平均提取量为98.82 mg/g。抗氧化活性表明紫果西番莲果肉多糖对DPPH 自由基和·OH 均有一定的清除能力,其清除DPPH 自由基、·OH 的半抑制浓度(IC50)别为66.97μg/mL 和 0.23 mg/mL。
