黄芪多糖对大黄鱼头肾巨噬细胞的免疫调节作用
2020-02-28孙林浩程安怡黄小红张伟妮
孙林浩,程安怡,黄小红,张伟妮,
(1.福建农林大学中西兽医结合与动物保健福建省高校重点实验室,福建 福州,350002;2.福建农林大学海洋研究院,福建 福州,350002)
大黄鱼(Larimichthyscrocea)俗称黄花鱼,属鲈形目、石首鱼科、黄鱼属(Larimichthys),是我国独特的海水鱼种。目前,大黄鱼养殖年产量十余万吨,产值超百亿元。然而,养殖规模的扩大和养殖环境的恶化造成了大面积疾病的爆发,给大黄鱼养殖业造成了巨大的损失,已成为制约大黄鱼养殖产业发展的主要瓶颈之一[1]。对于大黄鱼养殖病害的防治,目前主要采用抗生素和化学药物。但是抗生素和化学药物的大量使用,造成了鱼体药物残留、病原菌耐药性增加及环境污染等严重问题。因此,寻找能有效防治水产动物疾病、替代或减少抗生素使用的免疫增强剂显得非常必要。
黄芪为豆科植物蒙古黄芪或膜荚黄芪的干燥根,具有补气固表、利水退肿、脱毒排脓、生肌等功效[2]。黄芪中含有多种活性成分,包括黄芪黄酮类、黄芪皂苷、黄芪多糖(Astragaluspolysaccharide, APS)等。其中,黄芪多糖为黄芪中最主要的活性成分之一,在提高机体免疫力、抗肿瘤、降血糖等方面具有显著效果[3],现在多应用于中医临床和动物疾病的预防[4]。同时,APS在提高和改善水生动物免疫功能方面的作用也受到普遍关注。许明等(2008)发现在草鱼饲料中添加适量的APS、维生素K3粉和维生素C,可提高草鱼对病毒的抵抗力,达到治疗草鱼出血病的效果[5]。在饲料中添加1 200 mg/kg的APS可以显著促进黄颡鱼(Pelteobagrusfulvidraco)各组织中的溶菌酶活力和吞噬细胞的吞噬能力,提高鱼体对迟钝爱德华氏菌(Edwardsiellatarda)的免疫保护力[6],并显著促进外周血白细胞的增殖[7]。
头肾是硬骨鱼类的主要免疫器官,也是主要造血器官,是免疫细胞的发生场所,在功能上类似于高等脊椎动物的脊髓[8-9]。头肾中的巨噬细胞在识别与吞噬外来病原微生物、处理和呈递抗原、激活淋巴细胞启动特异性免疫应答等方面发挥了关键作用,其活性与功能是反映和评价鱼类免疫水平的重要指标[10-11]。本研究以大黄鱼头肾巨噬细胞为研究对象,初步研究APS对大黄鱼巨噬细胞呼吸爆发、吞噬活性及免疫相关细胞因子转录水平的影响,明确APS对大黄鱼头肾巨噬细胞的激活作用,有利于进一步研究APS对大黄鱼头肾巨噬细胞的调控机制。
1 材料与方法
1.1 材料
1.1.1 试验鱼 大黄鱼来自宁德海水养殖基地,体长(25±5)cm,体重(400±100)g。
1.1.2 主要试剂 黄芪切片购自北京同仁堂健康药业有限公司;GIBCO Leibovitz′s L-15 无酚红培养基、GIBCO胰酶、FITC-荧光微球购自Thermo公司;Percoll购于GE公司;丙二醇甲醚醋酸酯(PMA)、脂多糖(LPS)购于sigma公司;活性氧(ROS)检测试剂盒、DAF-FM DA(NO荧光探针)购自碧云天公司;红细胞裂解液、反转录试剂盒购于天根公司;细胞总RNA提取试剂盒、Go Taq® qPCR Master Mix 购于Promega公司。
1.2 试验方法
1.2.1 黄芪多糖提取 采取水提醇沉法[12]从黄芪切片中制得粗糖。采用酶-Sevag法进一步去除蛋白。最后经AB-8大孔树脂柱(柱体积为200 cm3)纯化,将洗脱液浓缩后冷冻干燥,得到纯化的APS。用苯酚-浓硫酸法测定多糖含量为78%。
1.2.2 大黄鱼头肾巨噬细胞的分离 大黄鱼头肾巨噬细胞的分离采取Percoll密度梯度离心技术,选取健康大黄鱼,MS-222麻醉大黄鱼至不动,随后将其放置于解剖盘中,用75%的酒精擦拭鱼体,杀死鱼体表细菌。抽尽鱼血,用剪刀和镊子取出大黄鱼头肾。在超净台内研磨,研磨液过70 μm滤网,后将滤过液加入到事先配制好的体积分数分别为34%与51%的Percoll分离液液面之上。4 ℃、2 248 r/min离心30 min,得液面交界处细胞。加入红细胞裂解液去除红细胞,并用细胞计数仪计数。用细胞培养基稀释后按每孔2 cm3加至6孔板中。每孔细胞浓度为2×106cells/cm3。贴壁2 h后,用pH为7.4的磷酸盐缓冲液(PBS)洗去悬浮与半贴壁的细胞,用无酚红的L-15培养基培养备用。
1.2.3 氧呼吸爆发(ROS)的检测 备用的细胞分别用含0、50、100、200、400、800 μg/cm3APS的细胞培养基培养,每个浓度设置3个重复,将细胞置于28 ℃培养24 h,随后每孔加入0.1 μg/cm3PMA,刺激1 h后弃去培养基,加入10 μmol/dm3的DCFH-DA(用无血清培养液按体积比为1∶1 000稀释)。28 ℃细胞培养箱内孵育20 min,弃去培养液,用PBS清洗细胞3次,每孔加入胰酶700 mm3消化细胞5 min,弃去胰酶,用细胞刮刮下细胞,PBS清洗后用100 mm3PBS重悬,避光置于冰上,用流式细胞仪进行检测。
1.2.4 氮呼吸爆发(NO)的检测 备用的细胞分别用含0、50、100、200、400、800 μg/cm3APS的细胞培养基培养,每个浓度设置3个重复,将细胞置于28 ℃培养24 h。处理结束后弃去培养液,加入5 μmol/dm3的DAF-FM DA(用DAF-FM DA稀释液按体积比为1∶1 000稀释)。28 ℃细胞培养箱内培养20 min。弃去培养液,用PBS清洗细胞3次,每孔加入700 mm3胰酶消化细胞5 min,弃去胰酶,用细胞刮刮下细胞,PBS清洗后用100 mm3PBS重悬,避光置于冰上,用流式细胞仪进行检测。
1.2.5 APS对LPS刺激大黄鱼头肾巨噬细胞吞噬活性检测 备用的细胞分别用含0、50、100、200、400、800 μg/cm3APS的细胞培养基培养,每个浓度设置3个重复,将细胞置于28 ℃培养24 h,处理结束后弃去培养基,加入 LPS浓度为20 μg/cm3的培养基,培养3 h后,在每个孔内加入1 mm3FITC-荧光微球,28 ℃培养箱避光培养1 h。用PBS清洗细胞3次,每孔加入胰酶700 mm3消化细胞5 min,弃去胰酶,用细胞刮刮下细胞,PBS清洗后用100 mm3PBS重悬,避光置于冰上,用流式细胞仪进行检测。
1.2.6 RT-PCR检测TNF-α、IL-1β和IL-6mRNA的表达 将大黄鱼头肾巨噬细胞用200 μg/cm3的APS处理,同时设立空白对照。于处理后6、12、24 h时按照细胞总RNA提取试剂盒操作说明收集细胞RNA。用天根反转录试剂盒反转成cDNA。实时荧光定量PCR反应按Promega公司生产的Go Taq® qPCR Master Mix 进行。使用实时荧光定量PCR得到各样品的Ct值后,以β-actin为内参,对样品Ct值作均一化处理,通过2-△△Ct计算各个样品mRNA相对含量。TNF-α上游引物:5′-GGACGATTCTTCGTTTACAG-3′,下游引物:5′-GTTTGTCACCTCTGTTCAGG-3′;IL-1β上游引物:5′-CAGCTGTTCTCAAGTATGTGGC-3′,下游引物:5′-GTTGTAAATAGTGGGTGTGTCG-3′;IL-6上游引物:5′-GCTGTTCTCAAGTATGTGGCG-3′,下游引物:5′-TGTTGTAAATAGTGGGTGTGTCG-3′;β-actin上游引物:5′-GACCTGACAGACTACCTCATG-3′,下游引物:5′-AGTTGAAGGTGGTCTCGTGGA-3′,3条鱼重复。
1.3 数据分析
采用SPSS软件对数据进行单因子方差分析,用LSD判定组间的差异性,用FlowJo软件对流式细胞仪测得数据进行处理。
2 结果与讨论
2.1 APS对大黄鱼头肾巨噬细胞氧呼吸爆发影响
如图1a所示,随着APS浓度的增加,DCFH-DA的荧光强度明显下降,且呈剂量依赖性。通过对其平均荧光值进行差异性分析,结果如图1b所示,50、100、200、400、800 μg/cm3APS均可极显著地抑制活性氧的产生(p<0.01)。
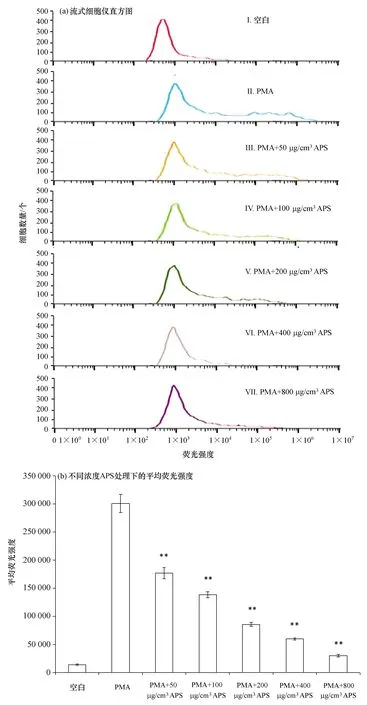
图1 不同浓度APS对大黄鱼头肾巨噬细胞氧呼吸爆发的影响
2.2 氮呼吸爆发的检测
用流式细胞仪检测APS对大黄鱼头肾巨噬细胞氮呼吸爆发的影响,结果如图2a所示,与Ⅰ峰相比(空白),各峰逐渐向其左方偏移,且偏移程度随APS浓度增大而增大。通过对其平均荧光值进行差异性分析,结果如图2b所示,不同浓度APS作用大黄鱼头肾巨噬细胞24 h后,100 μg/cm3APS能够显著地抑制细胞NO的产生(p<0.05),200、400、800 μg/cm3的APS能够极显著地抑制细胞NO的产生(p<0.01),且呈剂量依赖性。50 μg/cm3APS与空白组相比无显著性差异。
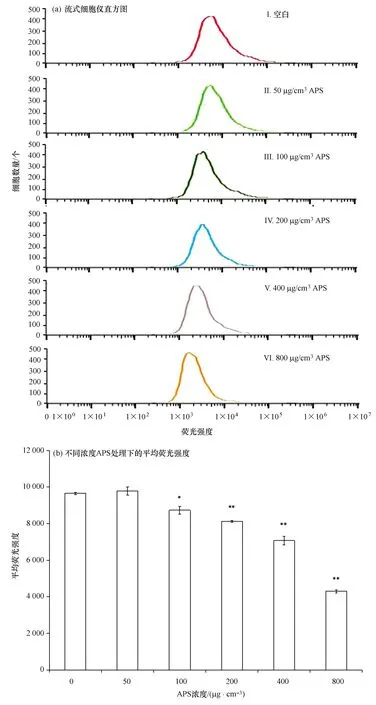
图2 不同浓度APS对大黄鱼头肾巨噬细胞氮呼吸爆发的影响
2.3 APS对经LPS刺激大黄鱼头肾巨噬细胞吞噬活性的影响
头肾巨噬细胞具有吞噬荧光微球的能力,如图3a所示,峰越往右表示其吞噬微球数目增多。用50、100、200 μg/cm3APS 预处理24 h后发现,与Ⅱ峰(LPS刺激)相比,荧光强度明显升高,则说明细胞吞噬荧光微球数量增多,400、800 μg/cm3APS处理组与Ⅱ峰相比差异不明显。通过对其平均荧光值进行差异性分析,结果如图3b所示,50、100 μg/cm3的APS预处理24 h后可以极显著地增强大黄鱼头肾巨噬细胞经过LPS刺激后的吞噬能力(p<0.01),200 μg/cm3APS可以显著增强细胞经LPS刺激后的吞噬能力(p<0.05),400、800 μg/cm3APS刺激后与单纯 LPS刺激组相比无显著性差异。
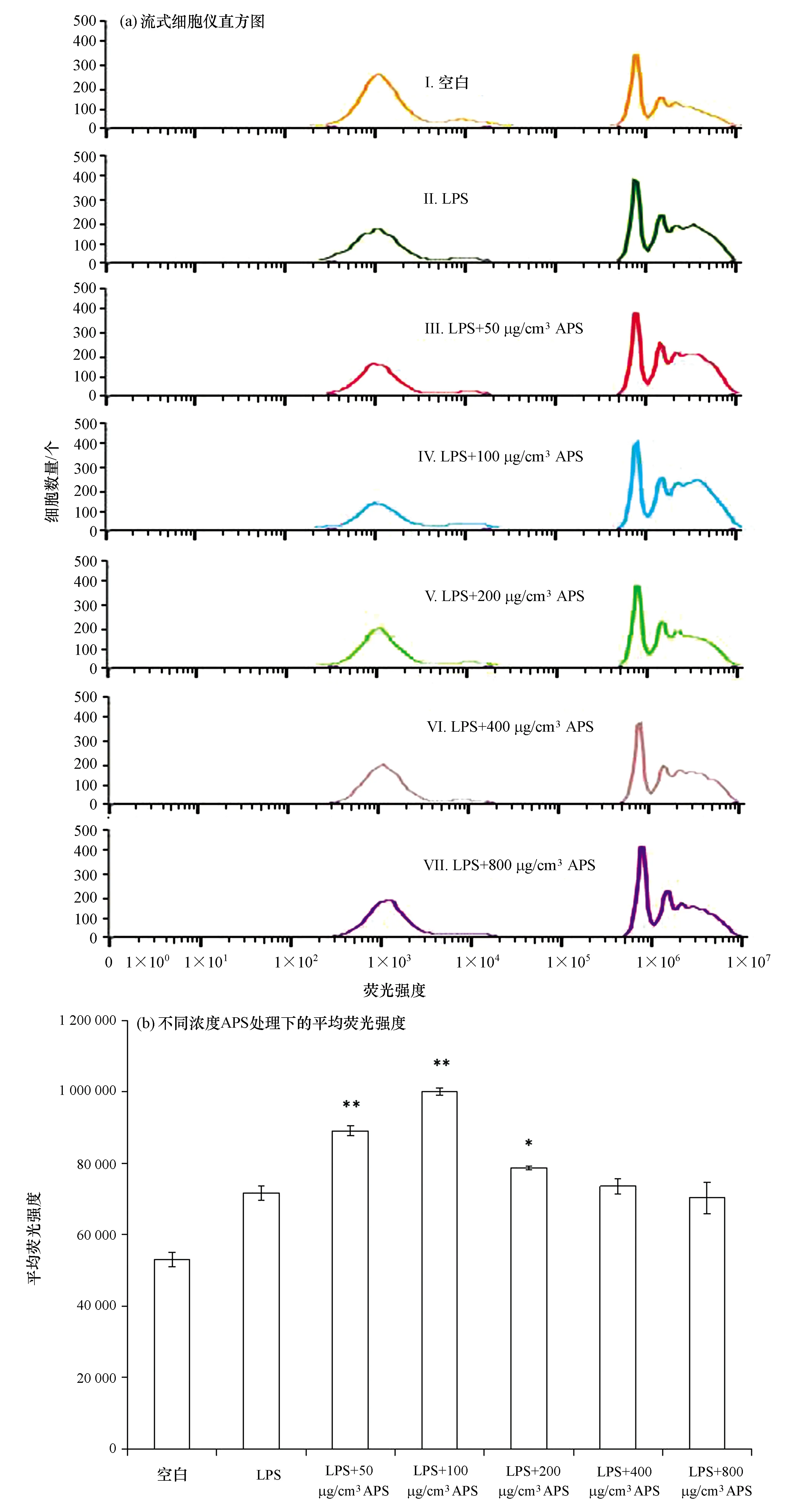
图3 不同浓度APS对经LPS刺激大黄鱼头肾巨噬细胞吞噬活性的影响
2.4 RT-PCR检测TNF-α、IL-1β和IL-6 mRNA的表达
APS对大黄鱼头肾巨噬细胞TNF-α、IL-1β和IL-6mRNA转录水平影响如图4所示,在采用200 μg/cm3的APS刺激大黄鱼头肾巨噬细胞后,3种细胞因子的转录水平在6、12、24 h均极显著上升(p<0.01),TNF-α、IL-1β和IL-6mRNA转录水平在6 h升高最明显,随着刺激时间增长,升高趋势逐渐降低。
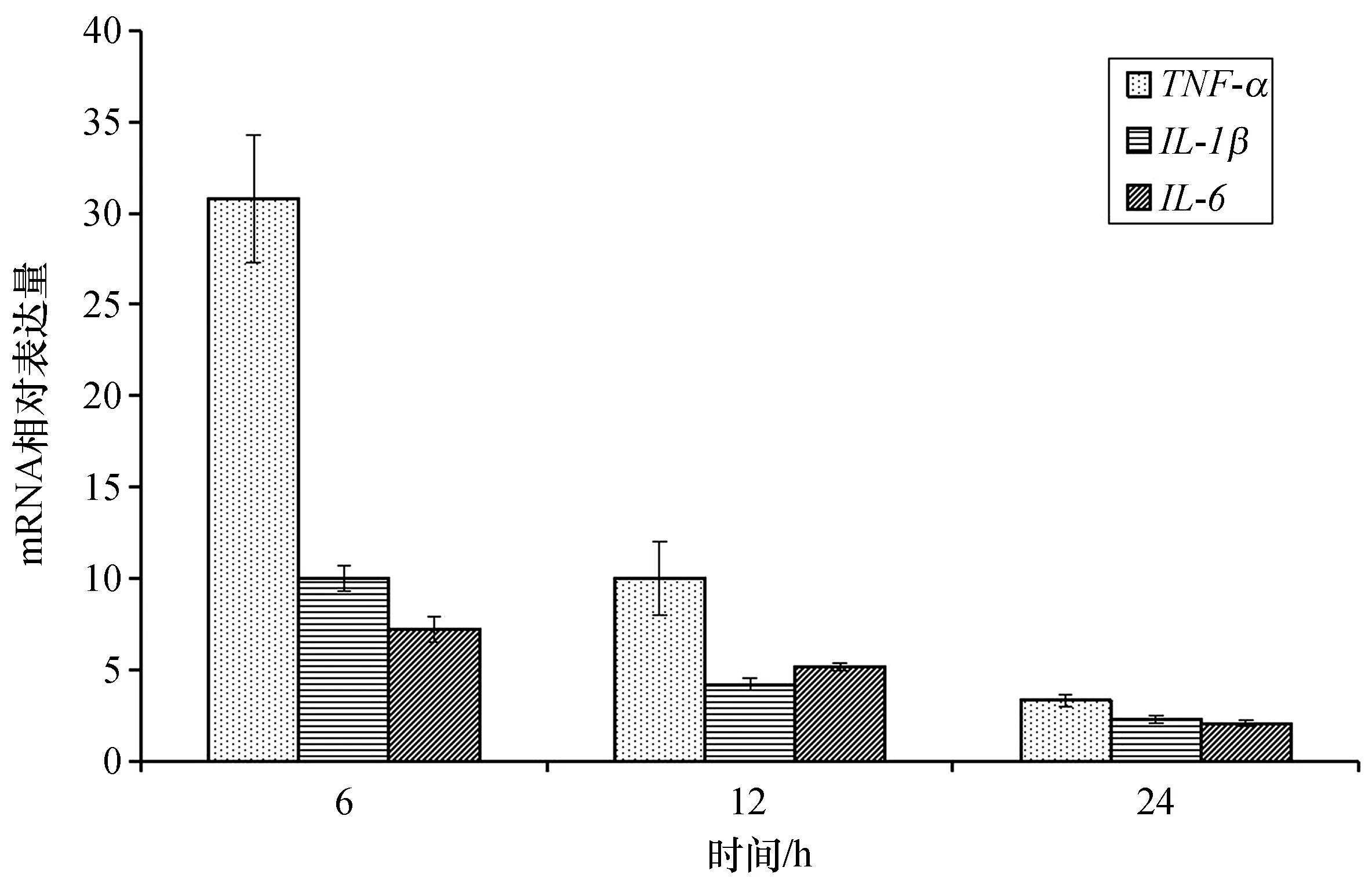
图4 APS对大黄鱼头肾巨噬细胞免疫相关基因表达水平影响
2.5 讨论
头肾是大黄鱼免疫细胞的主要发源地之一,这些免疫细胞包括单核/巨噬细胞、颗粒细胞和B淋巴细胞等,其中头肾巨噬细胞在鱼类抵御微生物感染的各个阶段发挥重要作用[13]。多糖是一种重要的生物大分子,在机体内参与各种生命现象的调节和能量的储存与传递[14-16]。研究表明,植物多糖可以通过激活免疫细胞、活化补体、促进细胞因子生成等方面对免疫系统进行调节[17]。
氧是细胞发挥作用所必不可少的成分,但氧过量时会发生单价还原而产生活性氧类。活性氧是指机体在进行生命活动中产生的一些代谢产物,大部分细胞中90%以上的氧在线粒体中被消耗,其中约2%的氧在线粒体内膜和基质中被转变成为活性氧。活性氧主要包括:超氧阴离子、单线态氧、次氯酸、羟自由基、过亚硝酸盐、过氧化氢等。活化的巨噬细胞会产生呼吸爆发,消耗大量的氧同时产生过量的活性氧自由基。过量的活性氧会损害细胞正常的双层膜结构,对细胞器的结构和功能造成破坏,继而损伤脂质、蛋白质等生物大分子,最终导致自身凋亡[18]。李明春等(2000)发现灵芝多糖GLB7可以减少小鼠腹腔巨噬细胞内活性氧自由基的生成,清除活性氧,从而达到免疫增强与抗衰老的目的[19]。张庆等(2000)也发现大枣中性多糖具有抗活性氧作用,减少其对细胞所产生的损伤作用[20]。本研究通过用APS对大黄鱼头肾巨噬细胞处理24 h后发现,不同浓度APS均可以显著抑制头肾巨噬细胞经PMA诱导后的氧呼吸爆发活性。
本研究结果表明,APS还可以抑制头肾巨噬细胞的氮呼吸爆发活性,抑制效果随浓度增加而增加。NO是巨噬细胞产生的效应分子之一,它是由一氧化氮合酶(NOS)催化左旋精氨酸(L-Arg)产生。适量的NO可以增强巨噬细胞的免疫功能,但是过量的NO会产生细胞毒性作用,损伤细胞、导致基因突变。欧德渊等(2007)研究显示APS可以使仔猪腹腔巨噬细胞中NO的含量显著降低[21],与本研究结果一致。
巨噬细胞的吞噬功能是其最主要的细胞功能,是其识别并消灭病原体、清除衰亡细胞、维持机体内环境稳态的重要手段。本研究结果显示,50、100、200 μg/cm3APS可以显著增强LPS刺激的大黄鱼头肾巨噬细胞吞噬活性,说明APS预处理可以通过提高大黄鱼头肾巨噬的吞噬活性来提高机体对病原菌的免疫力。
已有研究表明,APS可以增强猪外周血树突状细胞IL-1β和TNF-α的表达量,并显著增强IL-6的表达量[22]。曹丽萍等(2008)在对鲤鱼头肾巨噬细胞的研究中也发现,APS能显著增强IL-1β的表达量[23]。TNF-α、IL-1β、IL-6是巨噬细胞分泌重要的细胞因子,是其发挥免疫功能必不可少的活性物质[24]。在本研究中,200 μg/cm3的APS能够显著增强大黄鱼头肾巨噬细胞TNF-α、IL-1β和IL-6基因的表达,说明APS可以通过增强细胞因子的表达对巨噬细胞发挥免疫调节作用。
3 结论
本研究表明APS可以抑制大黄鱼头肾巨噬细胞的呼吸爆发活性,增强经LPS刺激的巨噬细胞的吞噬活性,提高巨噬细胞TNF-α、IL-1β、IL-6基因的表达量,从而对大黄鱼头肾巨噬细胞发挥免疫调节作用。
