黄芪多糖对CPZ诱导的急性脱髓鞘模型的保护作用
2020-02-28邢雁霞李自青刘斌焰赵一锦章培军刘斌钰马存根
邢雁霞 李自青 刘斌焰 赵一锦 章培军 刘斌钰 马存根
(1大同大学医学院脑科学研究所,山西 大同 037009;2山西中医药大学“2011”协同创新中心)
少突胶质细胞是中枢神经系统(CNS)中一群高度分化的神经胶质细胞,其主要功能是在轴突周围形成紧密的多层髓鞘,维持神经元轴突的存活和正常功能。少突胶质细胞分化不良或受损后影响髓鞘的正常功能,导致CNS脱髓鞘疾病,如多发性硬化(MS)〔1〕。双环己酮草酰二腙(CPZ)是一种铜离子螯合剂,小剂量CPZ能特异性诱导少突胶质细胞死亡,引发CNS脱髓鞘,但对神经元的影响较小〔2〕。中医学认为脱髓鞘疾病属于“痿症”的范畴,治疗以补气为主。黄芪具有益气扶正,养阴生津,补气升阳,益卫固表等作用,其主要化学成分为黄芪多糖(APS)。课题组前期研究发现黄芪多糖具有提高机体免疫功能、增强耐力、延缓衰老等作用〔3~6〕,黄芪糖蛋白能通过抗炎和免疫调节机制减轻实验性自身免疫性脑脊髓膜炎(EAE)小鼠髓鞘的脱失,促进神经修复〔7,8〕。目前对于APS不涉及免疫调节的机制下治疗脱髓鞘疾病,国内未见有报道。本实验主要观察APS对CPZ诱导的急性脱髓鞘小鼠的神经保护作用,探讨其治疗髓鞘脱失疾病的可能性。
1 材料和方法
1.1材料
1.1.1动物 8周龄雌性C57BL/6小鼠购自北京维通利华实验动物技术有限公司,体重18~22 g,健康清洁级,饲养于大同大学脑科学研究所实验动物中心,实验前小鼠在无病原菌动物房自由饮食喂养1 w。
1.1.2试剂 APS(S31346)和CPZ(S30349)均购自北京博扬宏达科技有限公司;大鼠抗小鼠MBP单克隆抗体(monoclonal antibody,mAb)(550280)购自英国AbD Serotec公司;Alexa Fluor 488 荧光标记的二抗(#4416S)购自美国Cell Signaling公司。
1.1.3仪器 日本Olympus 荧光显微镜(BX51);德国Leica冰冻切片机(CM1950);北京赛多利斯天平有限公司电子天平(BS210S)。
1.2方法
1.2.1模型制备与给药 通过含0.2%CPZ的混合饲料连续喂食小鼠来诱导建立脱髓鞘模型〔9〕。54只小鼠随机分为三组:正常组,CPZ组,APS组,每组18只,每组根据观察时间(4、5和6 w)分为三个亚组,每个亚组6只。正常组小鼠采用普通饲料饲养,CPZ组和APS组小鼠食用含有0.2% CPZ的特殊饲料,持续喂养6 w。从第2周开始,APS组按500 mg/(kg·d)腹腔注射APS,CPZ组给予等量生理盐水,持续给药至实验结束。
1.2.2标本制备 实验第4、5和6周末,各组取6只小鼠采用0.3 g/L戊巴比妥钠按0.2 ml/只 腹腔注射麻醉后,采用40 g/L多聚甲醛灌注进行组织固定,小心剥取脑组织,取4只用最佳切削温度化合物(OCT)包埋后制成7 μm冷冻切片,用于髓鞘固蓝(LFB)染色和免疫荧光组化染色;剩余2只常规做石蜡包埋并切片,用于苏木精-伊红(HE)染色。
1.2.3髓鞘染色 采用LFB染色法显示髓鞘,配制LFB染液〔8〕,将脑组织切片在95%乙醇溶液中浸泡15 min后,转入LFB染液37℃过夜,95%乙醇和双蒸水漂洗,0.05%碳酸锂溶液分化,70%乙醇分色,蒸馏水终止分色,梯度乙醇脱水、二甲苯透明、中性树胶封片。镜下观察,用 Image-Pro Plus6.0 软件计算脑组织染色平均光密度值。
1.2.4免疫荧光组织化学染色 取脑组织冰冻切片置室温下晾干,先用0.01 mol/L磷酸盐缓冲液(PBS)洗3次,5 min/次;用1%胎牛血清白蛋白(BSA)以1∶1 000的比例稀释髓鞘碱性蛋白(MBP)一抗抗体,4℃冰箱中孵育过夜;次日再用PBS洗3次,5 min/次,滤纸吸干,加入Alexa Fluor 488荧光标记的二抗(1∶1 000)室温孵育2 h;PBS洗3次,5 min/次。再加入染核液(1∶1 000)室温孵育5 min,PBS洗3次,5 min/次,甘油封片,荧光显微镜观察每个切面脑组织MBP阳性细胞荧光强度,用Image-Pro Plus 6.0 软件统计。
1.2.5HE染色 常规做小鼠脑组织石蜡包埋并切片,每张切片厚度为5 μm,HE染色,中性树胶封片,光镜下观察脑组织形态学变化,并用Image-Pro Plus 6.0 软件分析每个切面脑组织小胶质细胞的数量。
1.2.6小鼠体重、进食量和全脑重量检测 实验开始为每只小鼠放入相应饲料10 g,以后每天固定时间记录放入笼中的新鲜饲料重量和剩余饲料重量;实验期间每隔1 d给小鼠称重并记录,在喂养4、5和6 w末将小鼠麻醉取脑,置于称量杯中用电子天平称出脑湿重,根据脑组织重量计算脏器系数(脏器系数=脏器重量/体重×100%)。
1.3统计学分析 采用SPSS19.5软件进行方差分析。
2 结 果
2.1APS对CPZ小鼠体重的影响 采用CPZ造模前三组小鼠体重无显著差异(F=1.05,P=0.364)。造模第1周末CPZ组与APS组小鼠体重均减轻,与正常组小鼠体重比较有显著差异(F=3.46,P=0.046);但两组间比较无明显差异(P>0.05);第2~6周正常组小鼠体重呈逐渐增加的趋势,且明显高于APS组、CPZ组(P<0.05,P<0.001);CPZ组小鼠体重低于APS组(P<0.05,P<0.01,P<0.001)。见表1。
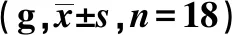
表1 三组造模前及造模后不同时间体重比较
与正常组比较:1)P<0.05,2)P<0.001;与APS组比较:3)P<0.05,4)P<0.01,5)P<0.001
2.2APS对CPZ小鼠进食量的影响 造模前三组小鼠的进食量无显著差异(F=2.593,P=0.093)。造模第2~6周,与正常组相比,CPZ组和APS组小鼠进食量均明显降低(F=71.71、89.33、82.85、69.41、80.12,均P<0.001),且CPZ 组小鼠进食量明显低于APS组小鼠(P<0.001)。见表2。
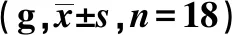
表2 三组造模前及造模后不同时间进食量比较
与正常组比较:1)P<0.001,与APS组比较:2)P<0.001,下表同
2.3APS减轻CPZ小鼠髓鞘的脱失 用LFB染色法观察5 w末小鼠脑组织髓鞘变化:正常组小鼠脑组织LFB染色后呈深蓝色,致密均匀,OD值为(0.29±0.024),显著高于CPZ组和APS组(0.16±0.018,0.23±0.019,P<0.001)。CPZ组染色明显变浅,呈现淡蓝色块状,APS有效改善了髓鞘脱失,APS组与CPZ组比较差别有统计学意义(P<0.001)。见图1。
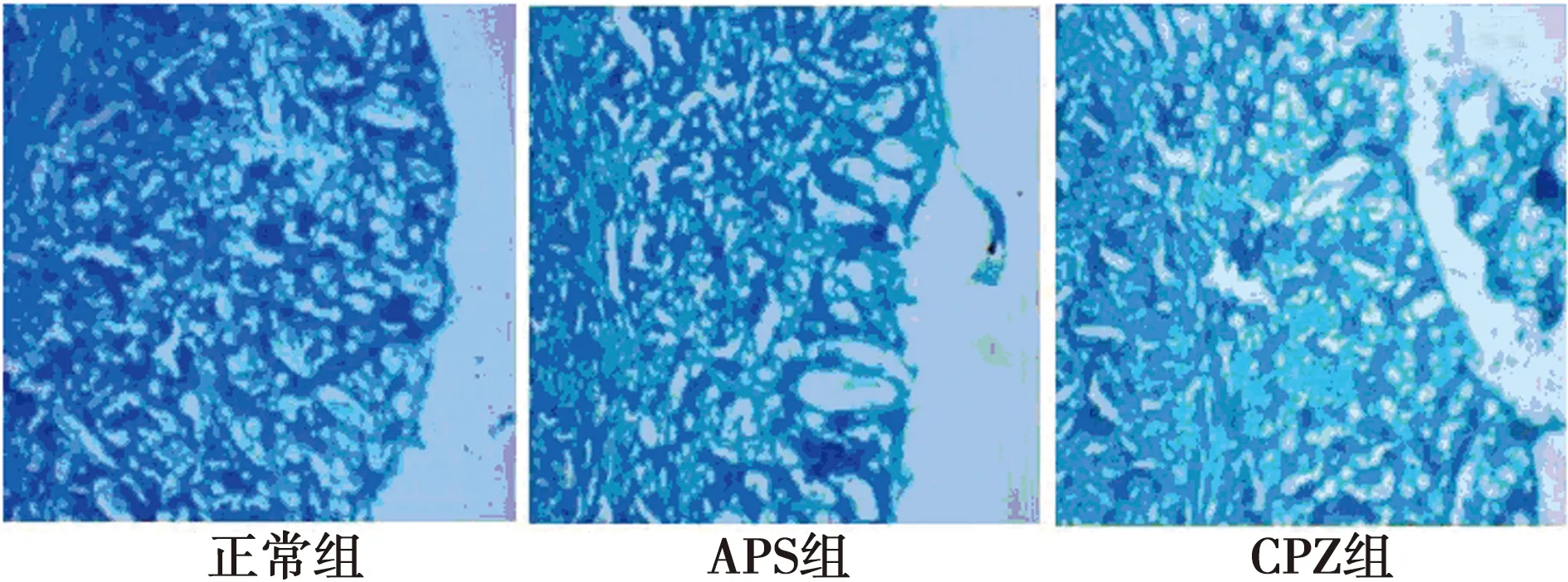
图1 3组脑组织LFB髓鞘染色(×200)
2.4APS促进CPZ小鼠脑组织MBP的表达 免疫荧光组化双染法观察造模后4~6 w小鼠脑组织MBP的表达,实验结果发现:正常组小鼠脑胼胝体切片中MBP阳性纤维完整、无损失;CPZ组显示明显而广泛的髓鞘损伤,MBP阳性纤维断裂以造模后5 w最为明显,MBP的表达量明显下降;APS组可见有完整的MBP阳性纤维及结构重建,提示APS能促进髓鞘的再生修复(图2~4)。对MBP平均荧光强度进行IOD值的统计发现:与正常组相比,CPZ 组和APS组小鼠的IOD值明显下降(P<0.001);APS组小鼠IOD值明显高于CPZ模型组(P<0.001),APS明显促进了CPZ小鼠髓鞘的再生修复。见表3。
图2 造模后4 w 3组小鼠脑组织MBP的表达(免疫组化,×400)
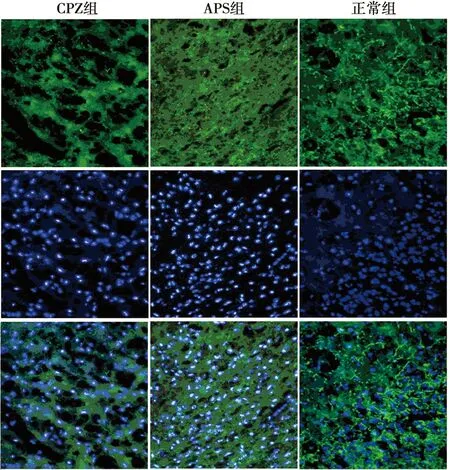
图3 造模后5 w 3组小鼠脑组织MBP的表达(免疫组化,×400)
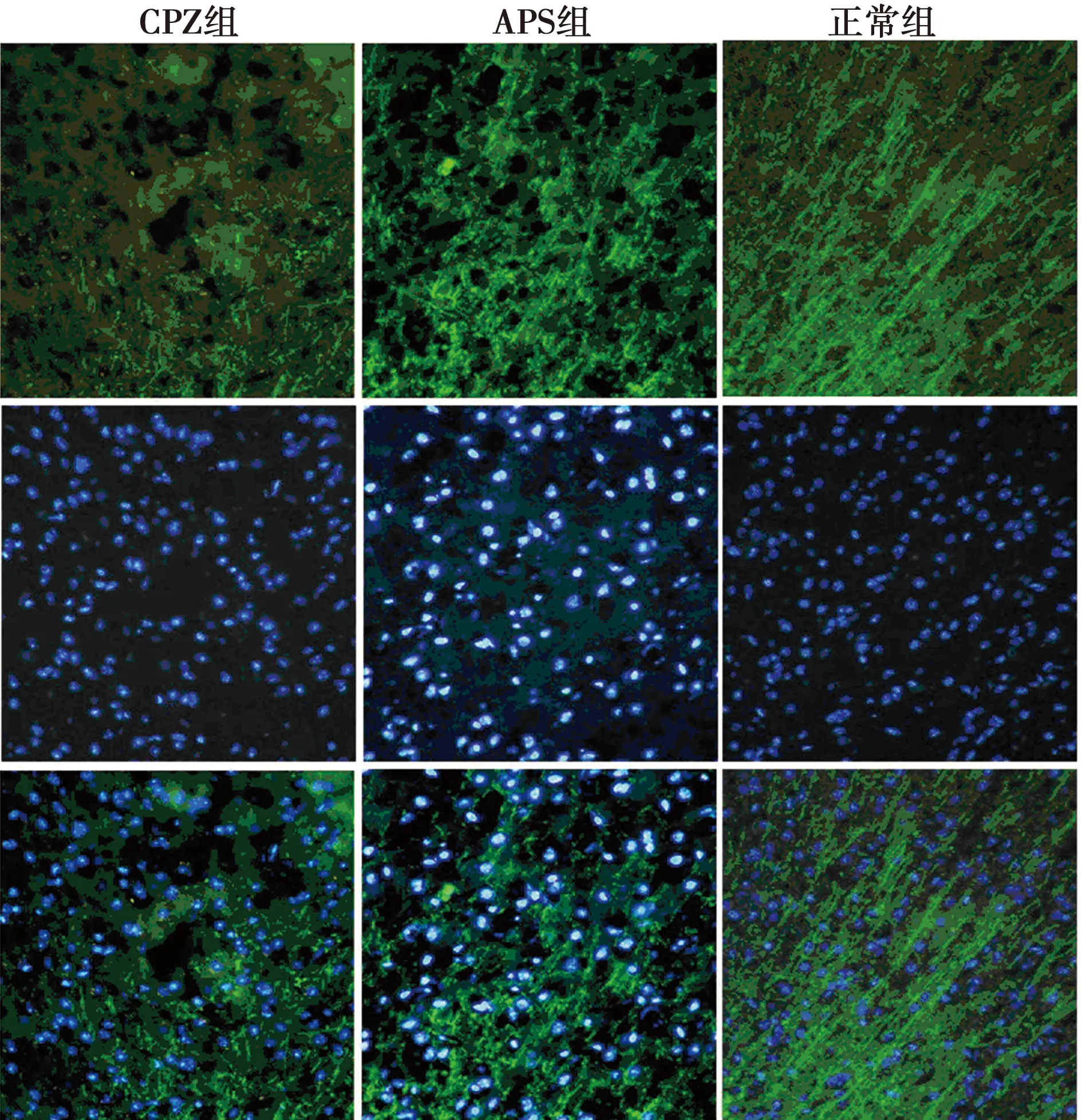
图4 造模后6 w 3组小鼠脑组织MBP的表达(免疫组化,×400)
2.5APS对CPZ小鼠脑组织形态学的影响 造模后4~6 w脑组织石蜡切片HE染色可见正常组小鼠有成熟的神经元,且分布均匀,小胶质细胞分布较少;CPZ组小鼠小胶质细胞聚集,数量明显增多,5 w达高峰,神经元排列紊乱,空泡形成;APS组神经元病理性损伤减轻,小胶质细胞数量较CPZ组减少(P<0.001),见图5,表4。
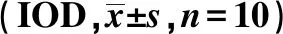
表3 造模后不同时间APS增加CPZ小鼠脑MBP的表达
与正常组比较:1)P<0.001;与APS组比较:2)P<0.001

图5 3组造模后不同时间脑组织形态学改变(HE ×400)
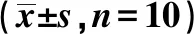
表4 造模后不同时间APS减少CPZ小鼠脑组织小胶质细胞数
与正常组比较:1)P<0.001;与APS组比较:2)P<0.05,3)P<0.001
2.6APS对CPZ小鼠脏器系数的影响 各组组间造模后4、5、6 w全脑重量比较差异有统计学意义(P<0.05,P<0.01),见表5。
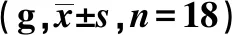
表5 造模后不同时间APS对CPZ小鼠脑重量的影响
与正常组比较:1)P<0.01,与CPZ组比较:2)P<0.05,3)P<0.01
4~6 w各组脏器系数分别为:正常组1.52±0.99、1.45±0.87和1.41±0.79;CPZ组2.07±0.64、1.99±0.89和1.98±0.69;APS组1.79±0.59、1.70±0.67和1.68±0.76。各组组间比较差异有统计学意义(P<0.05,P<0.01)。APS增加了CPZ小鼠脑重,降低了脏器系数。
3 讨 论
CPZ是Cu2+螯合剂,含Cu2+的辅酶在细胞内浓度极为有限,如干扰Cu2+在细胞内浓度的稳定性可导致神经变性,小剂量(0.2%)CPZ通过干扰Cu2+对酶抑制而产生神经毒性。CPZ作用于C57BL/6小鼠可明显诱导其CNS少突胶质细胞凋亡,引起髓鞘脱失〔10〕。利用这一特性,CPZ可用于建立MS等脱髓鞘疾病的动物模型,该模型的优势是与MS复发缓解的病理特点相似,可从髓鞘的脱失和再生角度对疾病进行模拟。
小鼠的体重变化和进食量可反映机体的整体状态和疾病的进展程度,脑脏器系数则较好地反映了CPZ对脑的毒性作用及APS的干预效应。体重减轻可能与CPZ导致小鼠摄食能力的下降和病情有关;进食量减少是CPZ的味道不佳,还是抑制摄食中枢或病情所致有待进一步研究。本研究结果,提示APS可减轻CPZ的毒性作用,保护脑组织。中医认为MS是“痿证”,明·方隅《医林绳墨》认为“痿者,气之软弱也……,气虚血瘀证”;《内经》言调理气血应“疏其气血,令其调达,以致和平”,故中医理论认为补益气血可改善MS患者的临床症状。黄芪无论从传统用药还是现代应用,均显示出良好的补益气血作用,APS是黄芪的有效单体成分,具有广泛的药理作用,如神经保护功能、对抗氧化应激诱导的神经变性及提高记忆力等,由此推测APS通过健脾补气增加小鼠进食量、体重和机体耐力。
MS的脱髓鞘和神经变性病变与小胶质细胞活化有关。一般情况下,不活化的小胶质细胞有助于神经元室内稳态。过度活化的小胶质细胞通过产生活性氧(ROS)和活性氮(RNS),诱导线粒体功能障碍,进而直接损伤少突胶质细胞前体细胞和神经元〔11,12〕。给予小鼠含cuprizone 的饲料2 w后,脑内小胶质细胞聚集,第3周髓鞘脱失显著且小胶质细胞聚集数量增加,4~6 w病变达高峰〔13〕。Lindner等〔14〕将17β-雌二醇给予CPZ模型小鼠时,小胶质细胞活化的延迟,髓鞘脱失减轻。Millet等〔15〕研究报道表明注射蛋白酶体抑制剂乳胞素,可促进CPZ小鼠髓鞘再生,并伴有小胶质细胞和巨噬细胞数量减少。体内给予小胶质细胞活化抑制剂米诺环素可抑制小胶质细胞的活化与增殖,阻止cuprizone引起的脱髓鞘〔13〕。本实验可见小胶质细胞在cuprizone 引起的脱髓鞘动物模型中具有有害作用,抑制小胶质细胞的聚集与活化可减少髓鞘脱失,促进髓鞘再生。
本实验LFB 染色显示CPZ组小鼠髓鞘染色变浅、断裂或缺失,提示造模成功;APS组小鼠髓鞘脱失减轻,证实APS有不同程度的髓鞘修复作用。MBP是CNS髓鞘的主要蛋白质,用于评价髓鞘的形成和发展,判断神经损伤的严重程度、损伤范围的指标〔16〕。MBP染色显示CPZ组小鼠MBP阳性纤维有明显而广泛的断裂,MBP的表达量显著下降,以造模后5 w最为明显;APS组小鼠脑组织有完整的MBP阳性纤维及结构重建,提示APS能促进髓鞘的再生修复。综上,APS对CPZ诱导的急性脱髓鞘小鼠具有较好的神经保护作用。
