TIG-Fc真核表达载体的构建及其对自然杀伤细胞功能的影响
2020-02-27李国华高锦伟周希胜王霞程伟华
李国华, 高锦伟, 周希胜, 王霞, 程伟华
1.陕西省延安市延安职业技术学院, 陕西 延安 716000;
2.陕西省延安市安塞区中医医院, 陕西 延安 717400;
3.陕西省宝鸡市凤翔县医院, 陕西 宝鸡 721400;
4.陕西省宝鸡市中心医院肝胆胰脾外科, 陕西 宝鸡 721000
T细胞免疫球蛋白和免疫受体酪氨酸抑制性基序结构域[ T-cell immunoglobulin and immunoreceptor tyrosine-based inhibitory motif (ITIM) domain,TIGIT ]是近年来新发现的一种跨膜蛋白,是CD28家族的成员之一,TIGIT的基因位于人类第16号染色体,编码由244个氨基酸组成的Ⅰ型跨膜蛋白[1-2]。TIGIT的结构包括胞外段的IgV结构域、跨膜结构域和胞内段的ITIM结构域。TIGIT仅限于在淋巴细胞上表达,其中表达水平较高的为CD4+调节性T细胞、CD4+滤泡辅助性T细胞、CD8+效应T细胞和自然杀伤(natural killer,NK)细胞,而在静息和活化B细胞表面均未检测到TIGIT的表达[3-5]。
近年来,TIGIT作为一种新型的免疫抑制性受体,在机体的免疫调节网络中扮演着重要角色,其对免疫细胞功能的影响也开始被重视。Yu等[6]的研究表明TIGIT可以作为配体作用于树突状细胞(dendritic cell,DC)表面的脊髓灰质炎病毒受体(polivirus receptor,PVR/CD155),并证明了TIGIT通过PVR通路可以诱导DC细胞提高IL-10的分泌水平从而抑制免疫反应。Joller等[7]构建了TIGIT基因敲除小鼠,在无抗原提呈细胞存在的培养体系中,利用具有功能活性的TIGIT单克隆抗体刺激T细胞,出现免疫应答下调的现象,表明TIGIT可以直接抑制T细胞的增殖。此外,有研究发现,TIGIT不但表达于T细胞表面,其在NK细胞表面也有高水平的表达,而且对NK细胞发挥直接抑制作用[8]。
为了进一步探究TIGIT对NK细胞的免疫负调节功能及机制,本研究利用分子生物学方法,将携带人TIGIT胞外段(即TIGIT第1~135位氨基酸,以保留功能结构域IgV区,此胞外段简称为TIG)与人免疫球蛋白G3(immunoglobulin G3,IgG3)Fc段的基因融合,然后插入真核表达载体pcDNA3.1(-)中,以构建重组质粒pcDNA3.1(-)-TIG-Fc。免疫球蛋白IgG3中的Fc段作为重要的蛋白融合标签,不但可以延长小分子蛋白质在体内的代谢时间,还可以作为识别标签用于目的蛋白的纯化[9-11]。随后通过检测细胞增殖和IFN-γ的分泌水平来明确TIG-Fc融合蛋白对NK细胞功能的影响,以期为研究相关疾病的免疫机理奠定理论基础。
1 材料与方法
1.1 实验材料
人TIGIT全长基因序列由生工生物工程(上海)股份有限公司合成;含有人IgG3 Fc段的质粒由本实验室保存;真核表达载体pcDNA3.1(-)购自美国Ambion公司;大肠杆菌DH5α感受态细胞购自北京全式金生物技术有限公司;NK-92细胞购于美国ATCC公司;人胚肾细胞HEK-293T由本实验室保存;抗人TIGIT [藻红蛋白(P-phycoerythrin,PE)标记]抗体购自美国eBioscience公司。
胰酶、胎牛血清(fetal bovine serum,FBS)均购自美国HyClone公司;限制性内切酶(NheⅠ和NotⅠ)、T4 DNA连接酶、Taq酶和高保真DNA聚合酶均购自宝生物工程(大连)有限公司;脂质体转染试剂LipofectamineTM2000购自美国英杰生命技术有限公司(Invitrogen公司);DMEM高糖培养基培养基购自中科迈晨(北京)科技有限公司(Macgene公司)。
琼脂糖凝胶DNA回收试剂盒、质粒提取试剂盒均购自天根生化科技(北京)有限公司;BCA蛋白浓度测定试剂盒、WST-1细胞增殖及细胞毒性检测试剂盒均购自上海碧云天生物技术研究所;人IFN-γ ELISA检测试剂盒购于厦门慧嘉生物科技有限公司;引物合成及DNA测序由生工生物工程(上海)股份有限公司完成。
1.2 pcDNA3.1(-)-TIG-Fc真核表达载体的构建
分别以TIGIT全长基因序列和含人IgG3 Fc段的质粒为模板,利用Primer 5.0软件,设计TIGIT胞外段引物TIG-F和TIG-R,从TIGIT全长基因中扩增TIGIT的胞外段(TIG);设计Fc段引物Fc-F和Fc-R,从含人IgG3 Fc段的质粒中扩增Fc片段。PCR反应体系为:DNA模板1 μL,正、反向引物各0.5 μL,Taq酶 0.3 μL,dNTP 2 μL,10×buffer 2.5 μL,去离子水补至25 μL。反应程序为:95 ℃预变性10 min;94 ℃ 30 s,63 ℃ 30 s,72 ℃ 45 s,共35个循环;72 ℃延伸10 min。引物Fc-F在合成过程中加入一段连接肽(linker)DNA序列,便于通过PCR搭桥方式和Fc基因融合,从而实现2个片段间的重叠延伸过程(引物及linker序列见表1)。然后分别将PCR产物中的人TIG和IgG3 Fc片段回收,以TIG-F和Fc-R为引物进行重叠PCR,扩增获得TIG-Fc融合基因。扩增体系为:模板各1 μL,10×buffer 2.5 μL,Taq酶 0.3 μL,dNTP 2 μL,引物TIG-F和Fc-R各0.5 μL,去离子水补至25 μL。扩增程序为:95 ℃预变性10 min;94 ℃ 45 s,64 ℃ 45 s,72 ℃ 45 s,共35个循环;72 ℃延伸 10 min。
将上述PCR扩增获得的融合基因和载体pcDNA3.1(-)分别用限制性内切酶NheⅠ和NotⅠ双酶切后,经1%琼脂糖凝胶电泳切胶回收酶切产物。将pcDNA3.1(-)载体与回收的DNA片段以3∶1的摩尔比,在T4连接酶作用下,于16 ℃连接过夜,以构建pcDNA3.1(-)-TIG-Fc重组质粒。随后,通过DH5α感受态转化,将其产物取100 μL均匀涂布于LB/Amp的平板中,37 ℃培养过夜,再挑取平板上生长的单克隆于37 ℃、250 r·min-1培养16~18 h,再通过PCR扩增进行鉴定。扩增体系为:菌液 2 μL,TaqPCR Master Mix 10 μL,引物TIG-F和Fc-R各0.5 μL,去离子水补至25 μL。扩增程序为:94 ℃预变性5 min;94 ℃ 45 s,68 ℃ 45 s,72 ℃ 45 s,共35个循环;72 ℃延伸10 min。选择鉴定为阳性的菌液用质粒小提试剂盒提取重组质粒,进行双酶切验证后,交至生工生物工程(上海)股份有限公司测序鉴定。

表1 本研究所用引物序列
1.3 细胞培养和转染
将人293T细胞在37 ℃、5%CO2条件下培养于添加10% FBS的高糖DMEM培养基中;将NK-92细胞培养于含12.5%FBS、12.5%马血清和终浓度100 U·mL-1重组人白细胞介素-2(recombinant human interleukin-2,rhIL-2)的α-MEM培养液中。在真核细胞转染的过程中,细胞培养至指数增长期,待其状态良好时进行实验,根据LipofectamineTM2000的试剂说明瞬时转染细胞,具体步骤如下:分别用约200 μL的无血清的DMEM高糖培养液稀释9 μL pcDNA3.1(-)-TIG-Fc(浓度为447 ng·μL-1)质粒和10 μL LipofectamineTM2000脂质体,充分混匀后室温静置5 min,然后将2管液体等量混合,轻轻混匀后静置15 min即为转染工作液。将细胞换至无血清培养液,将配置所得转染工作液轻轻缓慢加入细胞中,于37 ℃孵育4~6 h后更换成10% FBS培养液,培养48 h后收集细胞进行检测。
1.4 流式细胞仪检测
采用脂质体介导基因转染的方法,转染前1天,将处于对数生长期的细胞接种于6孔板内,于不含抗生素的培养基中培养,第2天进行细胞转染,细胞密度为80%左右,细胞分为空白组、阴性对照组(用LipofectamineTM2000转染空质粒)、转染组。转染完成后培养细胞48 h,用预冷PBS清洗细胞1次,然后每孔加入200 μL不含EDTA的胰酶消化液,放入孵箱内,观察细胞状态,镜下观察细胞变圆、细胞间间隙加大时,加入新鲜培养基吹打混匀,以制备细胞悬液,2 000 r·min-1离心5 min,弃上清,用300 μL 4%多聚甲醛重悬,室温避光固定30 min后,PBS清洗3次;细胞膜打孔,加入200 μL 0.2% TritonX-100,室温静置20 min后再用PBS清洗2次,重悬细胞,每管加入PE标记的抗人TIGIT抗体5 μL,37 ℃避光孵育30 min,PBS清洗2次,弃上清,500 μL PBS重悬细胞,上机检测TIG-Fc融合蛋白在细胞内的表达水平。
1.5 Western blot法检测
将对数生长期的人293T细胞接种于6孔板中,细胞分为空白组、阴性对照组(用LipofectamineTM2000转染空质粒)和转染组,同样采用脂质体转染的方法,将质粒转染至293T细胞中,转染完成后培养细胞24 h。随后收集细胞总蛋白,采用BCA法测定蛋白质浓度,进行蛋白质电泳后,转移至硝酸纤维素膜上;用5%的脱脂奶粉室温封闭1 h,加入一抗,稀释比例为1∶500,于4 ℃孵育过夜;TBST洗膜5次,每次5 min,洗涤后,加入二抗,稀释比例为1∶1000,于37 ℃孵育1 h;TBST洗膜5次,每次5 min,用化学发光法显色,以空白与阴性为对照,检测TIG-Fc融合蛋白表达情况。
1.6 细胞增殖实验
利用WST-1细胞增殖及细胞毒性检测试剂盒检测转染的重组质粒pcDNA3.1(-)-TIG-Fc对NK-92细胞增殖能力的影响。取对数生长期的NK-92细胞,分别以6 000个/孔的细胞密度接种于96孔细胞培养板中,于37 ℃细胞培养箱中培养过夜。将细胞分为空白组、阴性对照组(用LipofectamineTM2000转染空质粒)、转染组,每组设6个复孔,每孔200 μL溶液,根据LipofectamineTM2000转染试剂说明瞬时转染细胞,待转染6 h后,换成含10%血清的完全培养基继续培养,48 h后更换为无血清培养基,之后每孔换为事先配好的WST-1溶液100 μL,在细胞培养箱内继续孵育1~2 h,随后,充分混匀待检测体系,利用酶标仪检测450 nm处吸光度,其吸光度(OD值)代表其增殖率[12]。
1.7 ELISA检测
将pcDNA3.1(-)-TIG-Fc表达质粒转染入培养于6孔板的NK-92细胞中,细胞分为空白组、阴性对照组(用LipofectamineTM2000转染空质粒)、转染组,培养48 h后,吸取细胞培养上清,1 000 r·min-1离心20 min,吸取上清检测即可。具体步骤如下:将预先纯化的IFN-γ抗体包被微孔板于室温平衡30 min,每孔加入100 μL待测样品,37 ℃温育2 h(每组样品做3个复孔),弃液体,甩干,每孔加检测溶液A工作液100 μL,37 ℃温育1 h,PBS洗板5次,再每孔加检测溶液B工作液100 μL,37 ℃温育1 h,再用PBS洗板5次,加入底物显色液反应30 min显色,迅速终止反应,在酶标仪450 nm波长处测量各孔吸光度(OD值),按照标准曲线并结合OD值计算各组浓度,结果以pg·mL-1表示。
1.8 数据统计分析
利用Excel软件进行统计学分析,每组实验至少重复3次,数据采用“均数±标准差”表示,采用单因素方差进行差异显著性分析,P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 pcDNA3.1(-)-TIG-Fc表达载体的构建与鉴定
分别以TIGIT全长基因序列及含人IgG3 Fc段基因的质粒为模板,PCR扩增TIG和Fc的基因片段,产物长度分别为396 bp和744 bp(图1A)。通过重叠PCR将2个片段拼接为TIG-Fc,产物长度为1 114 bp,经琼脂糖凝胶电泳验证产物与理论基因片段长度一致(图1B)。对TIG-Fc融合基因片段和pcDNA3.1(-)表达载体进行双酶切,再经T4连接酶连接,获得重组表达质粒pcDNA3.1(-)-TIG-Fc,随机挑取7个单菌落进行菌液PCR验证,结果显示3~7号克隆的目的基因连接成功(图1C),取3号单克隆测序分析,测序结果表明TIG-Fc基因序列正确,无插入或缺失突变。
2.2 TIG-Fc融合蛋白在293T细胞中的表达
将pcDNA3.1(-)-TIG-Fc质粒通过脂质体法转染至293T细胞中,利用流式细胞术检测其蛋白表达情况。由图2可知,在转染空载体的阴性对照组中TIG-Fc融合蛋白表达较低,转染组中TIG-Fc蛋白表达显著升高,阳性率达77.14%(标记TIGIT),转染组与2个对照组之间的差异具有统计学意义(P<0.05),说明融合质粒构建成功并在293T细胞中表达。
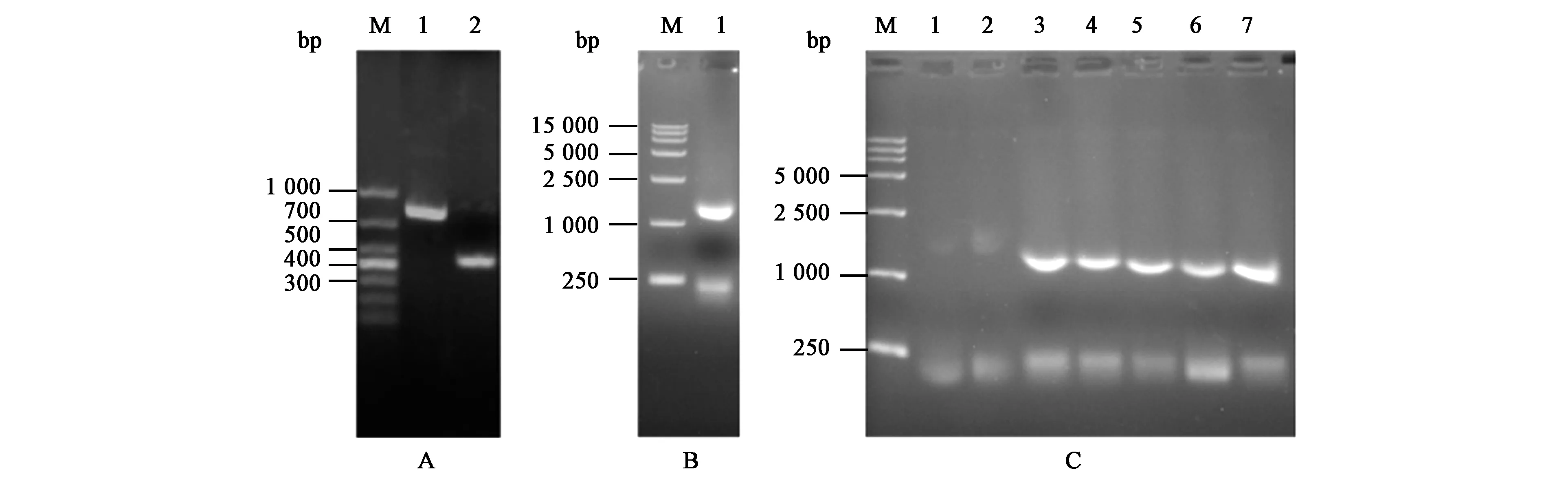
A:TIG和Fc的基因片段的电泳图 M—DNA Marker(Takara 3519Q),1—IgG3 Fc段基因,2—TIGIT胞外段(TIG)基因;B:重叠PCR扩增产物的电泳图 M—DNA Marker(Takara 3582Q),1—重叠PCR扩增产物;C:菌液PCR扩增产物的电泳图 M—DNA Marker(Takara 3582Q),1~7—1~7号单克隆PCR扩增产物。

注:M1:阳性细胞;Al:即All,所有细胞;Marker:分类;% gated:门内细胞的百分比。
2.3 Western blot法鉴定转染细胞系中融合蛋白的表达
将构建成功的TIG-Fc重组质粒转染至293T细胞中,24 h后提取总蛋白,利用Western blot检测其蛋白表达情况。由图3可知,当用抗TIGIT抗体免疫印迹时,转染组出现目标条带,分子量约为40 kDa,与TIG-Fc大小基本一致;而2个对照组无表达。这说明重组质粒能够在293T细胞中正确表达TIG-Fc融合蛋白。
2.4 TIG-Fc对NK细胞增殖的影响
将pcDNA3.1(-)-TIG-Fc表达质粒转染至NK-92细胞系中,利用WST-1实验检测细胞的增殖情况。由图4可知,转染组的细胞增殖率(0.532±0.07)显著低于阴性对照组(0.953±0.04)(P<0.05),而空白对照组与阴性对照组之间的差异不具有统计学意义(P>0.05),表明过表达TIG-Fc能够显著抑制NK-92细胞的增殖,抑制率达50%左右。

注:A—空白对照组;B—阴性对照组;C—转染组

注:不同小写字母表示不同处理间的差异具有统计学意义(P<0.05)。
2.5 TIG-Fc对NK-92细胞分泌IFN-γ水平的影响
由图5可知,pcDNA3.1(-)-TIG-Fc转染组的IFN-γ水平为(325.3±46.5)pg·mL-1,较空白对照组和阴性对照组显著降低(P<0.05);而空白对照组和阴性对照组之间的差异不具有统计学意义(P>0.05)。由此推测,TIG-Fc可通过抑制NK-92细胞分泌IFN-γ,进而抑制NK细胞的增殖与活化。

注:不同小写字母表示不同处理间的差异具有统计学意义(P<0.05)。
3 讨论
近年来,TIGIT作为一种新进的抑制性分子,其与免疫细胞间的相互作用逐渐受到重视。TIGIT是NK细胞和T细胞共有的抑制性受体,归类于CD28家族,与其配体PVR(CD155)、CD112结合后被激活,不仅可以抑制T细胞的功能,还能促进NK细胞的免疫抑制作用[13-15]。NK细胞是机体内一种重要的免疫细胞,在抗肿瘤、抗病毒和抗胞内寄生菌方面发挥着重要作用,NK细胞的活性是通过共刺激信号和共抑制信号之间的平衡来调控的,其参与抵抗肿瘤的第一道防线,NK细胞能够通过其表面的一系列抑制性受体、活化性受体和粘附受体,来区分识别应激转化后的被感染的细胞和健康的细胞[16]。有研究指出:对外周血NK细胞表面的TIGIT表达进行检测,结果发现系统性红斑狼疮(systemic lupus erythematosus,SLE)患者外周血NK细胞表面TIGIT的表达显著低于健康对照组,且其表达与疾病活动度、抗体产生及炎症程度相关,提示TIGIT可作为疾病活动度评价的指标[17];PVR表达于肝细胞的表面,接受TIGIT配体的刺激,通过抑制NK细胞的功能,来减轻炎症,促进肝细胞的再生[18];CD226和CD96作为新发现的NK细胞表面活化性受体,在机体抗肿瘤免疫中发挥着重要的作用,但TIGIT与CD266和CD96同时活化时,TIGIT对NK细胞的抑制性作用占主导地位[8]。
为了进一步研究TIGIT蛋白对NK细胞增殖及分泌细胞因子功能的影响,本研究首先构建了pcDNA3.1(-)-TIG-Fc的真核表达载体。在前期设计引物时,在TIG与Fc 2个基因间插入了一段柔性链,此段柔性肽的分子极性小,且富含甘氨酸和丝氨酸,易于弯曲,具有一定的弹性,使融合蛋白的2个部分有较大的间隔,保持活性必需的空间构象,并且避免了融合蛋白的2个部分产生相互作用[19]。
在成功构建TIG-Fc融合基因的基础上,将其转染至NK-92细胞中,研究发现,与2个对照组相比,转染了pcDNA3.1(-)-TIG-Fc质粒的NK-92细胞的增殖能力显著降低(P<0.05),并且细胞分泌IFN-γ的水平显著降低(P<0.05),表明TIG-Fc融合蛋白的表达可以影响NK细胞的功能。γ干扰素(IFN-γ)是Ⅱ型干扰素,主要由活化的T细胞和NK细胞产生,能够激活NK细胞等,从而增强免疫应答能力,是机体发挥免疫功能、清除体内病原体不可缺少的成分,具有强大的免疫调节作用和抗病毒、抗肿瘤的作用[20]。TIG-Fc在NK-92细胞的过表达使细胞分泌IFN-γ 的水平降低,这也进一步表明TIG-Fc可以直接抑制NK细胞的活化。
综上所述,本研究初步阐述了TIGIT对NK-92细胞增殖功能及分泌细胞因子功能的影响,但是TIGIT是如何发挥功能的,以及其分子机制仍有待深入研究。除此之外,TIGIT蛋白可以抑制多种自身免疫性疾病的发生和发展,如迟发型超敏反应(delayed-type hypersensitivity response,DTH)[6]、自身免疫性脑脊髓炎(experimental autoimmune encephalo-myelitis,EAE)[7]、SLE[17]和小鼠的移植物抗宿主病(graft-versus-host disease,GVHD)[21]。这些都和TIGIT蛋白对T细胞和NK细胞的抑制功能有关。也有研究报道阻断TIGIT可重塑NK细胞的功能,从而抑制肿瘤生长[22]。总之,TIGIT作为新兴的抑制分子,其在免疫调节疾病中的作用越来越突显,也为后续研究疾病机制开阔了思路。
