双重数字PCR在转基因大豆检测中的应用
2020-02-27刘晓朱鹏宇景小艳李志红张永江李想付伟
刘晓, 朱鹏宇, 景小艳, 李志红, 张永江, 李想, 付伟,*
1.中国农业大学植物保护学院, 北京 100193;
2.中国检验检疫科学研究院, 北京 100176;
3.上海海关动植物与食品检验检疫技术中心, 上海 200433
转基因作物自1994年商业化以来种植面积逐年增加,2017年达到了1.898亿 hm2。虽然各国对转基因作物的安全性评价标准有所不同,转基因作物的种植国家与种植面积在近些年来也略有变动,但总体发展态势十分良好。其中转基因大豆是研究比较多并且最早商业化的转基因作物品种,种植面积达到了9 140万hm2,占转基因作物总量的50%[1]。由于国内大豆生产成本高、进口大豆质优价低等因素,同时国内大豆市场面临国内种植规模小但需求量高的矛盾,我国需要进口大豆保障市场需求。国际市场上的大豆产品种类繁杂,其中转基因大豆占有相当大的比重。根据农业农村部的公告,截至2019年1月共有14个大豆转基因品系获得我国转基因生物进口安全证书(表1),这些转基因大豆品系随着国际贸易作为食品加工原料进入我国市场。除已获批的14个转基因大豆品系外,几个主要进口国还大面积种植了其他转基因品系,这些未获准入的大豆有可能在生产加工、运输、销售等过程中掺入其中,给我国进口大豆的精准检测带来障碍。同时为了满足众多消费者的知情权和消费权,必须加强转基因大豆的监管,提升转基因大豆的精准检测技术。实现这一目的的基础就是要加快实现微量转基因成分的定量检测,完善转基因产品管理体系。
目前,转基因成分定量检测应用最多的是实时荧光PCR技术[2],通过绘制标准物质浓度曲线,检测阈值来计算转基因成分含量,但是在实际应用中有一定局限性,其中最主要的是标准曲线的制备:首先很难做到精准的标准浓度梯度,其次在操作步骤及绘制曲线过程中会产生人工误差,数字PCR能够避免这些问题并且不受扩增效率的影响[4-5]。在实际检测过程中,不仅要检测大豆原料,有时也需要检测大豆深加工产品。深加工产品含有添加剂、色素等成分,往往提取的DNA质量不高,亟需选择一种灵敏度更高的检测方法,因此有学者尝试使用数字PCR检测方法,并证实了数字PCR灵敏度及重复性高于其他PCR方法[6-8]。dPCR是一种基于油包水结构实现单分子扩增的PCR方法,能实现不依赖于标准曲线检测拷贝数,利用内参基因与外源基因拷贝数比例来计算转基因成分含量,从而实现高灵敏度的定量并广泛应用于转基因成分的检测。吴潇等[9]利用微滴式数字PCR成功建立了转基因大豆GTS-40-3-2品系的检测方法。周圆等[10]建立了3种转基因玉米品系TC1507、MIR162、MIR604的二重微滴式数字PCR检测方法。Corbisier等[11]利用数字PCR方法也成功地检测到了转基因玉米MON810品系,并验证了其与实时荧光PCR结果的一致性。
对于转基因成分的绝对定量检测来说,单重检测在单个基因准确性方面具有较好的扩增效果,而且检测的稳定性较高;但是由于转基因成分绝对定量是基于外源基因与内标准基因的比值,因此双重检测具有潜在的较高的稳定性和准确性,而且相较于单重检测来说,具有较低的成本。
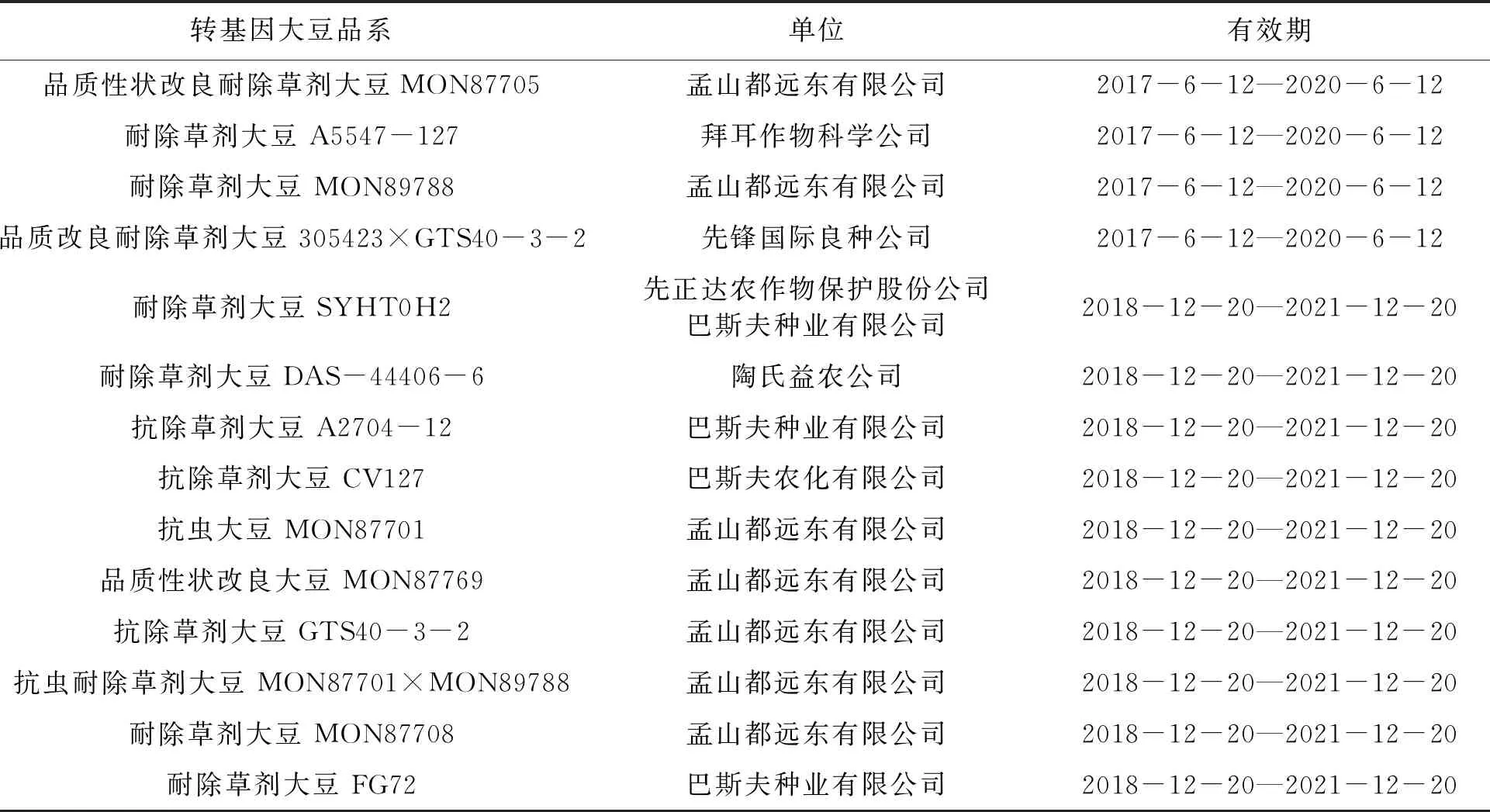
表1 转基因大豆安全证书(进口)批准清单
本研究基于数字PCR方法,针对MON87705、MON87769和DP356043三种转基因大豆的品系特异性序列进行引物的设计与优化,验证双重数字PCR在转基因大豆中的特异性、重复性、检测限和在实际样品中的检测效果等参数,并对双重微滴式数字PCR在转基因大豆检测的可行性以及标准化进行初步分析。在已有研究中,3个大豆品系的定量检测方法较少,其中转基因大豆MON87705尚未通过我国进口审批,但已在国外商业化,实际检测依靠筛选元件的筛查与判断不够准确,而本研究获得了3种大豆品系特异性序列,并针对侧翼片段和间插序列设计了引物与探针,以期能够实现转基因成分的品系溯源,为转基因大豆或大豆制品转基因成分定量研究提供技术方法。
1 材料与方法
1.1 实验材料与试剂
转基因大豆100% MON87705、100% MON87769、10% DP356043、MON87705、标准品购自美国油脂化学家协会(American Oil Chemists’ Society, AOCS)。ddPCR 预混液、微滴生成油、微滴分析油、微滴生成卡槽、微滴生成卡槽胶垫和96孔板购自美国Bio-Rad公司。
1.2 实验仪器
Nanodrop ND-1000核酸蛋白定量仪(Thermo Scientific, 美国);QX200 Droplet Digital PCR系统(Bio-Rad, 美国, 包括微滴生成仪、微滴读取仪和封膜仪);ABI StepOne Plus定量PCR仪(Applied Biosystem,美国)。
1.3 实验方法
1.3.1DNA提取 转基因大豆基因组采用改良CTAB法提取,基因组DNA通过Nanodrop ND-1000核酸蛋白定量仪检测纯度和浓度。
1.3.2引物与探针设计 大豆单拷贝内参基因lectin采用行业标准SN1204-2016提供的引物探针序列,大豆品系特异性区域序列参考GenBank并测序验证,采用NCBI数据库引物设计工具进行引物和探针的设计,并由英潍捷基(上海)股份有限公司合成,引物及探针信息见表2。

表2 引物探针序列
1.3.3微滴数字PCR 微滴式数字PCR包含四步:PCR体系配置、微滴生成、PCR扩增和信号读取。数字PCR体系为(20 μL):10 μL 2×ddPCR Master Mix,10 μmol·L-1内参基因,外源基因的正向引物和反向引物各1 μL,双探针各0.5 μL,DNA模板1 μL(模板浓度50 ng·μL-1)。微滴生成步骤需要专用的微滴生成卡以及微滴生成仪,将20 μL PCR体系和70 μL微滴生成油(droplet generation oil)加入微滴生成卡,覆盖专用胶垫后置入微滴生成仪,生成微滴。将微滴转入96孔板,用锡箔纸密封置于ABI-PCR仪中进行扩增。以lectin为内参基因,实验设置空白对照,并且每个样品3个平行。
微滴数字PCR扩增程序:94 ℃,10 min预变性;94 ℃变性15 s,57 ℃退火60 s,39个循环;98 ℃热失活10 min。扩增阶段结束将96孔板置入微滴读取仪中读取信号,并使用软件QuantaSoft V1.3.2.0分析实验数据。
1.3.4外源拷贝数的计算 ddPCR采用直接计数的方法进行拷贝数的计算。通过数字PCR反应总微滴数和阳性微滴数直接计算得到同一待测样中外源基因与内参基因的绝对拷贝数,再计算转基因样品中转基因成分含量即可。转基因成分含量计算公式如下所示:
转基因成分含量=(外源基因拷贝数/内标准基因拷贝数)×100%
1.4 特异性检测
实验以3个转基因大豆品系:MON87705、MON87769、DP356043为实验材料,并加入了转基因大豆常见品系DAS44406、MON87701验证不同品系双重数字PCR方法的特异性。具体反应体系与反应条件同1.3.3。
1.5 定量范围检测
将50 ng·μL-1的转基因大豆基因组用水进行梯度稀释,经过浓度梯度稀释后的转基因大豆基因组DNA用于双重数字PCR定量范围及检测限的测定。具体反应体系与反应条件同1.3.3。
2 结果与分析
2.1 特异性检测
实验所用的转基因品系特异性测定实验结果见图1。实验所用的品系特异性引物探针组合对非靶标大豆品系无扩增,数字PCR结果阴性点与阳性点的荧光信号区分明显,由图1B可知所建立方法可同时分析外源基因与内参基因的两种荧光信号并且相互无交叉扩增的影响。
2.2 定量范围检测
定量范围是指双重数字PCR检测方法所能实现稳定定量检测的质量百分比范围。满足稳定拷贝数:20 μL体系的数字PCR反应孔包含的目的基因拷贝数。定量检测应实现界定线性范围内的点满足线性拟合标准曲线线性系数大于95%。对于转基因成分检测来说重点是低含量转基因成分的有效检出,因此本研究重点对双重数字PCR检测限进行了检测。
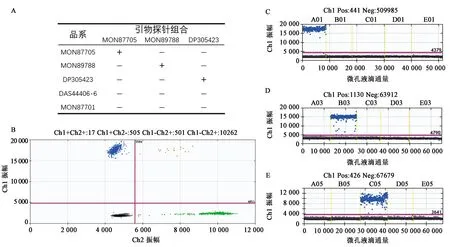
A:转基因大豆品系特异性验证结果;B:转基因大豆MON87705品系双重dPCR的二维散点图 蓝色点—外源基因阳性,绿色点—内参基因阳性,橘色点—外源基因阳性和内参基因阳性; C、D、E:分别为转基因大豆品系MON87705、MON89788、DP356043外源基因的微滴dPCR结果 蓝色点—阳性,灰色点—阴性,粉色线—荧光阈值限。
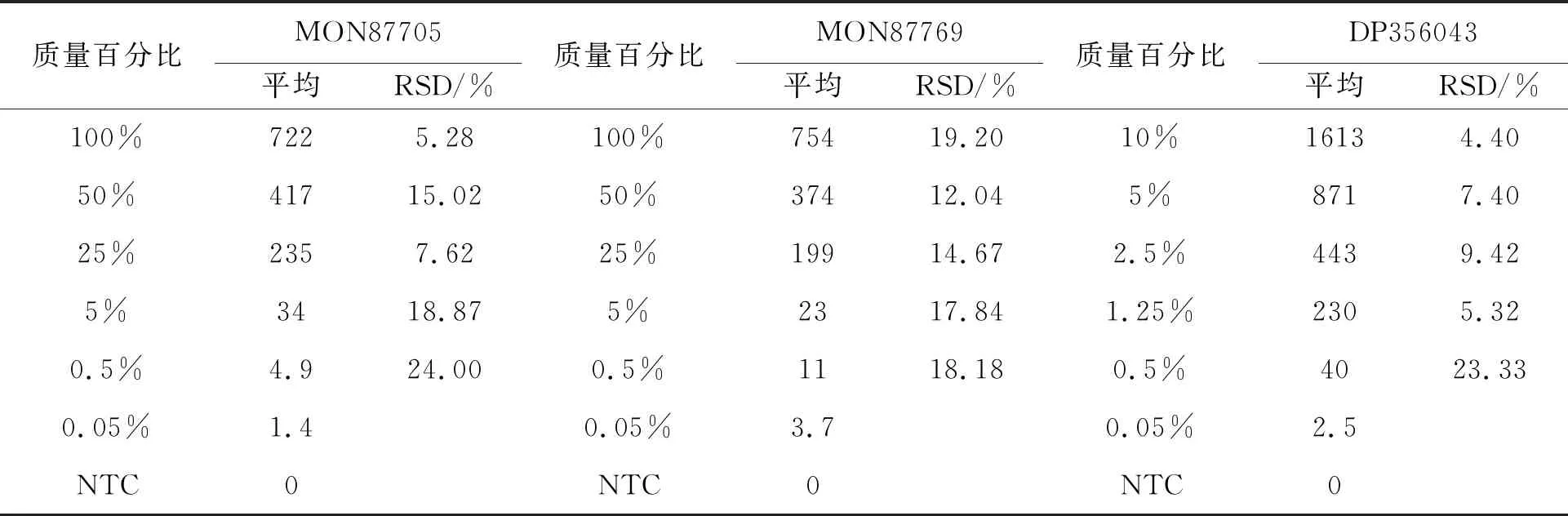
质量百分比MON87705平均RSD/%质量百分比MON87769平均RSD/%质量百分比DP356043平均RSD/%100%7225.28100%75419.2010%16134.4050%41715.0250%37412.045%8717.4025%2357.6225%19914.672.5%4439.425%3418.875%2317.841.25%2305.320.5%4.924.000.5%1118.180.5%4023.330.05%1.40.05%3.70.05%2.5NTC0NTC0NTC0

图2 转基因大豆定量检测结果
通过三个品系的双重数字PCR定量结果及双重数字PCR反应热点图可以看出,本研究中双重数字PCR检测体系具有较高的检测线性,并且不同组内的RSD值小于25%。双重数字PCR反应阳性点与阴性点的区分非常明显,结果表明所建立方法的稳定性和重复性较好。从验证结果可以看出,本研究中的检测体系在质量百分比为0.5%的样品中可以实现稳定扩增,在0.05%的样品中可以出现阳性结果,但是所有平行不全为阳性,因此,本研究设定定性检测限定为0.05%,定量检测限为0.5%。
2.3 转基因大豆品系拷贝数分析
利用转基因成分含量计算公式进行计算,结果如表4所示,MON87705和MON87769含量分别为115.43%、104.08%,DP356043含量为12.75%,RSD均符合稳定定量检测标准。
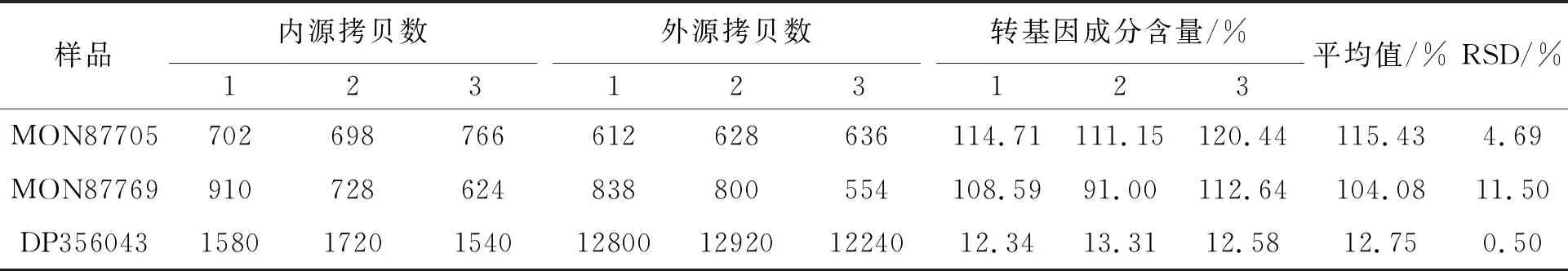
表4 大豆转基因成分拷贝数结果
3 讨论
近年来随着转基因技术的推广及商业化程度的加深,进口产品或市售大豆制品所含转基因成分越来越复杂,实际检测过程中常常会遇到样品混杂、纯度低或多拷贝整合等情况[12],十分不利于国家对转基因商品市场的监督管理。数字PCR方法作为一种新型的准确定量技术,在灵敏度、稳定性等方面都优于其他PCR方法,更适合应用于实际检测工作。本研究建立了一种转基因大豆品系的数字PCR检测方法,验证了检测特异性、定量范围等参数,结果显示实验所用引物探针组合在数字PCR方法中仅对目标大豆品系有荧光信号产生,可以进行特异性扩增,用于大豆转基因品系的筛选与鉴别,方法也可以准确检测出大豆中转基因成分的含量,定量检测限可达0.5%,研究同时测定了转基因大豆的外源基因拷贝数,其结果与购买标准品的参数大体一致,也说明本研究建立的双重数字PCR体系能够准确且稳定的满足实际检测需要。数字PCR是一种灵敏、准确的定量技术,操作流程较为简单,采用基因组DNA可直接进行检测。此外不需要绘制标准曲线,可以直接实现对拷贝数的绝对定量分析,在线性范围、检测极限和定量极限等方面都更胜于实时荧光PCR,因此受到很多学者的认可[13-14]。双重数字PCR相对于单重数字PCR在稳定性和准确性方面具有明显的优势,尤其是检测通量大大提高[15]。通过对实际样品的检测所建立的双重数字PCR方法适用于港口及各检验检疫单位或者其他科研单位,以进行转基因大豆的品系特异性高效定量成分检测。
