大鼠肝癌模型中Piwil4、Mael和Ddx4基因mRNA和蛋白表达水平及其与肿瘤检测的关系
2020-02-27古丽米热依米提斯坎德尔白克力王延蛟
古丽米热·依米提, 斯坎德尔·白克力, 王延蛟
新疆医科大学基础医学院, 乌鲁木齐 830011
肝癌是常见的恶性肿瘤之一, 其发病机制与癌基因的激活有关[1]。目前,对癌症发生发展的研究主要集中在肿瘤相关基因的表达调控方面[2]。DEN二乙基亚硝胺(diethylnitrosamine, DEN)对人体和动物都存在剧毒性,即使是小剂量注射或口服给药也会造成严重的肝损伤。DEN诱发大鼠肝癌模型是目前研究分析人类肝细胞癌的发病机制和过程的理想动物模型[3]。非编码小RNA与肿瘤类型密切相关[4]。非编码RNA是一类不编码蛋白质的基因转录产物,PIWI相互作用RNA(piRNA)是一种非编码RNA[5]。Aravin等[6]在雄性小鼠睾丸组织中分离出一段小RNA,该RNA主要与Argnaute家族PIWI蛋白成员相互作用而将其命名为piRNA,piRNA是长度约为24~31 nt的新型非编码RNA,piRNA在肿瘤的发生中发挥着重要的作用[7]。piRNA不仅参与生殖细胞的调控,而且在宫颈癌、胃癌、乳腺癌和膀胱癌等多种癌细胞中均检测到piRNA的异常表达[8],piRNA与PIWI蛋白家族成员相结合才能发挥调控作用。研究表明,PIWI和piRNA的表达水平与肿瘤类型密切相关。PIWI/piRNA调控靶基因的稳定性表达、转录及转录后水平的修饰[9]。已有研究发现,多种肿瘤中PIWI蛋白高表达,PIWI蛋白异常表达水平与肿瘤的恶性程度显著相关[10]。PIWI可能还参与胃癌和其他癌症的发展,并且是癌症诊断的一个潜在标记[11]。PIWIL2 mRNA在肝癌中的表达量比肿瘤周围的肝脏组织的表达量高(P<0.05),Piwil2基因mRNA的表达与PIWIL2蛋白质的表达相关,PIWIL2有可能成为肝癌的检测及治疗的分子标志物[12]。PIWIL2可以通过控制p53作为STAT3信号通路的正调节,使p53基因发生修饰和沉默,从而抑制肿瘤细胞的凋亡发挥癌基因的作用[13]。PIWI/piRNA通路相关基因Piwil4、Mael和Ddx4作为候选癌基因在多种癌组织中表达,而在肝癌组织中的研究尚未见相关报道。
本研究以建立的大鼠肝癌动物模型为研究对象,通过ELISA方法检测肝癌模型各组血清肿瘤标记物验证大鼠肝癌病证动物模型;采用实时荧光定量PCR(qRT-PCR)、蛋白免疫印迹技术(Western-blot)和免疫组织化学方法分别检测肝癌模型组织中Piwil4、Mael、Ddx4基因mRNA和蛋白的表达水平,探讨Piwil4、Mael、Ddx4基因在肝癌中表达水平变化的影响。
1 材料与方法
1.1 材料
选取健康雄性40只Wistar大鼠(提供单位:新疆医科大学动物实验中心,动物合格证号:65000700000538),体重约(150±10)g,月龄约为6月。DEN购自Sigma公司。Mael、Piwil4、Ddx4和GAPDH引物合成自上海生工公司,Mael、Piwil4、Ddx4和GAPDH兔抗鼠单克隆抗体购自ABCAM公司,RNA提取试剂盒购自聚合美生物公司,蛋白裂解液购自Thermo公司。
1.2 肝癌动物模型建立与分组
选取雄性Wistar大鼠40只,饲养3 d后大鼠随机分成肝癌模型组(自由饮用灭菌水配制的浓度为0.1 mg·mL-1的DEN 溶液,20只)和正常对照组(饮用灭菌水,普通饲料饲养,20只)。满20周处死动物并取肝组织 -80 ℃冰箱保存备用。
1.3 观察大鼠肝癌模型肝组织病理形态学特征
分别取肝癌组小鼠肝组织和正常组小鼠肝组织,4% PFA溶液固定,石蜡包埋两组肝组织切片,HE染色,显微镜下观察病理切片检测组织形态特征。
1.4 酶联免疫吸附剂(ELISA)测定模型各组中的肿瘤标记物(HSP、ARF、ASMA)
取血后,室温下血液凝固2 h,4 ℃过夜,离心(3 000 r·min-1,4 ℃,10 min),弃不溶物,将血清移至试管,置于-80 ℃保存。按照AFP-L3、HSP-70、ASMA ELISA试剂说明书要求,配标准曲线(AFP:64、32、16、8、4、0 ng·mL-1;HSP:400、200、100、50、25、0 pg·mL-1;ASMA:200、100、50、25、12.5、0 IU·L-1),加入标准液,加入样品,洗涤,测450 nm分光光度值,根据标准曲线计算各组血清中肿瘤标记物的表达量。
1.5 实时荧光定量(qRT-PCR)法检测Piwil4、Mael和Ddx4基因的mRNA表达
用加强型组织/细胞RNA快速提取试剂盒(聚合美生物公司)提取总RNA,反转录成cDNA。所用引物均由上海生工公司合成,引物序列见表1。
实时荧光定量qRT-PCR按 SYBR Green RT-PCR试剂盒的操作步骤进行。充分混匀以上反应体系(25 μL):12.5 μL SYBR Premix ExTaqTM,10.3 μL dd H2O,1 μL cDNA模板,1.6 μL上游引物,1.6 μL下游引物。PCR反应条件为: 95 ℃ 3 min;95 ℃ 10 s,Tm30 s,40个循环;95 ℃ 10 s延伸,40个循环(由设定点温度增加0.5 ℃/s)。结果用目的基因在肝癌模型组相对于正常对照组的mRNA相对模板表达量差异倍数用2-ΔΔCt方法来计算,其中ΔΔCt=(CtTarget-CtGAPDH)处理-(CtTarget-CtGAPDH)对照。

表1 实时荧光定量PCR引物序列及扩增片段
1.6 蛋白质印迹法(Western-blot)检测Piwil4、Mael和Ddx4基因在蛋白的表达
20周后处死动物并取各组肝组织立即用液氮研磨,加蛋白裂解液提取总蛋白,用BCA试剂盒对总蛋白进行定量。加6×电泳上样缓冲液沸水浴10 min,SDS-PAGE电泳(80 V 30 min,100 V 40 min),PVDF转膜(80 mA,2 h 30 min),封闭,一抗4 ℃孵育过夜(GAPDH 1∶5 000; PIWIL4 1∶1 000;MAEL 1∶2 000;DDX4 1∶1 000),TBST洗膜5次,HRP标记(山羊抗兔1∶10 000)的二抗孵育2 h,TBST洗膜5次,加入ECL化学发光试剂进行曝光。
1.7 免疫组织化学法检测Piwil4、Mael和Ddx4基因的蛋白表达水平
60 ℃温箱中烘烤60 min;二甲苯Ⅰ、二甲苯Ⅱ浸泡15 min,95%乙醇、85%乙醇、75%乙醇浸泡5 min,洗涤;用沸腾的10 mmol·L-1枸橼酸盐缓冲液洗涤,3% H2O2-甲醇溶液中洗涤15 min,5%山羊血清室温封闭40 min,加一抗过夜,洗涤,加酶标二抗孵育40 min,洗涤,DAB显色液显色10 min,蒸馏水终止显色,苏木素染液复染10 min,脱色反蓝,封片,显微镜拍片。
1.8 统计学方法
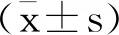
2 结果与分析
2.1 肝癌组织病理形态学特征
成功建立大鼠肝癌模型,正常组大鼠肝组织细胞结构完整,肝细胞排列规则,细胞核形态正常。肝小叶结构正常,未见纤维间隔,未见细胞水肿,未见坏死肝细胞(图1)。肝癌模型组大鼠肝细胞呈多角形,异型性明显,胞浆丰富,嗜酸性,核大,圆形,有清楚的核仁。分化差异癌细胞异型性明显,常有巨核及多核瘤细胞(图1)。
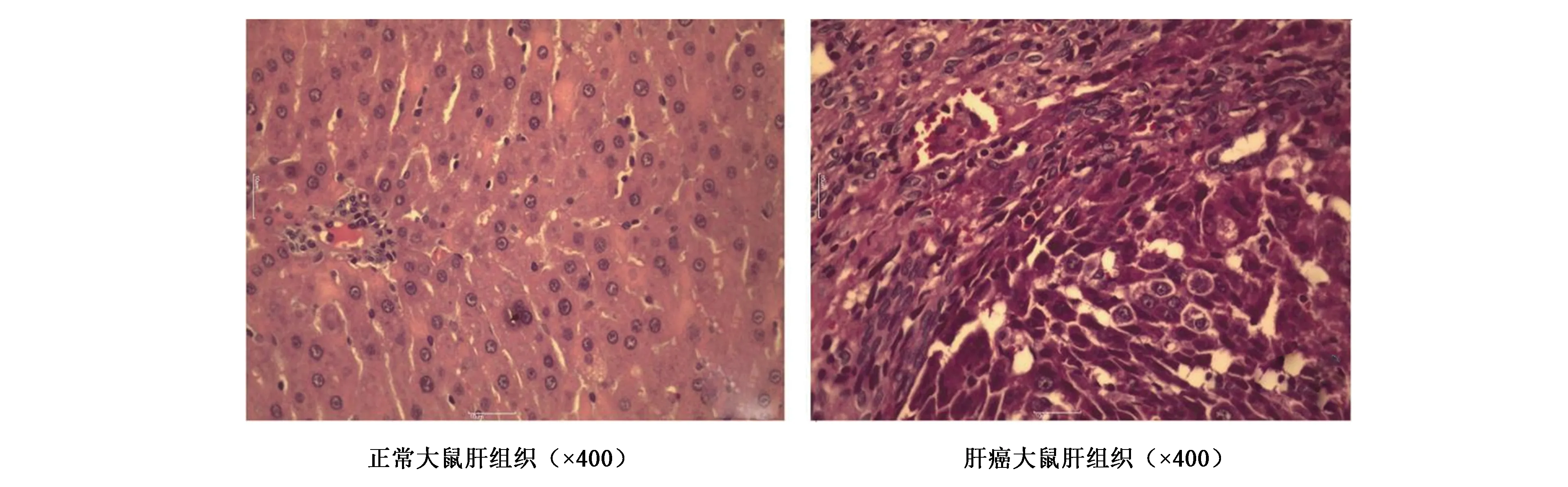
图1 HE染色观察肝脏病理形态特征
2.2 肝癌模型组织中肿瘤标记物(HSP、ARF、ASMA)表达水平
结果(图2)表明,肿瘤标记物AFP肝癌模型组(6.70±3.17)与正常对照组(0.98±0.13)差异极显著(P<0.05);肿瘤标记物ASMA肝癌模型组(62.63±2.65)与正常对照组(48.09±4.23)差异极显著(P<0.05);肿瘤标记物HSP肝癌模型组(27.43±3.18)与正常对照组(6.64±4.57)差异极显著(P<0.05)。
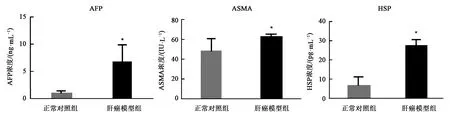
图2 肝癌模型组织中肿瘤标记物表达变化
2.3 肝癌模型组织中Piwil4、Mael和Ddx4基因的mRNA表达水平
结果(图3)表明,肝癌模型组织中Piwill4、Mael和Ddx4mRNA相对表达水平分别为114.8±15.74、5.66±2.02、15.07±6.17,正常对照组mRNA相对表达水平分别为1.18±0.23、1.27±0.27、1.57±0.49。在肝癌模型组织中Piwil4、Mael和Ddx4基因mRNA表达水平明显高于正常肝组织(P<0.05)。
2.4 Western-blot法检测肝癌模型组织中PIWIL4、MAEL和DDX4蛋白表达水平
结果(图4)表明,肝癌模型组中PIWIL4、MAEL和DDX4蛋白表达水平分别为2.23±0.49、0.14±0.02、1.36±0.12,正常对照组蛋白表达水平分别为0.85±0.15、0.04±0.05、0.71±0.11。在肝癌模型组织中PIWIL4、MAEL和DDX4 蛋白表达水平明显高于对应的正常肝组织(P<0.05)。
图3 肝癌模型组织中Piwil4、Mael和Ddx4 mRNA的相对表达水平

图4 肝癌模型组织中PIWIL4、MAEL、DDX4蛋白表达水平
2.5 免疫组织化学法检测肝癌模型组织中PIWIL4、MAEL和DDX4蛋白表达水平
结果(图5)表明,肝癌模型组中PIWIL4、MAEL、DDX4蛋白表达水平分别为879.9±12.64、904.6±8.73、874.8±7.95,正常对照组蛋白表达水平分别为292.0±3.55、343.1±8.05、290.5±6.09。在肝癌模型组织中PIWIL4、MAEL、DDX4蛋白表达水平明显高于对应的正常肝组织,在肝癌模型组织中高表达(P<0.05)。
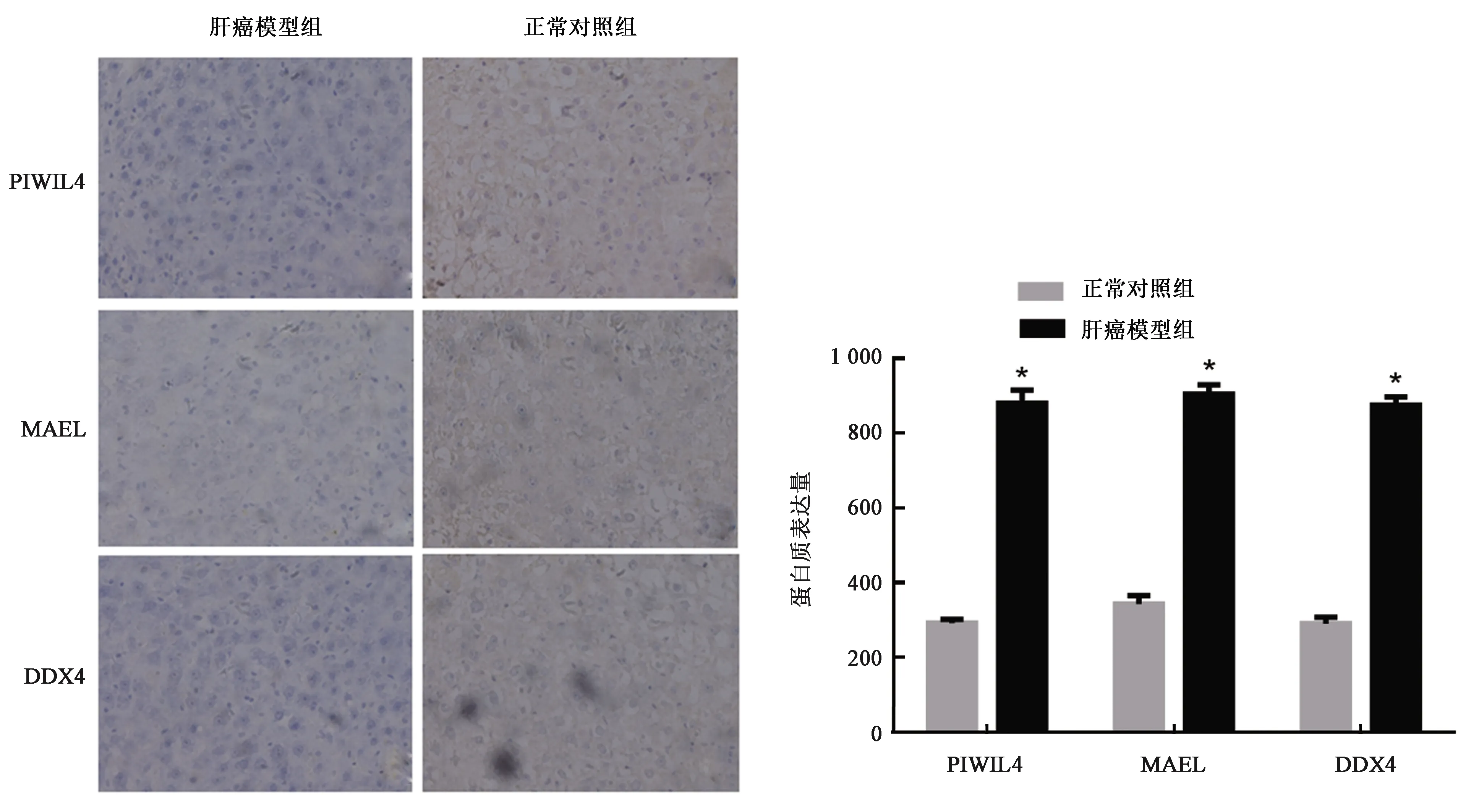
图5 PIWIL4、MAEL和DDX4蛋白的表达水平
3 讨论
肝癌是常见的恶性肿瘤之一,严重威胁着人类健康,目前认为其发病受遗传因素和环境因素双重影响。对肝癌的发生及发展主要集中在肿瘤相关基因的调控等方面的研究。
PIWI/piRNA不仅在人睾丸和造血干细胞大量表达,也在多种肿瘤组织和肿瘤细胞株有异常表达。在乳腺癌等肿瘤中,PIWI蛋白在肿瘤表达量与恶性程度呈正相关[14]。PIWI蛋白含量用于判断肿瘤恶性程度在胃癌、胰腺癌、食管鳞状细胞癌、肉瘤和肝细胞癌的研究中已得到证实[15]。
Piwil2与Piwil4都是PIWI家族亚成员,PIWIL2在恶性肿瘤中过度表达使抑癌基因沉默,促进肿瘤的发展[16]。Piwil2基因的高表达诱导抗凋亡基因Bcl-xL的过表达,引起STAT3基因的表达上升,激活STAT3/BCL-XL通路抑制肿瘤细胞凋亡[17]。在结肠癌及其癌旁组织中,Piwil2的异常表达可促进肿瘤的转移与病人生存期呈负相关[18]。PIWIL4蛋白参与修复p53蛋白的突变,促进p53蛋白发挥功能[19],PIWIL4蛋白的低表达会影响miRNA的稳定性[20]。2010年苏畅等[21]发现Piwil4基因在人宫颈癌组织中的表达水平较正常组织髙,能够促进细胞的生长活性和增殖能力,并能抑制其凋亡。
Mael与Ddx4(Vasa)基因与PIWI通路相关,研究发现Mael基因在结直肠癌等癌组织中异常高表达[22]。徐景波等[23]研究发现DDX4高表达与卵巢癌的发生、发展密切相关。李斌等[24]研究发现,靶向沉默Ddx4基因可明显抑制裸鼠食管鳞癌细胞成瘤,Ddx4基因沉默可能是通过抑制 PI3K的活性,由此参入并下调 PI3K/Akt 信号通路,进而发挥抑制肿瘤细胞增殖、诱导细胞凋亡的作用。
本研究对肝癌模型中的肿瘤标记物在肝癌模型组织中的肿瘤标记物含量高于正常对照组含量,可以推测肿瘤标记物在肝癌模型组织中的表达升高。qRT-PCR及Western-blot方法检测,结果表明肝癌模型组织中Piwil4、Mael和Ddx4基因mRNA和蛋白表达水平明显高于对应的正常组织(P<0.05)。Piwil基因mRNA的表达与PIWIL蛋白质的表达有相关性。提示Piwi基因的mRNA表达及蛋白表达与肝癌的恶性程度及预后有关。综上所述,研究表明,Piwil4、Mael和Ddx4基因mRNA及蛋白在肝癌模型组织中高表达,对肝癌的早期诊断提供一定的依据。肝癌模型组织中PIWI基因表达水平有望作为肝癌的检测及治疗的一种分子标志物。
