真菌漆酶及其介体系统:来源、机理与应用
2020-02-27徐鑫张国庆胡渤洋刘子璐孙悦
徐鑫, 张国庆,2*, 胡渤洋, 刘子璐, 孙悦
1.北京农学院生物与资源环境学院, 农业农村部华北都市农业重点实验室, 北京 102206;
2.北京农学院植物科学技术学院, 北京林木分子设计育种高精尖创新中心, 农业应用新技术北京市重点实验室, 北京 102206
漆酶(laccase, Lac,p-diphenol: dioxygen oxidoreductases, EC 1.10.3.2)是一类含铜的多酚氧化酶,其研究历史最早可以追溯到19世纪末。漆酶广泛分布于植物、真菌、细菌、昆虫等中,其中尤以真菌漆酶在环境污染物降解中的重要作用成为近年来的研究热点[1]。漆酶的作用底物广泛,能够催化木质素、酚类、胺类等芳香族、非芳香族化合物的氧化分解,最终将分子氧还原成水,不产生其他副产物,因而也被称为“绿色催化剂”,被广泛应用于环保、造纸、纺织、食品加工、药品改良等领域[2]。另外,漆酶结合小分子化合物构成漆酶/介体系统(laccase mediator system,LMS),对多种酚类、胺类、蒽醌类、杂环类以及有机磷化合物表现出更高效的降解能力[3]。本文就近年来真菌漆酶及其介体系统研究进行了综述,以期为后续漆酶相关研究提供参考。
1 漆酶的来源与功能
漆酶早在1883年就被日本科学家Yoshida[4]从日本漆树(Rhusvernicifera)的汁液中分离出来,并对其进行命名。1896年Bertrand[5]证实漆酶是一种含金属蛋白,这一发现为后续漆酶结构以及功能研究奠定了基础。后经大量研究发现,漆酶还存在于昆虫、细菌和真菌中,可以说漆酶是一类广泛存在的活性蛋白[6, 7]。依据来源不同,漆酶可主要分为两个大的类群,即植物漆酶和微生物漆酶,另外还有少量动物漆酶[8]。植物漆酶研究历史最为悠久,如野漆树(Rhussuccedanea)[4]、茶树(Camelliasinensis)[9]、白桦(Betulaplatyphylla)[10]等。而真菌漆酶分布最广、报道最多,广泛分布于白腐真菌、软腐真菌、腐生真菌、菌根真菌、病原真菌等,尤以白腐真菌的研究和应用最广泛[1,11],如云芝(Trametesversicolor)[12]和一色齿毛菌(Cerrenaunicolor)[13]等。
不同物种来源的漆酶功能不同。茶树(Camelliasinensis)[9]和龙眼(Dimocarpuslongan)[14]等植物的漆酶分布于细胞壁中,主要功能是参与木质素的合成反应、病虫害防治以及多种抗逆反应[8-9,15]。在云芝(T.versicolor)、糙皮侧耳(P.ostreatus)和粗毛栓菌(Trametestrogii)等真菌中,漆酶所发挥的作用更加多样,参与多种生理生化反应,如真菌形态的产生、真菌病原体与宿主的相互作用、木质素的降解与利用以及胁迫反应和防御机制等[8]。细菌漆酶多来自芽孢杆菌属细菌,其存在与细菌本身的形态有关,并参与棕色孢子的形成以及孢子保护系统的构建[15]。另外,在棉铃虫(Helicoverpaarmigera)[16]和亚洲玉米螟(Ostriniafurnacalis)[17]等昆虫中,漆酶的主要功能是参与昆虫的生长发育与变态,并在角质层的形成及硬化和免疫防御过程中起重要作用。
漆酶有众多的同工酶,共同发挥作用,以实现对木质素等高分子底物的高效降解[18]。如已报道的一色齿毛菌(C.unicolor)漆酶同工酶有14种[13]。到目前为止,已有100多种漆酶从真菌中成功分离纯化,并完成了性质研究,其中多数已经进行工业化生产并投入使用,植物漆酶和动物漆酶还未见工业化生产,这是由于植物和动物的粗提液成分十分复杂,从中分离纯化出单纯漆酶难度较大[1, 6, 18]。因此,目前具有实际应用价值的漆酶主要是真菌漆酶。
2 真菌漆酶的结构
真菌漆酶一般为胞外分泌且高度糖基化的单亚基蛋白,由500~550个氨基酸组成,分子量约60~90 kDa、等电点在pH 4.0左右,伴有不同程度的糖基化,糖基含量约为10%~25%,主要有葡萄糖、甘露糖、半乳糖、氨基己糖等[16]。漆酶很少以单体形式参与反应,多数情况下在反应前多种同工酶通过寡聚化形成多聚复合体而进行催化反应,复杂的肽链保证了复合酶的稳定性,而高度的糖基化决定了复合酶的特异性[19]。
漆酶与抗坏血酸氧化酶、铜蓝蛋白、铁氧化酶和胆红素氧化酶同属于多铜氧化酶家族(multicopper oxidase family)。典型漆酶含有的4个铜离子,分别构成了T1-Cu、T2-Cu和T3-Cu三型铜离子(铜离子活性中心),其中T1型铜离子(T1-Cu)为顺磁性“蓝色”铜,在610 nm有特征吸收峰;T2型(T2-Cu)为非“蓝色”顺磁性铜,无特征吸收峰;T3型(T3-Cu)为2个铜离子构成的抗磁自旋耦合铜-铜对,在330 nm处有特征吸收峰。含有蓝色铜离子的漆酶被称作蓝漆酶,后发现有些漆酶与传统蓝漆酶不同,缺失蓝色铜,因此也将其称作黄漆酶或白漆酶[20-23]。漆酶的高级结构是在肽链的基础上围绕Cu中心缠绕而成,多呈现球状或杯状,这既加快了底物与漆酶的结合,也对活性中心内的金属离子起到了保护作用。至今已有多种真菌漆酶的高级结构被解析[24]。2007年Matera等[25]从粗毛栓菌(Trametestrogii)中分离得到一种漆酶(PDB ID: 2HRH,图1A),是传统的蓝漆酶。随后在2015年Glazunova等[26]从硬毛革孔菌(Coriolopsiscaperata)中得到了一种T2-Cu缺失型漆酶(PDB ID: 4JHV,图1B)。伴随基因克隆技术的发展,真菌漆酶基因及其4个铜离子对应的Cu保守区氨基酸序列被逐步解析,毛栓菌(T.hirsuta)、云芝(Trametesversicolor)等多种栓菌属漆酶含4个Cu保守区(Cu I、Cu II、Cu III和Cu IV),其序列分别为HWHGFFQ、YHSHLSTQY、PHPFHLHGH和HCHIDFH。

A:蓝漆酶;B:T2-Cu缺失型漆酶。
3 真菌漆酶的反应机理
真菌漆酶的催化机理是利用自身与底物的氧化还原电势差将底物氧化。漆酶分子中的T1-Cu从底物中夺取电子,由Cu2+转变为Cu+,电子再经由保守的His-Cys-His三肽结构,传递给T2-Cu、T3-Cu三核铜离子中心,最终分子氧在该中心转化为水[27-29]。以云芝(T.versicolor)漆酶为例,其活性中心结构由1个T2-Cu、2个T3-Cu构成的三核铜离子中心(trinuclear cluster, TNC)和T1-Cu构成的单核中心组成,主要负责底物的氧化以及氧化过程产生的电子向TNC方向传递(图2A)[30-31]。4个铜离子共与10个His残基相连,其中三核铜离子中心共与8个His残基相连,T3-Cu与6个His相连,T2-Cu与2个His残基相连,剩余2个His残基则与T1-Cu相连,T1-Cu构成的单核中心通常靠近漆酶表面,使其更易与底物结合,将底物从还原态氧化为氧化态,同时向内嵌在漆酶结构凹陷处的TNC释放4个电子,在TNC内部,4个电子被传递给氧分子,形成2分子H2O(图2B)[27-28]。由于T1-Cu承担从底物中夺取电子的功能,其氧化还原电势高低直接影响着漆酶氧化能力的强弱[28,32]。
4 漆酶/介体系统(LMS)
4.1 定义及作用特点
漆酶对于底物的氧化是一种选择性反应,只有能进入漆酶活性中心并且与漆酶存在一定氧化还原电势差的底物才能被氧化[31-33]。单一漆酶介导的底物氧化流程见图3A。漆酶的氧化还原电位为0.5~0.8 V[相对于标准氢电极(normal hydrogen electrode, NHE)],低于木素过氧化物酶(>1 V, 相对于NHE),而漆酶的典型底物酚类化合物氧化还原电位为0.5~1.0 V(相对于NHE),足以让漆酶的T1-Cu中心获得电子,因而最初认为只能氧化木质素含量占20%以下的酚类底物[15,34]。具有高氧化还原电位的非酚类底物不能被漆酶直接氧化,因此为了拓展能够被氧化的底物范围,漆酶需要介质的帮助。
介体(mediator)是一类低氧化还原电势的小分子化合物,容易得失电子,在漆酶作用下形成高氧化还原电势的稳定中间体,并作用于底物使其被氧化[15,31,35]。1990年,Bourbonnais和Paice[36]首次报道,人工合成的小分子化合物2,2-联氨-二(3-乙基-苯并噻唑-6-磺酸)[2,2′-azino-bis-(3-ethylbenzothiazoline-6 sulphonic acid), ABTS]能够增强云芝(T.versicolor)降解木质素的能力。此后,对漆酶与这些小分子化合物在木质素降解和纸浆生物漂白方面开展了广泛的研究。漆酶与这些介体构成的系统称为漆酶/介体系统(LMS),能够实现对高氧化还原电势或不能进入漆酶活性中心的底物分子的快速降解,拓展了漆酶降解底物的范围;同时介体的存在还能够提高漆酶的催化效率和稳定性,因而近年来被广泛用于漆酶的应用研究[37]。LMS催化底物氧化的流程见图3B。
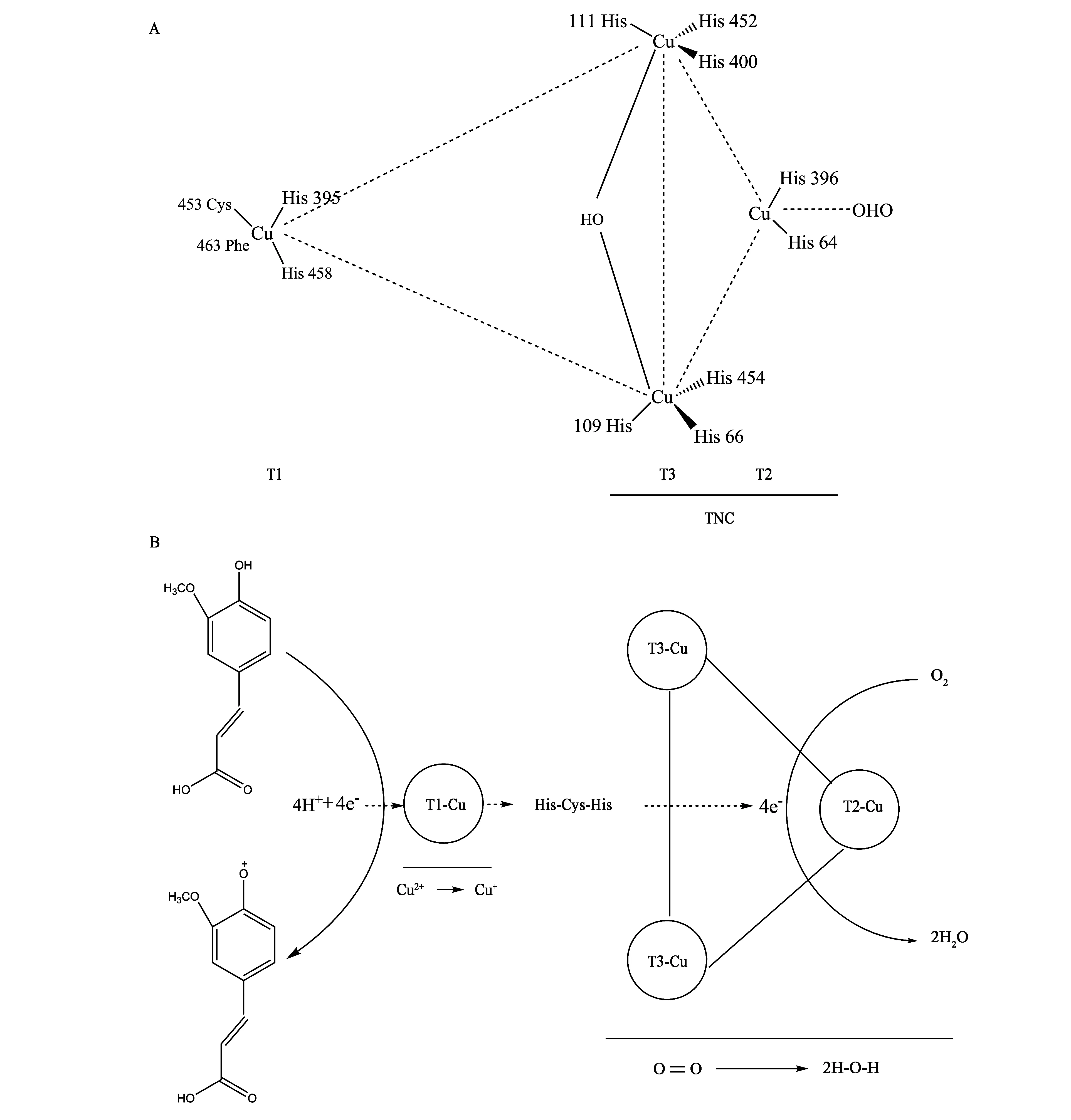
图2 云芝漆酶活性中心结构(A)[19,30-31]及其氧化松柏醇的反应机理(B)[27-28]
4.2 介体类型
迄今为止,已有超过100种漆酶介体被报道[7]。根据其来源,常见介体主要分为两大类,即天然介体(natural mediators)和合成介体(synthetic mediators)[7,38]。天然介体有乙酰丁香酮(acetosyringone,AS)、乙酰香草酮(acetovanillone)、肉桂酸(cinnamic acid)、邻苯二酚(catechol)、针叶醇(coniferyl alcohol)、2,6-二甲基苯酚(2,6-dimethylphenol)、乙基香兰素(ethyl vanillin)、阿魏酸(ferulic acid)、没食子酸(gallic acid)、3-羟基邻氨基苯甲酸(3-hydroxyanthranilic acid)、4-羟基苯甲酸(4-hydroxybenzoic acid)、对香豆酸(p-coumaric acid,p-PCA)、芥子酸(sinapic acid)、丁香醛(syringaldehyde, SA)、丁香酸(syringic acid)、2,4,6-三甲基苯酚(2,4,6-trimethylphenol)、香草醛(vanillin)、香草酰醇(vanillyl alcohol)等。合成介体有ABTS、N-羟基-N-乙酰基苯胺(N-hydroxyacetanilide, NHA)、1-羟基苯并三唑(1-hydroxybenzotriazole, HBT)、N-羟基邻苯二甲酰亚胺(N-hydroxyphthalimide, HPI)、酚红(phenol red)、2,2′,6,6′-四甲基呱啶氧化物(2,2′,6,6′-tetramethyl-piperidine-N-oxyl, TEMPO)、1-(3′-磺苯基)-3-甲基吡唑啉酮-5[1-(3′-sulphophenyl)-3-methylpyrazolone-5, SPP-m]、紫脲酸(violuric acid, VA)等[7]。另外,一些多金属氧酸盐(polyoxometalates,POM)具有氧化还原和催化的双功能,被作为漆酶介体用于辅助降解木质素和染料脱色[39]。笔者认为,介体也可以根据其主要结构的复杂程度划分为单苯环介体和多环或杂环介体。单苯环介体多为酚类的衍生醛、酮、酸等,如香草醛、丁香醛、芥子酸、乙酰丁香酮、乙酰香草酮和阿魏酸等。多环或杂环介体多为含氮、硫的杂环化合物,如ABTS、HBT、NHA、TEMPO、VA等。
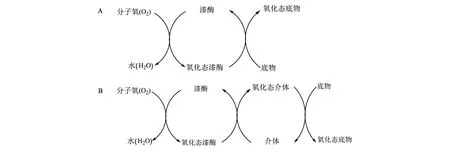
A: 无介体; B: 有介体。
理想的漆酶介质同时必须是一种良好的漆酶底物,其氧化还原形式必须稳定、且不能抑制酶的活性,其氧化还原态转换必须是可循环的[40-41]。另外,介体价格应相对便宜且环境友好[39,42]。最初人们发现ABTS、HBT等杂环类介体与漆酶构成的LMS对木质素等多种底物具有良好的降解效果,但杂环和多环介体给环境造成了负担,且对漆酶活性也有一定的影响[43~45]。而单苯环介体中多数是天然型介体,如乙酰丁香酮和丁香醛,最早在丁香的花瓣中和汁液中被发现,与人工合成的杂环或多环介体相比,具有来源清洁、价格低廉、低毒环保等特点。目前漆酶的天然介体日益受到人们的关注[39]。
4.3 LMS的作用机理
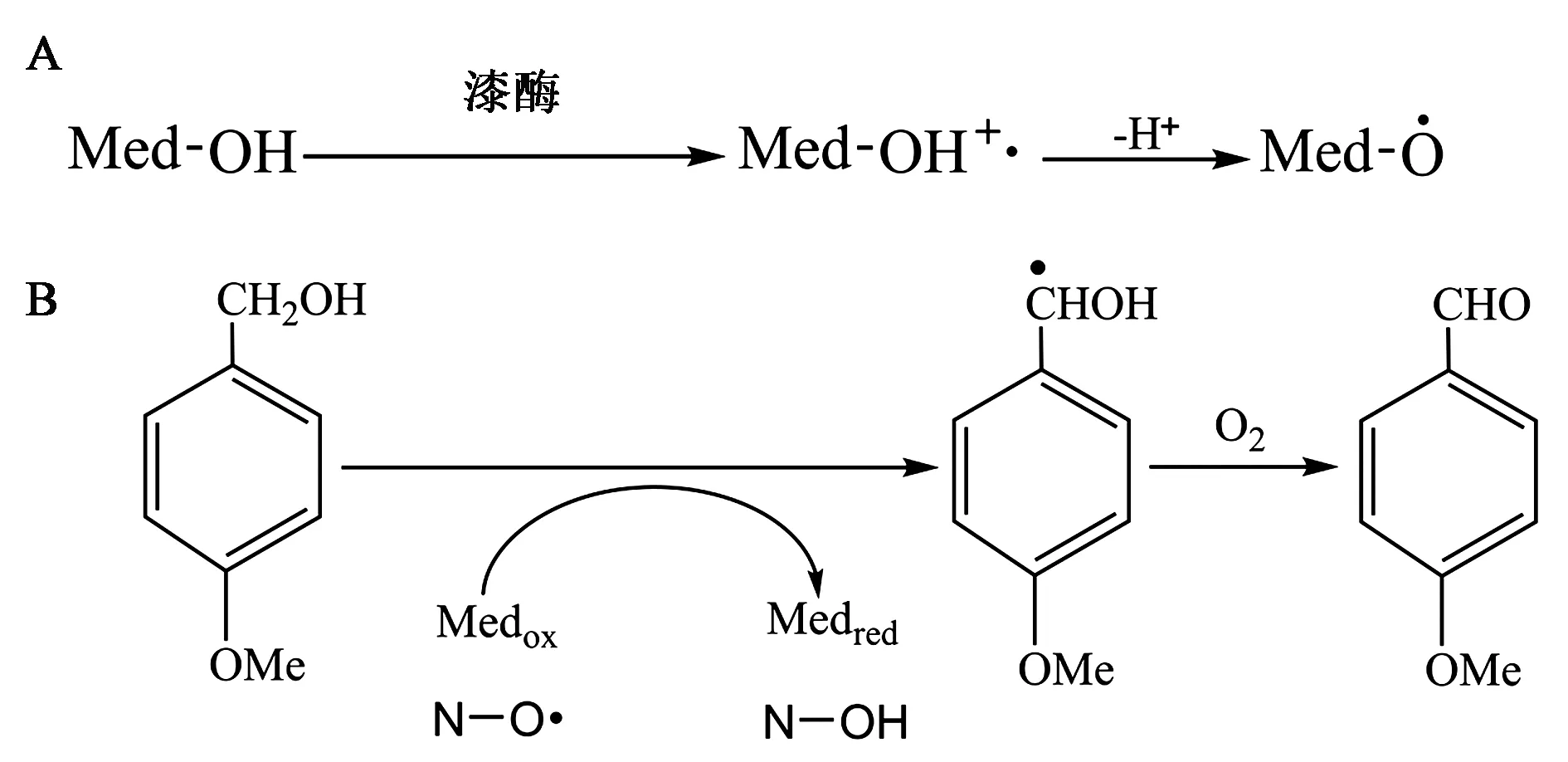
目前研究较为清晰的LMS作用机理有2大类,包括电子转移(electron transfer, ET)途径和自由基转移(radical transfer, RT)途径[34,38,40,46-47]。其中,自由基转移途径类型又可以分为氢原子转移(hydrogen atom transfer, HAT)和离子机制(ionic mechanism, IM)途径,二者催化底物氧化的功能基团分别为氮氧自由基(N-oxyl radicals, >N-O·)和氧合铵离子(Oxo-ammonium ion, >N=O+)[39]。电子转移型介体如ABTS;HAT型介体结构中往往含有氮羟基(>N-OH)单元,如HBT、HPI、VA、HAA等;IM型介体结构中含有氮氧自由基(>N-O·)单元,如TEMPO(图4)。
以ABTS为介体的LMS最早被发现,其作用机制属于电子转移机制[47-48]。漆酶介导的ABTS氧化经过两个阶段,首先形成ABTS+·阳离子自由基,进而被缓慢氧化成ABTS2+(图5A)[40,47]。以Ag/AgCl电极作参照的电化学研究表明,ABTS/ABTS+·和ABTS+·/ABTS2+的氧化还原电势分别为0.472 V和0.885 V[48]。前人对云芝(T.versicolor)、嗜热毁丝霉(Myceliophthorathermophila)漆酶研究发现,其T1-Cu中心的氧化还原电势分别为0.585 V和0.3~0.4 V(以Ag/AgCl电作参照)[41]。因而,具有更高还原电势的ABTS2+(而不是ABTS+·)在漆酶-ABTS系统中承担着更重要的功能,介导非酚木质素底物的氧化(图5B)[40, 49-51]。

图4 >N-OH和>N-O 型漆酶介体结构[40]
在HAT途径中,LMS介导的非酚木质素底物氧化,更倾向于利用自由基氢原子转移(radical H-atom transfer)[47]。由长绒毛栓菌(Trametesvillosa)和HBT构成的LMS中,漆酶先将HBT氧化形成HBT+·自由基形式,再进一步去质子化产生氮氧自由基(N-O·),后者催化非酚木质素底物苄基脱氢生成醛和HBT再生(图6)[47,50]。另外,该途径中底物氧化还原电位与反应的相关性较低,主要取决于反应体系的pH[47]。IM途径与HAT途径类似,但催化底物氧化的介体活性形式是氧合铵离子(>N=O+)[34,47]。漆酶氧化TEMPO生成离子型TEMPO(>N=O+)(图7A),其活化的氧合铵离子氧化非酚类底物苄基生成醛/酮,而自身被还原成还原型TEMPO(>N-OH),然后漆酶再将还原型TEMPO依次氧化为自由基型TEMPO(>N-O·)和离子型TEMPO(图7B)[40,47]。
5 LMS的应用
5.1 造纸领域
造纸行业具有产量大、用水多、污染严重的特点。生物酶技术在造纸行业改造升级中发挥着重要的作用。LMS最初的发现正是源于利用云芝漆酶和ABTS降解木质素,此后被广泛研究并应用于造纸行业[18]。LMS可以降低制浆过程中木质素含量,去除胶黏物,改善纸浆性能[52-54];在漂白过程中,酶法漂白替代传统化学漂白,能够提高漂白亮度,降低环境污染[55-56];LMS用于造纸废水的处理,可以显著降低废水中的木质素含量、色度与化学需氧量值(chemical oxygen demand, COD)[57]。

A: ABTS。B:氧化途径 Medox—氧化型介体; Medred—还原型介体
A: 介体; B: 氧化途径 Med—介体; Medox—氧化型介体; Medred—还原型介体
利用长绒毛栓菌(T.villosa)漆酶-VA系统,处理由60%欧洲云杉(Piceaabis)和40%樟子松(Pinussylvestri)制备的未漂白纸浆,能够获得62%纤维素、90%漂白度的高品质纸浆,完全能够达到商品化的需要,并且较之传统化学脱色方法,节约了约2 h和70%的过氧化氢消耗[52]。长绒毛栓菌(T.villosa)漆酶与1-亚硝基-2-萘酚-3,6-二磺酸(NNDS)构成的介体体系能够对蓝桉(Eucalyptusglobulus)纸浆实现高效脱木质素[58]。另外,利用长绒毛栓菌(T.villosa)漆酶介体系统处理剑麻(Agavesisalana)纸浆的比较研究中,对羟基肉桂酸、阿魏酸、松柏醛、芥子醛4种天然介体在促进纸浆漂白方面不如合成HBT有效,但它们倾向于与纸浆纤维结合从而改善纸浆特性,可用于功能化纤维应用[53]。张勇兵等[59]报道,利用漆酶-ABTS系统处理纤维后,黄麻纤维中木质素分子量减小,酚羟基、醇羟基以及甲氧基含量降低,羰基含量增加。利用朱红密孔菌(Pycnoporuscinnabarinus)与5种天然介体(AS、SA、对-香豆素酸、香兰素和乙酰苯胺)处理中国红麻(Hibiscuscannabinus)纸浆研究发现,所有天然介体均能够提高纸浆的卡帕值(kappa number)、降低亮度、改善纸浆性质,其中AS和SA的脱木素和漂白效果最好,而另3种天然介体可用于红麻功能化,以获得性能新颖的纸浆[55]。以AS、SA和对香豆素3种植物酚作为朱红密孔菌(P.cinnabarinus)漆酶介体处理未漂白的蓝桉(E.globulus)纸浆的研究表明,对香豆素酸只引起纸浆白度的轻微增加,卡帕值变化不显著;而使用AS或SA作为介质使最终白度和卡帕值均提高15%以上,且处理后残留木质素组分也得到优化[56]。裂褶菌(Schizophyllumcommune)漆酶与HBT构成的介体系统对造纸废水的研究中,当酶用量40 U·mL-1、HBT用量6 mg·L-1、50 ℃、pH 5.5处理4 h后,废水中木质素、色度与COD值的降解率分别达到了77.5%、81.1% 与61.1%[57]。

A: TEMPO; B: IM型非酚底物氧化途径。
5.2 纺织领域
纺织行业染料消费量已占全球染料市场总量的三分之二,并且以每年3.5%的速度增长。随着现代工业的快速发展,用在纺织及印染行业的染料在多种工艺上得到改善,增加了染料的溶解性以及漂染后的稳定性的同时,也增加了环境治理的难度[35]。由于印染废水成分复杂、色度高、COD高、有毒物质多,是国内外公认较难处理的工业废水之一[60]。漆酶能有效降解木质素的原因在于它可以氧化木质素的酚类结构,使酚类结构形成不稳定的氧化态,然后进行重排、转化等反应最终达到降解的目的,而用于纺织业的多种染料的主要结构也是酚类结构,因此漆酶对于染料废水的降解有着良好的应用前景。但印染废水中的染料组分十分复杂,多数是酚类的多重衍生物,在酚类结构的基础上还有偶氮、杂环等结构,这使得其氧化还原电势远远高于漆酶而无法被降解,因而相应介体的引入使得这些顽固污染物被降解成为可能[39]。
Salami等[61]利用嗜热毁丝霉(M.thermophila)漆酶对纺织废水中常见的酸橙156、酸性红52、考马斯亮蓝、甲基紫、孔雀石绿等5种染料进行降解处理6 h,漆酶-HBT系统对于5种染料的降解率达到了82%~96%,是同条件下纯漆酶组的2倍;漆酶-AS系统对酸橙156等4种染料的降解率为97%~100%,其中对于孔雀石绿降解率为100%,对甲基紫降解率为79%。栓菌Trametessp. F1635漆酶与AS、HBT等4种介体组成的LMS对铬黑T、伊文思蓝、甲基橙等8种染料的降解实验显示,VA是降解伊文思蓝、碱性品红、亮蓝、甲基橙、甲基蓝的最适介体,降解率为85.6%~95.2%,AS和TEMPO也有很好的促降解效果,而HBT则无显著促进作用[62]。而另一方面,利用粗毛栓菌(T.trogii)漆酶介体系统对碱性纺织工业染料废水脱色脱毒实验则显示,HBT是其最适介体,8 h脱色率能达到50%[63]。因此,利用LMS处理纺织废水时,应根据不同染料废水、漆酶类型筛选适宜的介体类型和工作条件(浓度、温度、pH等)。
5.3 环保领域
随着工农业的飞速发展,环境污染问题日益严重,化工废弃物、农药残留、抗生素残留等严重威胁着人类健康和环境安全。这些环境污染物如多环芳烃、有机磷农药、磺胺类抗生素等,往往是含苯环或杂环化合物,LMS对这些污染物降解与脱毒具有良好的应用价值[38]。
粗毛革孔菌(Coriolopsisgallica)介体系统对10种多环芳烃的降解研究表明,ABTS和HBT是蒽(anthracene)降解的最适介体,漆酶5U、ABTS和HBT均为1 mmol·L-1条件下,20 μmol·L-1的蒽在10 min内被完全降解,只有ABTS单一介体时需要9 h才能完全降解,而只有HBT存在时9 h降解80%[64]。云芝(T.versicolor)漆酶介体系统对毒死蜱(chlorpyrifos)、百菌清(chlorothalonil)、嘧霉胺(pyrimethanil)、莠去津(atrazine)、异丙隆(isoproturon)等5种农药降解研究表明,VA是嘧霉胺和异丙隆降解的最适介体,香草醛是毒死蜱降解的最适介体,AS和HBT是百菌清和莠去津降解的最适介体。VA介导的嘧霉胺和异丙隆在24 h降解率接近100%,而其他3种农药需要8 d降解率达到90%[65]。粗毛革孔菌(C.gallica)漆酶与9种介体构成的体系对12种有机卤化农药的降解研究表明,AS和SA是最佳介体,对溴苯腈、氯硝柳胺、溴芬肟和二氯酚等卤化农药降解效率分别达到48.8%、142.0%、166.2%和1 257.6 nmol·min-1·U-1[66]。多年卧孔菌Perenniporiastrain TFRI 707漆酶介体系统对2种磺胺类药物磺胺二甲氧嘧啶(SDM)和磺胺单甲氧嘧啶(SMM)降解研究表明,其最适介体为ABTS和丁香醛。漆酶-ABTS系统最适条件为pH 4、50~60℃、介体浓度1 mmol·L-1;漆酶-丁香醛系统最适条件为pH 6、50℃、介体浓度2 mmol·L-1;而以HBT和VA为介体的降解产物较之ABTS和丁香醛更低[67]。另外,云芝(T.versicolor)漆酶与ABTS或HBT构成的介体系统对避蚊胺(N,N-diethyl-m-toluamide, DEET)的去除作用达到50%以上[68]。
6 展望
漆酶是极具应用前景的多功能酶,对木质素及其衍生物、多种染料、有机磷化合物、磺胺类化合物都有良好的降解作用。漆酶与小分子介体构成的LMS进一步提高了漆酶的作用底物范围、酶的催化效率与稳定性,为这一研究历史悠久的催化酶赋予了更加重要的生态价值和应用价值。与此同时,白腐真菌较之细菌生长速率慢,酶活水平偏低、重组酶催化效率低,漆酶大规模工业化生产方面的报道较少。可以预见,新型高效真菌漆酶的挖掘、基于分子生物学手段高产漆酶工程菌株的构建、高效低毒天然介体的筛选、漆酶固定化、环境污染物降解等将是今后真菌漆酶研究与应用的重要方向。
