超声波处理对水溶性猪肝蛋白乳化特性的影响
2020-02-27康梦瑶丁景鲁小川李懿璇尚永彪
康梦瑶,丁景,鲁小川,李懿璇,尚永彪,2,3*
1(西南大学 食品科学学院,重庆,400715) 2(农业部农产品贮藏保鲜质量安全评估实验室(重庆),重庆,400715)3(重庆市特色食品工程技术研究中心,重庆,400715)
猪肝是生猪屠宰的主要副产品之一,其蛋白含量丰富且脂质含量甚少,必需氨基酸占比高,不仅可以改善营养性贫血,还能调节和改善正常机体血液系统,其食疗效果是其他肉类产品无法替代的[1-2]。但由于猪肝腥味重、味苦、切片性差和易褐变等特点使得其在食品工业中没有得到合理的利用[3]。目前国内外研究对大豆蛋白、乳清蛋白等乳化特性及其改性方法研究较多,对猪肝蛋白的研究相对较少,且主要集中在产品研发[4-5]和活性成分研究[6-7]上。猪肝蛋白中水溶性蛋白不仅含量多,而且具有良好的乳化性,商业利用和开发价值较高,但关于水溶性猪肝蛋白乳化特性缺乏较为系统的研究。
超声波作为常用的物理处理手段,具有效率高、成本低、安全性能好等优势[8],且有研究表明超声波能通过改变蛋白质的次级结构而改善其功能性质[9]。HU等[10]发现超声波能通过改变肌原纤维蛋白的结构而改善鱿鱼的嫩度。NAZARI等[11]发现超声处理可有效改善小米浓缩蛋白的乳化性质。本文以新鲜猪肝为原料,提取水溶性蛋白经超声波处理后,考察相关功能性质指标的变化、探讨其变化的机理,为猪肝的开发利用和水溶性猪肝蛋白在乳化型肉制品中的应用及猪肝资源的深度开发提供理论基础和应用依据。
1 材料与方法
1.1 材料与试剂
猪肝(猪屠宰后3 h内),北碚天生农贸市场,装在冰鲜保鲜盒中在20 min内运回实验室,去除脂肪和结缔组织,绞碎后置于小烧杯中,保鲜膜封口后于4 ℃贮藏备用,其他试剂均为分析纯。
1.2 仪器与设备
Avanti J-10高速冷冻离心机,美国贝克曼库尔特公司;XHF-D 内切式匀浆机,宁波新芝生物科技股份有限公司;ZEN 3690 马尔文激光粒度分析仪,英国马尔文仪器公司;FD-1-50 真空冷冻干燥机,北京博医康实验仪器有限公司;Power Pac Basic 小型垂直电泳仪,美国Bio-Rad 公司;722-P可见分光光度计,上海现科仪器有限公司。
1.3 方法
1.3.1 水溶性猪肝蛋白的提取
参照NUCKLES等[12]和LISELOT等[13]的方法并修改。取一定量的碎猪肝加入4倍体积0.05 mol/L磷酸缓冲溶液(pH 7.4),高速匀浆60 s充分混匀,离心(9 327×g,30 min)后取上清液,沉淀继续上述操作3次,将所有上清液用透析袋透析脱盐,冻干后备用。
1.3.2 实验设计
称取一定量的水溶性猪肝蛋白粉,用磷酸盐缓冲溶液配制成2.5 mg/mL 的蛋白溶液,将试样分别在0(对照组)、300、360、420、480、540 W条件下超声波处理7 min,然后进行乳化特性及相关指标的测定;将试样在420 W超声处理4、7、10、13、16 min,然后进行乳化特性及相关指标的测定。
1.3.3 乳化活性和乳化稳定性的测定
参照AGYARE等[14]和PEARCE等[15]的方法并修改。取2.0 mL大豆油和6.0 mL上述蛋白溶液于25 mL塑料离心管中,高速匀浆30 s,立即从距管底5 mm处取乳化液50 μL,加入5 mL 0.1% SDS溶液中,混匀后放置10 min,用紫外分光光度计测定其在500 nm处的吸光值A0。匀浆液静置10 min后,按照上述同样方法测定其吸光值A10,空白用0.1% SDS溶液代替,按公式(1)、(2)计算其乳化活性(emulsifying activity,EAI)和乳化稳定性(emulsification stability)。

(1)
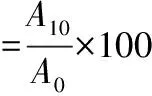
(2)
式中:φ,油相体积分数(油的体积/乳化体系的体积);ρ,蛋白质质量浓度,g/L;A0、A10,乳化液在0、10 min时的吸光值;稀释倍数,101。
1.3.4 乳析指数的测定
参照SOLEIMANPOUR等[19]方法测定。
1.3.5 表面张力的测定
在25 ℃条件下用表面张力仪进行测定。
1.3.6 乳液液滴粒径大小及分布的测定
参照崔珊珊[17]的方法测定,用水作为分散剂。
1.3.7 蛋白吸附量的测定
参考PALAZOLO等[18]的方法并修改。按1.3.2将乳液配制好后立即倒入50 mL离心管中,室温离心(10 000×g)30 min。取上清液测定其蛋白浓度,按公式(3)计算其蛋白吸附量。

(3)
式中:C2,蛋白溶液的浓度;C1,乳液离心后清液中的蛋白浓度;C0,蛋白溶液经相同条件离心后上清液中的蛋白浓度。
1.3.8 界面蛋白组成的测定
参照XIONG等[19]的方法测定,取1.3.7中离心分离出的蛋白溶液进行电泳样品的制备。
1.3.9 乳化液的光学显微镜观察
从均质的乳化体系(水溶液猪肝蛋白-大豆油)底部取10 μL乳液滴在载玻片上,用盖玻片盖紧后,置于光学显微镜下,在10倍目镜、40倍物镜的视野条件下观察并拍照。
1.3.10 乳化液分子作用力的测定
参照MONTERO等[20]并修改。称取1.0 g乳化样品,分别加入10 mL的0.05 mol/L NaCl(SA);0.6 mol/L NaCl(SB);0.6 mol/L NaCl+1.5 mol/L尿素(SC);0.6 mol/L NaCl+8 mol/L尿素(SD);0.6 mol/L NaCl+8 mol/L尿素+0.5 mol/L β-巯基乙醇(SE)。均质后4 ℃静止1 h,离心(7 100×g,4 ℃,15 min)后用双缩脲法测定上清液中蛋白质的含量来确定非特异性交联(溶于试剂A的蛋白),离子键(溶于试剂B的蛋白),氢键(溶于试剂C的蛋白),疏水相互作用力(溶于试剂D的蛋白),二硫键(溶于试剂E的蛋白)。结果以1 L均质液中可溶解的蛋白质质量表示(g)。
1.3.11 数据处理
每个样品重复3次,用Excel处理数据,SPSS Statistics 20.0软件进行单因素方差分析,Origin 8.5绘图,结果以平均值±标准差(X±SD)形式表示。
2 结果与分析
2.1 超声波处理对水溶性猪肝蛋白乳化特性的影响
2.1.1 超声波处理对水溶性猪肝蛋白乳化性和乳化稳定性的影响
超声波功率对水溶性猪肝蛋白乳化活性和乳化稳定性的影响如图1所示,随着超声波功率的升高,水溶性猪肝蛋白的乳化活性和乳化稳定性变化趋势是一致的,均呈先增加后减小的趋势。对照组的乳化活性和乳化稳定性最小,分别为31.41 m2/g和75.84%。在超声功率为420 W时,EAI值和ESI值均最大,分别为45.55 m2/g和93.32%,与对照组有显著性差异,说明超声波处理可以明显改善水溶性猪肝蛋白的乳化活性和乳化稳定性。
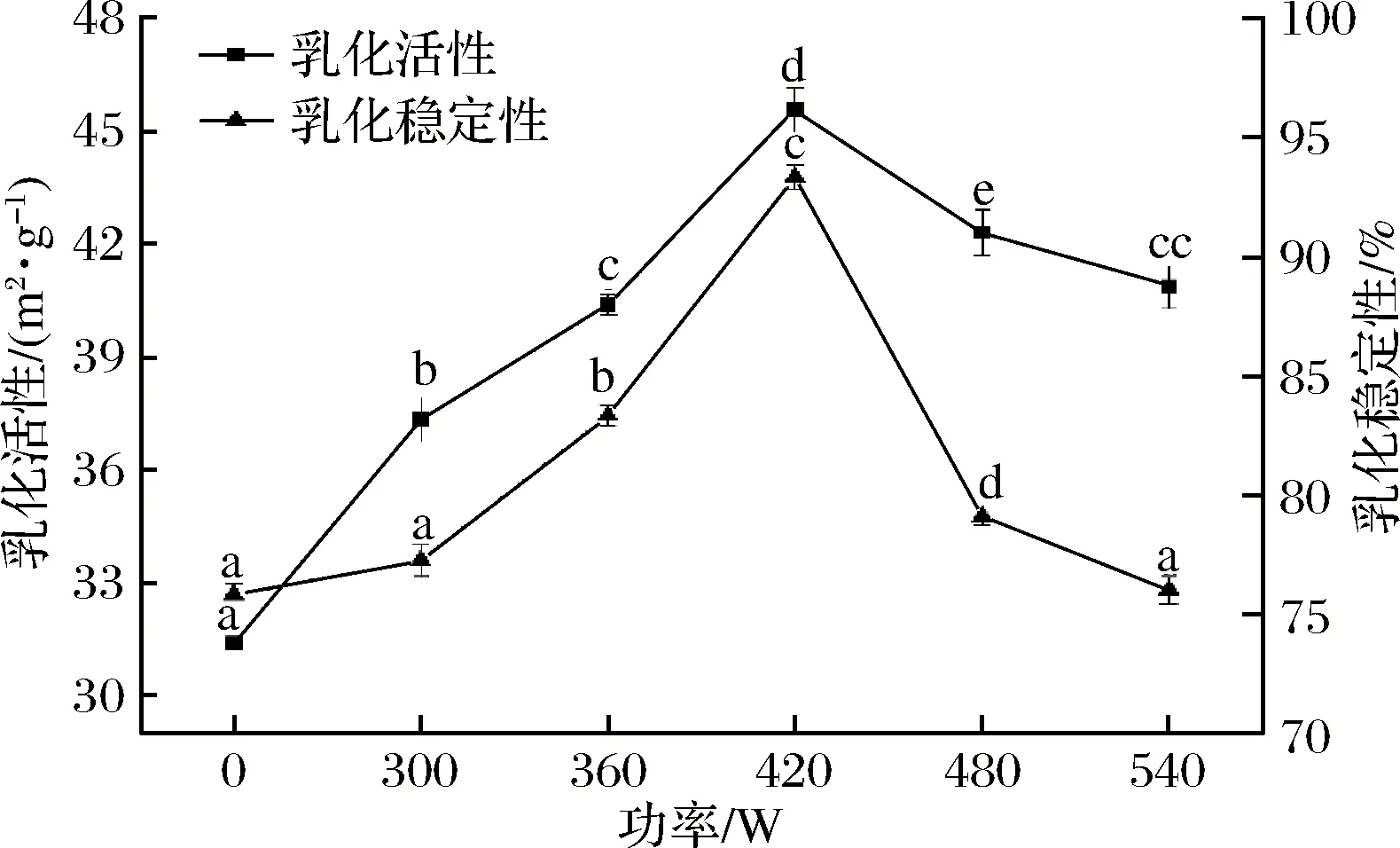
图1 超声波功率对水溶性猪肝蛋白乳化性和乳化稳定性的影响Fig.1 Effect of ultrasonic power on emulsification andemulsion stability of pig liver water-soluble protein
超声波处理时间对水溶性猪肝蛋白乳化性和乳化稳定性的影响如图2所示。随着超声波处理时间延长,猪肝蛋白乳化性和乳化稳定性逐渐增加,在7 min时达到最大值,分别为43.54 m2/g和86.64%,超过7 min后,乳化性和乳化稳定性明显减小。有研究证明蛋白质的乳化性与其溶解度呈正相关关系,溶解度越大,蛋白质乳化性越高[21]。可能是因为超声波处理的空化效应使蛋白质的结构发生变化,蛋白分子展开形成非共价键分子,与水的结合能力增强,溶解度增加。当超声功率超过420 W或超声时间超过7 min时,乳化性和乳化稳定性不断减小,这可能是蛋白质在过高功率或过长超声时间处理时,蛋白质变性程度增加,凝集程度加剧,分子表面亲水性基团大量减少,导致溶解度降低,蛋白乳化性减小。
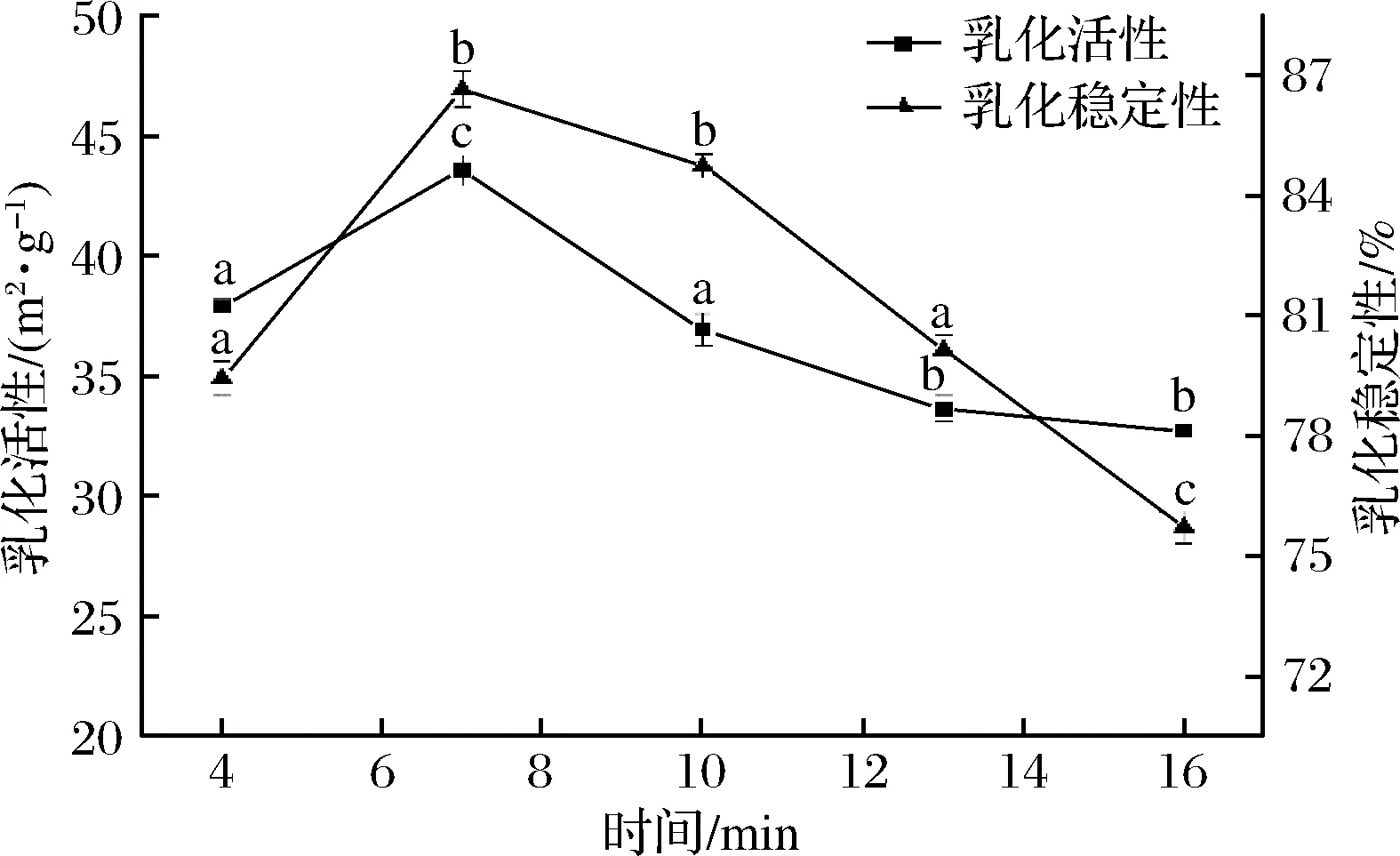
图2 超声波时间对水溶性猪肝蛋白乳化性和乳化稳定性的影响Fig.2 Effect of ultrasonic time on emulsification andemulsion stability of pig liver water-soluble protein
2.1.2 超声波处理对水溶性猪肝蛋白乳化液乳析稳定性的影响
超声波功率对水溶性猪肝蛋白乳化液乳析指数的影响如图3-A所示。经过14 d储藏稳定性观察表明,水溶性猪肝蛋白乳液的分层情况随着时间的变化有所不同。其中未经超声处理的乳化液乳析指数最高,均超过68.5%,说明乳液稳定性最差。但是处理组随着储藏时间延长,不同功率处理得到的乳化液乳析指数均不断增加。在储藏1 d时,乳化液已经出现明显乳析现象,体系失稳,乳析指数均大于50%,且在300~420 W 范围内,随着功率增大,乳析指数逐渐减小,说明蛋白超声波处理有利于乳化液的稳定性。对照组和低功率300 W组乳液具有较弱稳定性,原因可能是在油滴表面形成不完整和不稳定的界面膜,水溶性蛋白并没有完全展开形成可以包裹油滴的结构,使乳液液滴发生絮凝和变形。而适当超声处理后水溶性蛋白更容易吸附于油滴界面,可以增加乳液界面蛋白膜强度,而且超声空化效应使蛋白内部结构暴露,可以通过空间位阻作用为乳液液滴提供足够的排斥力,抑制液滴之间的相互作用,降低乳析现象发生[22]。

A-不同功率;B-不同超声时间图3 超声波处理对水溶性猪肝蛋白乳化液乳析指数的影响Fig.3 Effects of ultrasonic treatment on the creamingindex of pork liver water-soluble protein emulsion
超声波处理时间对水溶性猪肝蛋白乳化液乳析指数的影响如图3-B所示。超声波处理时间对乳化液的乳析指数影响明显,储藏时间相同时,超声处理时间不同,乳析指数不同。乳化液放置1 d后就会出现明显乳析现象,各处理组的乳析指数均在50%以上,且随着储藏时间延长,不同组乳化液乳析指数均呈现上升趋势,静置7 d后乳析指数体系维持稳定。乳化液在同一放置天数,超声时间为7 min时,乳析指数最低,表示乳化稳定性最佳,与2.1.1结论一致。原因是适当时间的超声波处理后产生的空化效应使原有的分子结构遭到破坏,从而变得疏松,疏水性基团暴露在外面,蛋白更容易分散在水中,使猪肝蛋白最大限度地溶解,改善乳化液的稳定性,抑制液滴的变形和聚结。当超声波处理时间超过7 min时,蛋白微粒间可能因为静电作用发生聚集,一部分暴露的疏水性基团被包埋,导致液滴发生失稳现象,从而使乳析指数增加。
2.2 超声波处理对水溶性猪肝蛋白乳化特性影响的机理
2.2.1 表面张力的变化
界面行为对乳状液的制备和稳定性有着重要的意义,乳化液的界面张力越小,稳定性越好[23]。水溶性猪肝蛋白乳液的乳化特性通过测定乳液的表面张力进行表征。蛋白质吸附在乳液的油水界面上,能迅速降低表面张力,从而增加乳液的稳定性阻止液滴的聚集。超声波处理对乳化液表面张力的影响实验结果如图4所示。
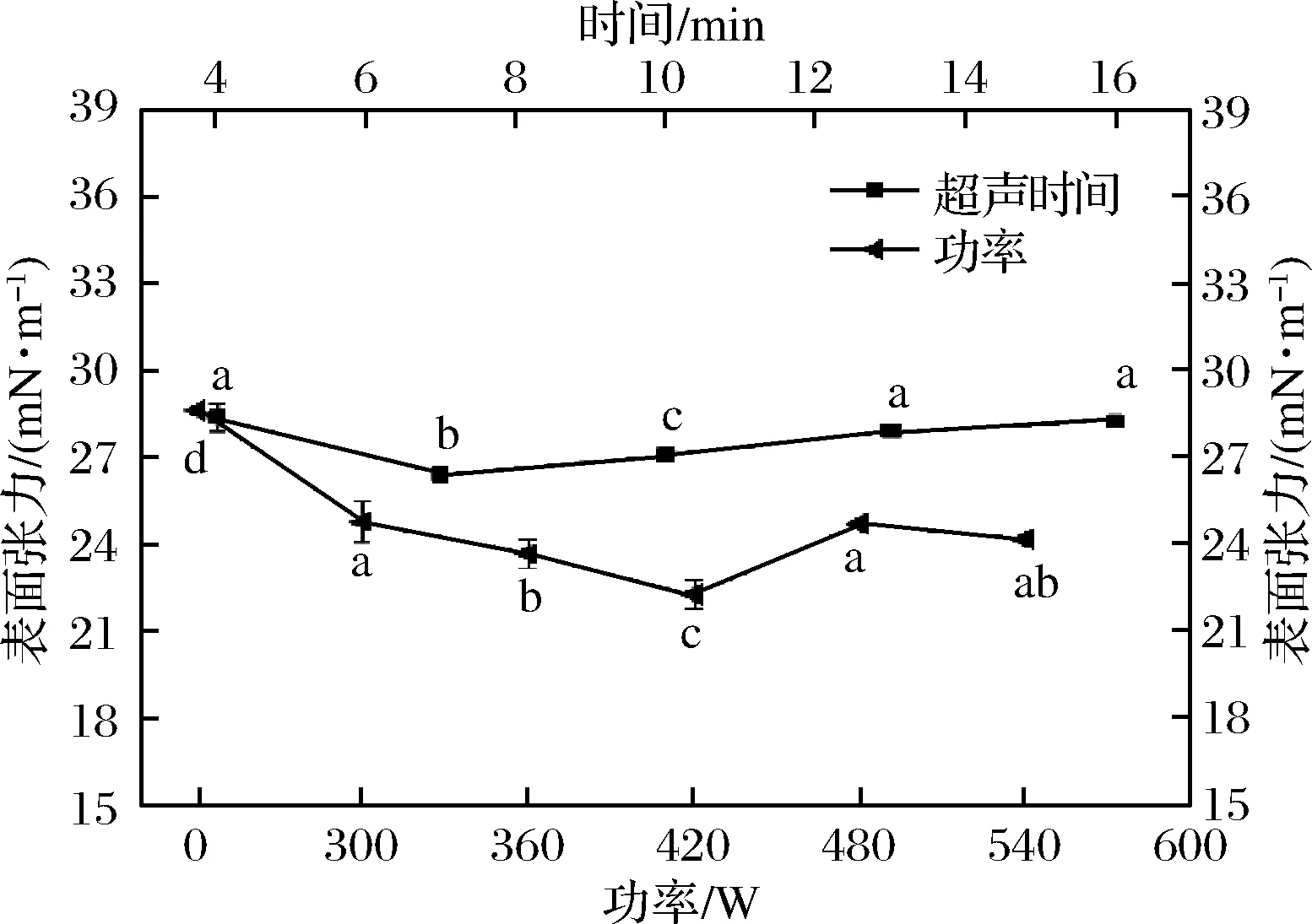
图4 超声波处理对水溶性猪肝蛋白乳化液界面蛋白吸附量的影响Fig.4 Effects of ultrasonic treatment on the interfacialprotein content of pork liver water-soluble protein emulsion
由图4可知,对照组乳液的表面张力为28.63 mN/m,明显高于处理组,证明超声处理可以降低乳液的表面张力、增强蛋白质在油滴表面的吸附性,从而改善乳液的乳化稳定性。随着超声功率的增加,样品的界面张力值先减小后有所回升,在420 W时达到最小值21.65 mN/m。可能是因为适当超声处理后,蛋白质性质发生变化,导致蛋白质在油水界面具有较高的吸附力,界面张力较小。当功率过大后,界面蛋白质发生自聚行为,造成蛋白质在油水界面伸展能力减小,乳液的表面张力就会变大。
超声处理时间对乳液的界面张力也会产生一定程度的影响(图4)。随着超声处理时间的延长,猪肝蛋白乳液的表面张力先减小后增加,在7 min时表面张力值最小为26.42 mN/m,13 min后表面张力值趋于平缓,接近对照样。原因可能是超声处理后水溶性猪肝蛋白结构发生变化,亲水性基团暴露,提高了蛋白质在油-水界面的吸附力,降低表面张力。而当处理时间过长后,蛋白质变性程度增加,降低了蛋白质与水结合的能力,导致表面张力增加。
2.2.2 界面蛋白组成
超声处理的乳液界面蛋白SDS-PAGE电泳图谱如图5所示,该结果与CHAN等[24]的肌浆蛋白图谱相似。
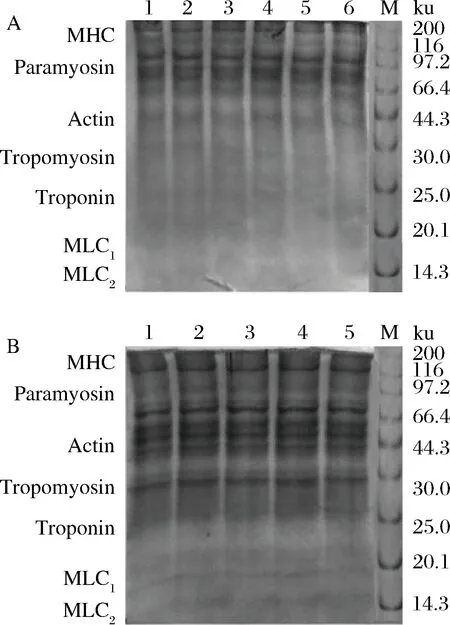
泳道M-marker;图A泳道1-6-超声波功率分别为0、300、360、420、480、540 W;图B泳道1-5:超声波时间分别为4、7、10、13、16 min;MHC-肌球蛋白重链;Actin-肌动蛋白图5 不同超声波处理蛋白稳定的乳液中吸附蛋白电泳图Fig.5 Electrophoretogram of adsorbed proteins inemulsions stabilized by proteins after treatment of differentultrasonic treatment
由图5-A可以看出,与泳道1对照样的界面蛋白相比,经不同超声波强度处理的界面水溶性猪肝蛋白条带分布没有明显变化,说明不同超声强度处理对吸附蛋白的亚基没有显著影响。但超声波改性后电泳图谱较改性前完整且清晰,处于66.4~97.2 kDa间有细小条带出现,这可能是因为超声波改性后提高了界面蛋白的溶解性。泳道4的图谱颜色较其他泳道颜色深,说明界面蛋白含量最高,符合2.1.2的结论。由图5-B可以看出,不同超声时间条件下蛋白的凝胶色谱条带间不存在明显差异。但是与图5-A泳道1未经超声处理的蛋白条带相比,不同超声时间处理的界面水溶性猪肝蛋白在分子量为66.4 kDa附近条带增加。可能是因为超声处理破坏了蛋白间的非共价作用,造成肽键断裂,导致部分蛋白亚基产生不可逆降解。
2.2.3 乳液颗粒粒径大小及分布
由图6可知,对照组粒径大于超声波处理组粒径且有显著性差异。超声波功率在300~420 W范围时,乳化颗粒粒径逐渐减小,乳化体系粒径范围为0.35~0.72 μm,且360和420 W超声波处理之间差异不显著(P>0.05)。功率在420~540 W范围内,水溶性蛋白乳化颗粒粒径呈现增加的趋势且差异性显著(P<0.05),乳化体系粒径范围为0.35~0.54 μm。随着功率变大,粒径随之增加,表明可能有乳液颗粒的小聚体形成。由图6可知,经过超声波处理4~7 min后,乳化液颗粒粒径从0.56 μm降低到0.38 μm,延长超声波处理时间能明显降低D4,3。超声波处理后粒径较小,可能是因为超声波处理过程中的超微束和紊流作用力,以及超声波探头的空化效应。这与JAMBRAK等[25]的研究结论一致:随着超声处理时间的延长,乳化液油滴粒径逐渐增加,可能是因为超长时间的超声处理诱发了乳液颗粒上附着的蛋白间的疏水或静电等非共价作用而形成微小的物理聚集体,致使平均粒径变大。
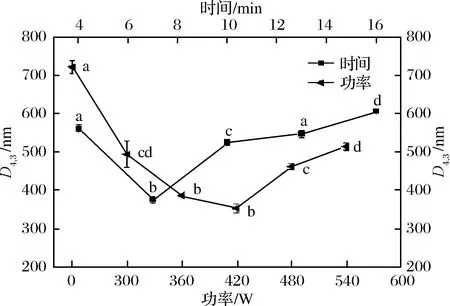
图6 超声波处理对水溶性猪肝蛋白乳化液平均粒径的影响Fig.6 Effects of ultrasonic treatment on the averageparticle size of pork liver water-soluble protein emulsion
由图7-b可知,未经超声处理的乳液粒径分布范围为78~604 nm,经过超声处理后乳液粒径范围变窄,尤其是超声时间为7 min时,乳液粒径分布范围变为91~820 nm,这表明适当的超声处理可以明显影响乳液的粒径范围,使得乳液颗粒粒径范围变窄,分布更加集中,即乳液颗粒大小更加均匀。由图7-a可知,对照组乳液的粒度分布范围最广,符合对照组乳液粒径最小的结论。超声处理组的乳液样品中微粒均呈现三峰分布,包括占主导地位的主峰和从属地位的2个肩峰,当超声功率小于420 W时,随着功率增加,样品粒度分布曲线有向左偏移的趋势且分布越来越集中,说明所有区间内的乳液粒径呈现减小的趋势。在较强的超声物理作用力下,乳液的粒径分布更加密集,原因可能是超声的机械作用力破坏了原有的乳液颗粒粒径分布区间,使得乳液颗粒粒径分布更加集中。
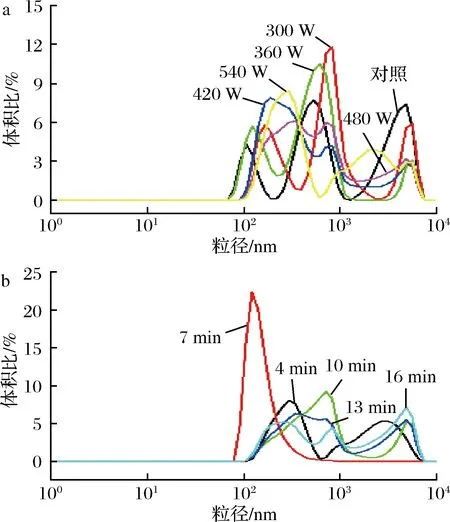
图7 超声波处理对水溶性猪肝蛋白乳化液微粒粒度分布的影响Fig.7 Effects of ultrasonic treatment on droplet sizedistribution of pork liver water-soluble protein emulsion
2.2.4 乳液液滴微观结构观察
由图8可知,对照组乳化液液滴大小不一,分布不均匀,液滴间有轻微聚集现象。经过超声处理后水溶性猪肝蛋白乳化液液滴分布出现明显变化。图8-A超声功率为420 W和图8-B超声时间为7 min时乳化液液滴分散均匀,液滴颗粒较小,液滴间无明显聚集现象,从微观角度说明此条件下乳化液的乳化稳定性较好,这与2.2.3结论一致。当超声功率为480 W和540 W时,液滴之间出现肉眼明显可见的絮凝现象,颗粒明显变大,表明乳液在此条件下出现严重脱稳现象;超声时间为13 min和16 min时,显微镜图中液滴出现轻微聚集现象,说明在此范围内乳化液乳化稳定性较差,这与2.1.2乳液的乳析指数分析结论一致。

图8 超声波时间对水溶性猪肝蛋白乳化体系微观结构的影响Fig.8 Effects of ultrasonic time on micro structure ofpork liver water-soluble protein emulsion
2.2.5 乳化液的分子作用力
乳化液在不同溶剂中的蛋白溶解度表示其破坏某种化学键的能力,结果如表1所示。各组水溶性猪肝蛋白乳化液在试剂A(非特异性交联)、B(离子键)、C(氢键)、D(疏水作用力)、E(二硫键)中的溶解度均较低(<1 g/L),表明5种作用力在乳化液形成过程中作用较小,其中非特异性交联和二硫键的含量与其他作用力相比较高(P<0.05)。
经过超声波处理后,乳化液在溶剂A(非特异性交联)和溶剂B(离子键)中的蛋白质溶解度随着超声功率的升高和超生时间的延长均先降低后基本维持不变。乳化液中的蛋白在溶剂A中的变化可能是因为超声波处理产生的空穴效应导致形成乳化液的水溶性猪肝蛋白部分变性和降解产生蛋白损失,蛋白之间的非特异性交联作用被削弱,蛋白溶解度呈现不同程度的减小。造成离子键变化的原因可能是由于超声波的作用,蛋白质的空间构象发生变化,活性基团被大量包埋或者参与了非二硫共价键的形成,导致离子键数量逐渐减小[26]。由表1可知,离子键并不是维持乳化液稳定的蛋白质网络结构形成的主要贡献。乳化液在溶剂C(氢键)和溶剂D(疏水作用力)中的蛋白质溶解度变化趋向类似,均呈现先增加后减小的趋势。前者可能是因为超声波处理后,蛋白二级结构被破坏,但是蛋白本身具有一定持水性,且链之间形成大量氢键,因此氢键含量有所增加,然而当处理强度增强和时间延长时,超声对氢键的破坏作用占主导,氢键含量有所下降。后者是因为在超声处理之前,大部分疏水基团被包裹在蛋白质分子内部,超声波的空穴效应和微束流作用使这些基团暴露出来,蛋白的疏水作用力增加,当超声达到一定强度和时间后,蛋白质增加的表面疏水性并没有转化成乳液蛋白中的疏水作用力,而又被包裹在蛋白的三维网络结构中。而乳化液在E(二硫键)中的蛋白溶解度先增加后基本维持稳定。这种现象的产生可能是因为超声处理为活性巯基提供更多能量,使其处于高能状态,从而降低了活性巯基转化为二硫键的活化能,促进分子内部的巯基形成二硫键。
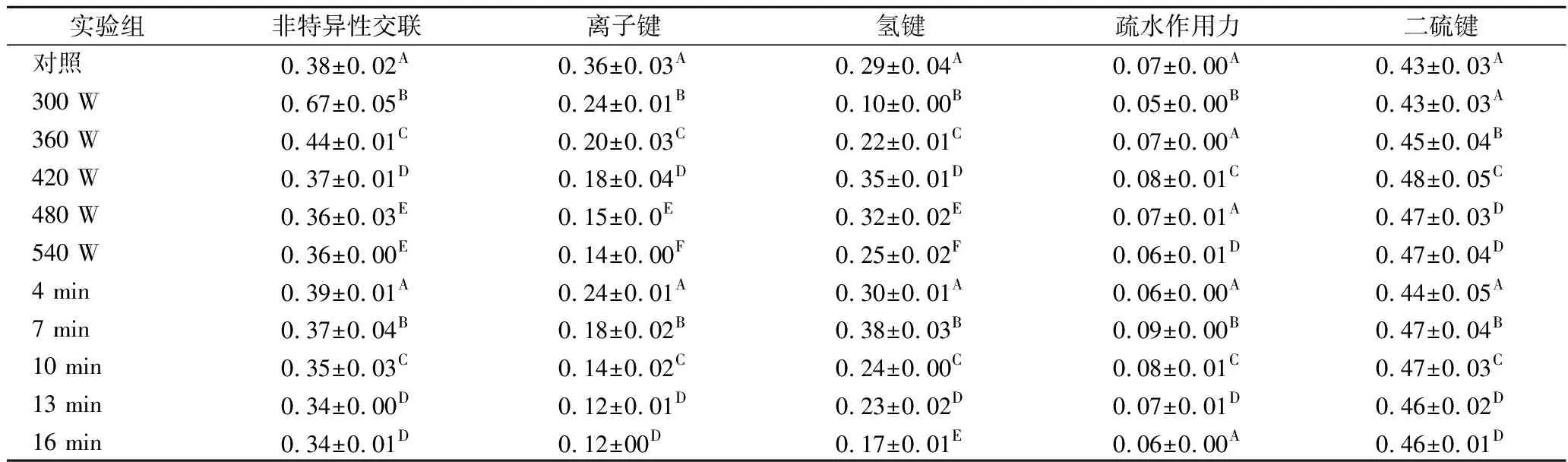
表1 超声波处理对水溶性猪肝蛋白乳化液非共价作用力的影响 单位:g/L
注:A~E分别代表组间数据的差异显著性(P<0.05)
3 结论
通过测定猪肝水溶性蛋白乳液的乳化活性指数、乳化稳定性和乳析稳定性,表明适当的超声波处理(420 W,7 min)有利于乳化液的稳定性,且可以明显改善水溶性猪肝蛋白的乳化活性,提高蛋白乳液的乳化稳定性。
通过对表面张力、界面蛋白吸附量、蛋白组成、乳化液微观结构和乳液的分子作用力等指标的分析探讨,表明超声功率和时间的增加,猪肝水溶性蛋白乳液界面张力会减小,界面蛋白发生自聚行为,蛋白的非特异性交联作用和离子键均先降低后基本维持不变,二硫键则先增加后基本维持稳定;适当的超声波处理(420 W,7 min)可使蛋白乳液颗粒粒径范围变窄,分布更加集中,且液滴间无明显聚集现象。
综合分析表明,超声波处理猪肝水溶性蛋白能有效改善其乳化效果,且当超声波功率为420 W,时间为7 min时效果最佳。
