纳米壳聚糖粒子制备工艺优化及抗菌性研究
2020-02-27林洪斌郭训练刘茜邢亚阁许青莲方佳兴车振明
林洪斌,郭训练,2,刘茜,邢亚阁*,许青莲,方佳兴,车振明
1(西华大学 食品与生物工程学院, 四川 成都, 610039) 2(商丘学院 风景园林学院,河南 商丘,476000)3(西华大学 西华学院, 四川 成都,610039)
壳聚糖(chitosan,CS)是从昆虫和虾、蟹等甲壳类动物的外壳中提取的甲壳素经浓碱溶液处理后脱乙酰基得到的产物,具有良好的生物相容性、生物降解性及成膜性等优点,同时其对革兰氏阳性菌、革兰氏阴性菌和真菌均有一定的抑制作用[1-2],但其抗菌性易受外界因素影响,纯壳聚糖膜用于果蔬保鲜时抗菌效果较差[3],且自身力学性能较差,使其应用具有局限性。而将壳聚糖制备成纳米壳聚糖粒子后,利用纳米材料独特的尺寸效应在保留壳聚糖优良性质的同时,能明显提升其力学性质及抗菌性,在果蔬保鲜领域有巨大的应用潜力[4]。

现阶段,国内外采用离子交联法制备纳米壳聚糖的研究很多[12-13],作为重要指标的纳米壳聚糖粒径和Zeta电位常常受到壳聚糖溶液浓度、交联剂溶液浓度、壳聚糖和交联剂溶液比例、反应溶液pH、超声处理条件等诸多因素的影响[14],如何得到窄尺寸,分布均匀,结构稳定的纳米壳聚糖粒子并研究其抗菌性成为研究人员关注的重点。FAN等[15]采用离子交联法制备单分散性的壳聚糖纳米粒子,通过优化制备条件,最终得到粒径为138 nm,Zeta电位为35 mV的壳聚糖纳米粒子。DE PINHO NEVES等[16]采用23因子设计优化离子交联技术制备壳聚糖纳米粒子的工艺,发现纳米颗粒的形成主要取决于壳聚糖与三聚磷酸钠的比例。而MANIKANDAN等[17]采用离子交联法制备壳聚糖纳米粒子,并发现其在离体叶片条件下,对稻瘟病毒具有显著抑制作用。
本文为得到粒径更小,分布均匀且结构稳定的纳米壳聚糖粒子,采用离子交联法制备纳米壳聚糖粒子。通过单因素和Box-Behnken响应面,以纳米壳聚糖平均粒径 (Z-ave) 和Zeta电位 (ZP) 为响应值,利用纳米粒度仪考察研究CS浓度,TPP浓度,CS与TPP的体积比,CS溶液pH值等因素对制备纳米壳聚糖平均粒径和Zeta电位的影响,优化得到纳米壳聚糖粒子的最佳制备工艺条件,为纳米壳聚糖粒子的制备和应用提供理论依据和参考。
1 材料与方法
1.1 材料与试剂
壳聚糖(脱乙酰度85.61%),济南海得贝海洋生物工程有限公司;三聚磷酸钠、冰乙酸、NaOH(分析纯), 成都市科龙化工试剂厂;营养琼脂、营养肉汤(生物试剂), 北京奥博星生物技术有限责任公司。
菌种:大肠杆菌 (E.coli)、金黄色葡萄球菌 (S.aureus),西华大学果蔬保鲜与加工研究所。
1.2 仪器与设备
Nano-ZS纳米粒度仪,英国马尔文仪器有限公司;PHS-320酸度计,成都世纪方舟科技有限公司;SD-1000喷雾干燥器,EYELA东京理化器械株式会社;BPG-9240A精密鼓风干燥箱,上海一恒科学仪器有限公司;RH digital数显型加热磁力搅拌器,广州艾卡仪器设备有限公司;UV2800紫外可见分光光度计,上海舜宇恒平科学仪器有限公司;GI54DWS立式自动压力蒸汽灭菌器,厦门致微仪器有限公司。
1.3 实验方法
1.3.1 壳聚糖纳米粒子的制备
参考CALVO等[18]和FAN等[15]的方法,并稍作修改。称取一定质量的壳聚糖溶解于体积分数1%的冰乙酸溶液中,配制成0.75 mg/mL的壳聚糖溶液,磁力搅拌1 h,调节pH值至5.0,溶液用0.45 μm的滤膜过滤以除去溶液中的不溶性杂质,制得壳聚糖储备液;配制浓度为0.75 mg/mL的TPP水溶液,经0.45 μm滤膜过滤,制得TPP储备液。移取6.0 mL壳聚糖储备液于50 mL圆底离心管中,在转速为600 r/min磁力搅拌器上,快速加入1.0 mL的TPP储备液,持续搅拌10 min,即得壳聚糖纳米粒子悬浮液。使用喷雾干燥器制备壳聚糖纳米颗粒[19]。喷雾干燥条件为:流速120 mL/h,干燥气流量为0.35 m3/min,喷雾加压为130 kPa,入口温度为121 ℃,出口温度为65 ℃。将壳聚糖纳米粒子置于玻璃管中保存。
1.3.2 纳米壳聚糖的粒径分布、Zeta电位和多分散指数(polydispersity, PDI)的测量
使用纳米粒度分析仪分别测量纳米粒子的平均粒径(Z-ave)、多分散指数 (PDI)以及Zeta电位 (ZP) 等数据,测试温度25 ℃,光检测角度90°。
1.3.3 单因素实验
设定CS溶液的浓度为0.75 mg/mL,TPP溶液的浓度为0.75 mg/mL,V(CS)∶V(TPP)=6∶1,CS溶液的pH值为5.0,使用磁力搅拌器600 r/min搅拌10 min为初始条件,分别考察的实验变量包括CS溶液的浓度 (0.25、0.5、0.75、1.0、1.5、2.0 mg/mL)、TPP溶液的浓度 (0.25、0.5、0.75、1.0、1.5、2.0 mg/mL)、CS与TPP的体积比(3∶1、4∶1、5∶1、6∶1、7∶1)、CS溶液的pH值 (3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5)对纳米壳聚糖粒子平均粒径和Zeta电位的影响。
1.3.4 响应曲面实验设计
根据单因素实验结果,以Z-ave和Zeta电位为响应值,以CS浓度、TPP浓度、V(CS)∶V(TPP)、CS溶液的pH值为自变量,利用Design Expert 8.0.6实验设计软件进行四因素三水平共29组的响应曲面优化实验[20]。实验因素水平如表1所示。
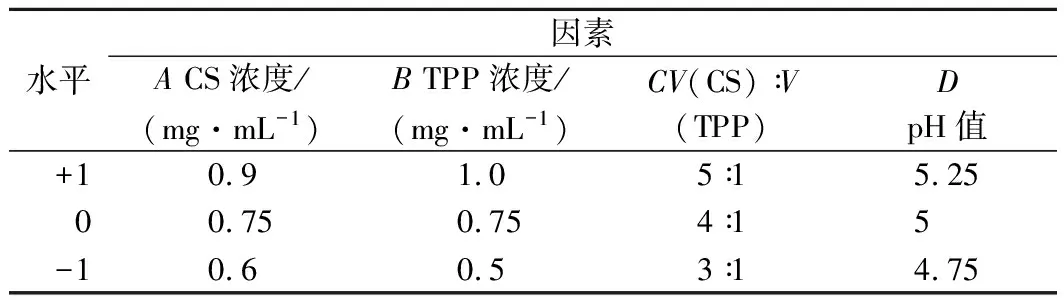
表1 响应面实验设计因素和水平编码值Table 1 Independent levels and code of responsesurface methodology
1.3.5 纳米壳聚糖抗菌实验
将大肠杆菌及金黄色葡萄球菌分别接种于固体培养基中,37 ℃培养24 h,用0.85%的生理盐水洗脱,离心洗涤,将菌体重新悬浮,调整菌悬液浓度,于4 ℃冰箱保存备用。
取不同体积的纳米壳聚糖溶液,分别加入装有50 mL营养肉汤的锥形瓶中,使其终浓度分别达到0.2、0.4、0.6 mg/mL。121 ℃灭菌20 min,冷却后,加入1 mL菌悬液,37 ℃,120 r/min下摇床培养24 h,使用紫外分光光度计每隔一段时间测定OD610。以等体积的无菌去离子水代替纳米壳聚糖作为对照,每个样品重复3次。
1.4 数据处理
采用Design-Expert 8.0.6软件进行响应面实验设计优化,采用SPSS 22.0和Excel进行数据统计和分析,显著性水平P<0.05,结果表示为均值±标准偏差;Origin 9.0作图。
2 结果与分析
2.1 单因素实验
2.1.1 CS溶液浓度对纳米壳聚糖粒径和Zeta电位的影响
壳聚糖链中的氨基阳离子在酸溶液中被质子化,与TPP中的磷酸基团负离子发生正负电荷的吸引,发生交联作用从而形成壳聚糖纳米粒子[21]。设定TPP浓度为0.75 mg/mL,CS与TPP的体积比为6∶1,CS溶液的pH值为5.0,考察CS浓度对纳米壳聚糖粒径和Zeta电位的影响,如图1所示。随着壳聚糖溶液浓度从0.25增大至2.0 mg/mL,粒子的粒径先保持83.6 nm不变,随后逐渐增加到335.9 nm,Zeta电位从+15.57增加到+27.71 mV。出现上述现象的原因主要与质子化的氨基基团的数量有关。当CS溶液处于低浓度状态时,氨基基团含量低,不能与磷酸基团进行有效的接触,离子交联作用较弱,形成的纳米粒子粒径较小,随着壳聚糖浓度的增加,质子化的氨基基团增加,体系中的1个磷酸基团可与多个氨基基团产生交联,分子间氢键增加,形成的纳米粒子粒径较大;Zeta电位是对壳聚糖分子之间相互排斥或吸引力的强度的度量,其绝对值越大表示体系越加稳定,随着CS溶液浓度升高,氨基质子化程度增加从而带更多正电荷,Zeta电位逐渐增加。综合考虑,CS浓度为0.75 mg/mL附近较为合适。
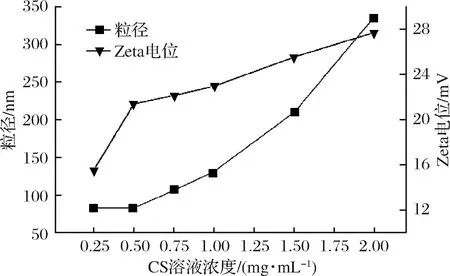
图1 CS溶液浓度对粒子粒径和Zeta电位的影响Fig.1 Effect of CS solution concentration on particle sizeand Zeta potential
2.1.2 TPP溶液浓度对纳米壳聚糖粒径和Zeta电位的影响
固定CS浓度为0.75 mg/mL,CS与TPP的体积比6∶1,CS溶液的pH值为5.0,考察TPP浓度对纳米壳聚糖粒径和Zeta电位的影响,如图2所示。随着TPP溶液浓度的增加,纳米壳聚糖的粒径从93.1 nm增加到147.1 nm,而Zeta电位几乎呈线性降低,从+22.62 mV降低到+14.53 mV。主要是随着TPP浓度增加,更多的磷酸基团与质子化氨基基团发生离子交联作用,形成的纳米粒子逐渐增加,分子间形成更多的氢键,从而粒径增大,Zeta电位减小。综上,选取TPP浓度0.75 mg/mL进行下一步优化。

图2 TPP溶液浓度对粒子粒径和Zeta电位的影响Fig.2 Effect of TPP solution concentration on the size andZeta potential
2.1.3 CS与TPP的体积比对纳米壳聚糖粒径和Zeta电位的影响
固定CS浓度为0.75 mg/mL,TPP浓度为0.75 mg/mL,CS溶液的pH值为5.0,考察CS与TPP的体积比对纳米壳聚糖粒径和Zeta电位的影响,如图3所示。

图3 CS与TPP溶液体积比对粒子粒径和Zeta电位的影响Fig.3 Effect of volume ratio of CS to TPP solution onparticle size and Zeta potential
随着CS与TPP的体积比增大,粒径先从135.2 nm减小到106.7 nm,当体积比达到7∶1时,粒径突然增大到124.4 nm,主要是由少量的磷酸基基团与大量的质子化氨基基团交联造成的;随着CS与TPP体积比增加,体系中纳米粒子表面质子化氨基的数量逐渐增多,导致Zeta电位持续增加,从+20.79 mV增大到+23.50 mV。综上,选择CS与TPP体积比为6∶1作为下一步优化条件。
2.1.4 CS溶液pH值对纳米壳聚糖粒径和Zeta电位的影响
壳聚糖是高分子的弱电解质,其电离常数pKa约为6.5,溶液pH值的增大可使壳聚糖分子上氨基的质子化程度降低[22]。溶液的pH值对TPP的电荷数也有一定的影响,溶液pH值的增大会导致TPP所含负电荷数量增加[23],所以pH值是纳米壳聚糖粒子制备中的关键因素。固定CS浓度为0.75 mg/mL,TPP浓度为0.75 mg/mL,CS与TPP的体积比为6∶1,考察CS溶液的pH值对纳米壳聚糖粒径和Zeta电位的影响。结果如图4所示,当pH值低于5.0时,随着CS溶液pH值的增大,粒径呈现减小的趋势,在pH值为5.0时,粒径取得最小值106.7 nm,随后粒径逐渐增大,在pH值为6.5时,粒径达到216.1 nm。随着pH值的增大,分子上氨基可结合氢离子减少,所带正电荷减少,Zeta电位逐渐下降。综合考虑选择pH值为5进行优化。

图4 壳聚糖溶液pH值对粒子粒径和Zeta电位的影响Fig.4 Effect of pH value of chitosan solution on particlesize and Zeta potential
2.2 响应面实验设计及结果
采用Box-Behnken实验设计,以CS浓度 (A)、TPP浓度 (B)、CS与TPP的体积比 (C) 和壳聚糖溶液的pH值 (D) 为自变量,以粒径 (Y1) 和Zeta电位 (Y2) 为响应值,进行响应面优化分析。实验设计及结果见表2。
利用 Design-Expert 8.0.6 软件,对表2中的实验数据进行二次回归分析,建立回归模型,分别以Z-Ave (Y1)和ZP (Y2)为因变量,得到编码值的多元二次回归方程为:
Y1=122.36+0.20A-0.82B-2.31C-0.075D+2.47AB-0.35AC+1.98AD-0.15BC+1.23BD-0.33CD+3.69A2+5.12B2+15.38C2+5.33D2
Y2=23.32+0.43A+0.17B+1.01C+0.037D-0.092AB-0.46AC-0.11AD+0.17BC+0.31BD+0.13CD-0.77A2-0.59B2-3.31C2-1.05D2

表2 响应曲面实验设计及结果Table 2 Experimental design and results of responsesurface methodology
2.3 回归方程方差分析

在平均粒径 (Y1) 模型中,一次项CS与TPP的体积比 (C) 以及二次项A2、B2、C2和D2对纳米壳聚糖的平均粒径均有极显著的影响 (P<0.01);交互项中CS浓度 (A) 和TPP浓度 (B)的交互作用对纳米壳聚糖的平均粒径影响显著 (P<0.05),其他交互项影响不显著。按结果对影响作用排序为C>B>A>D。
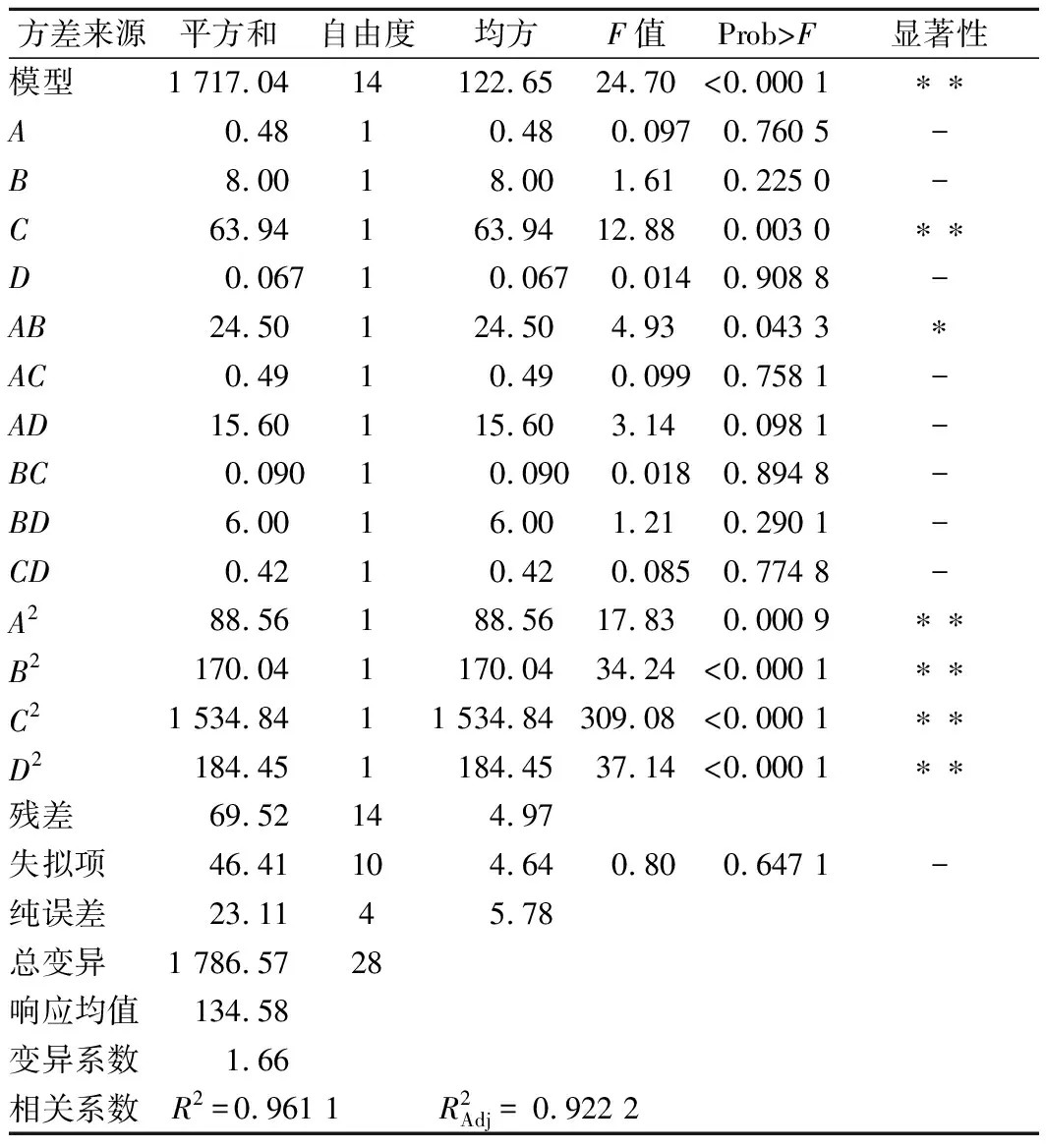
表3 壳聚糖纳米粒子平均粒径的二次回归模型的方差分析Table 3 Analysis of variance for quadratic regressionmodel for Z-Ave of chitosan nanoparticles
注:“**”为差异极显著 (P<0.01);“*”为差异显著 (P<0.05);“-”为差异不显著(下同)

在Zeta电位回归方程中,一次项C,二次项中C2和D2对Zeta电位 (Y2) 的影响呈极显著水平 (P<0.01);二次项A2对Zeta电位 (Y2)的影响显著 (P<0.05),交互项对Zeta电位 (Y2) 的影响均不显著。按结果对影响作用进行排序为C>A>B>D。
2.4 响应面分析
各因素交互作用对纳米壳聚糖粒径影响的响应曲面,如图5所示。响应面开口向上,响应值存在极小值。固定其他变量,沿C变量方向响应面较陡,等高线变化密集,当C固定,沿其他变量方向响应曲面变化较缓,等高线较稀疏,说明C比A、B和D对纳米壳聚糖平均粒径的影响大,与方差分析结果相符。其他因素对纳米壳聚糖粒径的影响作用中,TPP浓度大于CS浓度,CS溶液pH大于CS浓度。

表4 壳聚糖纳米粒子Zeta电位二次回归模型的方差分析Table 4 Analysis of variance for quadratic regressionmodel for Zeta potential of chitosan nanoparticles

图5 A、B、C、D交互作用对纳米壳聚糖粒径大小影响的响应曲面图Fig.5 Response surface of mutual-influence for theinteractive effects of A,B,C and D on theparticle size of nano-chitosan
各因素交互作用对纳米壳聚糖Zeta电位影响的响应曲面,如图6所示。从图6可以看出,响应面开口向下,响应值存在极大值。沿C方向响应曲面较其他因素更为陡峭,说明C对纳米壳聚糖Zeta电位的影响更为显著,与方差分析结果一致;同理,CS浓度影响作用大于TPP浓度,CS溶液pH影响作用比CS浓度更为显著,CS溶液pH影响作用大于TPP浓度。
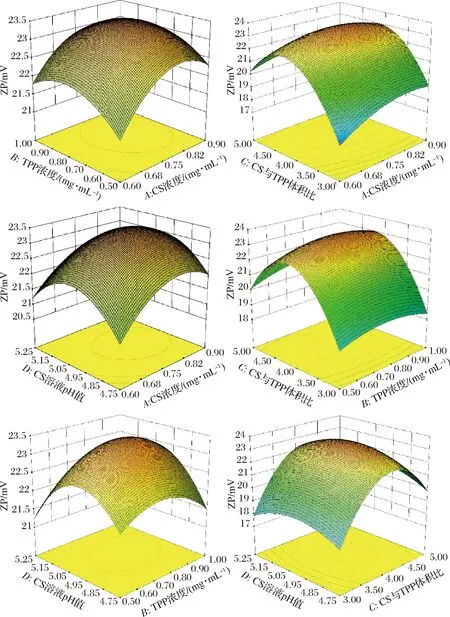
图6 A、B、C、D交互作用对纳米壳聚糖Zeta电位影响的响应曲面图Fig.6 Response surface of mutual-influence for theinteractive effects of A、B、C and D on the Zetapotential of nano-chitosan
2.5 验证实验
通过响应面优化得到制备纳米壳聚糖的最佳条件,即CS浓度为0.76 mg/mL,TPP浓度为0.77 mg/mL,CS与TPP的体积比为4.11∶1,壳聚糖溶液的pH值为5.0。纳米壳聚糖的粒径和Zeta电位的理论预测值分别为122.3 nm和+23.43 mV。利用纳米粒度仪测定最优条件制备的纳米壳聚糖的粒径、Zeta电位和分散度,实验结果表明,纳米壳聚糖的粒径为119.2 nm,Zeta电位为+22.8 mV,与理论值偏差分别为2.53%、2.69%,说明响应面回归模型可以很好地预测各因素与粒径和Zeta电位之间的关系。最优条件下制备的纳米壳聚糖的粒径分布如图7所示,粒径分布显示的峰较窄,说明粒子分布较集中,大小较均一, PDI为0.176(<0.3),粒子的分散程度均匀[24],适合进一步的研究评估。

图7 纳米壳聚糖的粒径分布Fig.7 Graphs of size distribution of nano-chitosan
2.6 纳米壳聚糖粒子抗菌试验结果
吸光度与细菌菌悬液浓度间存在线性正比关系,由图8可看出不同浓度纳米壳聚糖对大肠杆菌的抑制作用,在24 h内各实验组对应的OD610均小于对照组,表明纳米壳聚糖对细菌的生长具有一定的抑制作用。随着处理时间达到3 h后,不同浓度纳米壳聚糖抗菌性表现出较明显差异。浓度0.2 mg/mL的纳米壳聚糖,在6~15 h之间其OD610与对照组接近,抑菌作用不明显。当浓度增大到0.4 mg/mL时,前6 h OD610处于极低的范围,6 h后开始快速上升,大肠杆菌开始快速繁殖。当浓度达到0.6 mg/mL时,表现出极为明显的抑制作用,其OD610在6 h后与水平轴趋于平行且保持稳定,说明大肠杆菌的生长繁殖一直处于有效抑制的状态。

图8 不同浓度纳米壳聚糖对大肠杆菌的时间抗菌曲线Fig.8 The growth curve and time-kill curve of E. coli atvarious concentrations of chitosan nanoparticles
如图9所示,随着纳米壳聚糖溶液浓度的增加,其对金黄色葡萄球菌的抑菌作用也越强。与对照组相比,当纳米壳聚糖浓度为0.2 mg/mL时,在3 h后OD610较对照组偏低,呈现与对照组相似的变化规律,说明此浓度对金黄色葡萄球菌抑菌作用不强。浓度为0.4 mg/mL纳米壳聚糖在前12 h对金黄色葡萄球菌表现出显著的抗菌性,但12 h后OD610快速上升,金黄色葡萄球菌开始快速增多。浓度为0.6 mg/mL纳米壳聚糖,其OD610始终保持极低且稳定的趋势,说明此浓度下金黄色葡萄球菌生长被完全抑制。

图9 不同浓度纳米壳聚糖对金黄色葡萄球菌的时间抗菌曲线Fig.9 The growth curve and time-kill curve of S. aureuat various concentrations of chitosan nanoparticles
纳米材料由于表面带正电荷,依靠静电相互作用吸附到细胞膜,通过细胞内吞作用进入细胞内部并与之发生物理或化学作用,影响细胞的生理活动最终达到杀死细胞的目的。王杰等[25]制备的杂多蓝负载的壳聚糖纳米粒子质量浓度为7.5 mg/mL 时对大肠杆菌及金黄色葡萄球菌抑制率达到99%。宋玉民等[26]制备了纳米AgBr/壳聚糖杂化材料,显著提升壳聚糖抗菌性,并确定其对大肠杆菌及金黄色葡萄球菌的最低抑菌浓度均为0.625 mg/mL。而本实验可以看出当纳米壳聚糖粒子浓度达到0.6 mg/mL时,大肠杆菌和金黄色葡萄球菌均被完全抑制,表现出良好的抗菌性。同时相较于大肠杆菌,3 h后金黄色葡萄球菌实验组OD610下降趋势更为明显,说明纳米壳聚糖粒子对金黄色葡萄球菌抑制作用更强,与马新贤等[27]结论一致。
3 结论
采用离子交联法,以三聚磷酸钠为交联剂,制备壳聚糖纳米粒子,通过单因素实验和响应面实验,以纳米壳聚糖粒子的粒径和Zeta电位为考察指标,进行工艺优化,得到的最佳制备工艺条件为:CS浓度为0.76 mg/mL,TPP浓度为0.77 mg/mL,CS与TPP的体积比为4.11∶1,壳聚糖溶液的pH值为5.0。在该条件下,纳米壳聚糖粒子的粒径和Zeta电位分别为119.2 nm,+22.8 mV,与模型理论预测值接近,制备所得纳米壳聚糖粒子分布较集中,分散程度均匀,因此,利用响应面法优化壳聚糖纳米粒的制备工艺是可行的,且纳米壳聚糖粒子浓度0.6 mg/mL时具有良好的抗菌性,为纳米壳聚糖粒子应用到果蔬保鲜中提供理论依据。
