培养条件及表面活性剂的添加对纳豆芽孢杆菌生物膜形成的影响
2020-02-27冯静静杨自名吴静李伟SokhnaMbackeGningue赵礼军周文豪薛正莲王洲刘艳
冯静静,杨自名,吴静,李伟,Sokhna Mbacke Gningue,赵礼军,周文豪,薛正莲,2,王洲,2,刘艳,2*
1(安徽工程大学 生物与化学工程学院,安徽 芜湖,241000) 2(微生物发酵安徽省工程研究中心,安徽 芜湖,241000)
生物膜(biofilm,BF)是具有高度组织性的微生态系统,是细菌由浮游的单细胞状态转变为静止的多细胞状态的过程,随后的生长导致了有组织的群落以及细胞分化[1]。能够附着在非生物介质的表面以及气液相交的界面上,分泌的细胞外聚合物(extracellular poly-mericsubatances,EPS)主要包括胞外多糖、胞外蛋白、胞外DNA(extracellular DNA,eDNA),以此来增强对外界不利环境的抗性以及耐受能力[2-3]。作为一种细菌群体合作和竞争并存的表现形式,生物膜在细菌抵制外界有害物质入侵和外部环境压力,调整内部细菌个体协同代谢和遗传物质横向传递等方面,起着非常重要的作用。细菌的这种群体合作的行为,赋予了很多细菌个体所不具备的特殊功能,如近些年发现的细菌生物膜抵抗外来抗生素的进入[4]、促使结直肠癌的发生[5]等,在食品加工过程中菌体附着在设备的湿润拐角处形成生物膜,难以清除,造成设备腐蚀以及清理成本的增加。生物膜形成量的增加使其厚度增加,温度传感器不敏感造成生产过程中的损失。其内部调控机制成为当前学术界竞相研究的热点,也是近几年Science、Cell及PNAS等国际顶级期刊研究报道的热门[6-12]。同时,生物膜的形成导致细胞密度过高、营养物质有限、代谢产物的积累和细胞的高渗透压,细菌也会承受很大的压力。据报道,细菌也可能使用不同的附着机制来应对这些被修饰过的非生物介质,过度地使用表面活性剂也可能使细菌产生耐药性[13]。因此,研究生物膜具有重要意义。纳豆芽孢杆菌(Bacillussubtilisnatto,Bsn)是革兰氏阳性菌,属于好氧型细菌,且具有耐热以及较强的酸碱稳定性,在胃酸的环境下能够存活4 h[14]。Bsn不仅能分解大分子物质,如碳水化合物、蛋白质、脂肪等,使发酵产品中拥有丰富的有机酸、氨基酸、寡糖等易被人体吸收的小分子化合物;还能在发酵时产生对人类有利的代谢产物,如具有凝血功能和治疗三高(高血糖、高血压、高血脂)的维生素K2以及高强溶血栓功能的纳豆激酶[15]。因此,Bsn对于人类的健康起着重要的作用。而且有研究表明,Bsn生物膜的形成与维生素K2和纳豆激酶的含量之间具有密切的关系[16],更加明确了研究纳豆芽孢杆菌生物膜的意义。本文探究了培养条件及表面活性剂的添加对Bsn生物膜形成的影响,为研究其他革兰氏阳性菌生物膜及其致病机理提供理论基础。
目前,对于生物膜的研究多集中在革兰氏阴性菌,如大肠杆菌和铜绿假单胞菌等,但是对于Bsn生物膜的研究却鲜有报道,尤其是关于生物膜形成的调控因素研究。文章通过在不同温度、pH值[17]以及几种具有代表性的表面活性剂[13]对Bsn形成生物膜的能力进行分析,明确Bsn生物膜的形成条件,并且阐述不同代表类型的表面活性剂对生物膜形成的影响特性,从而为研究生物膜奠定理论基础。
1 材料与方法
1.1 菌种和培养基
纳豆芽孢杆菌(Bacillussubtilisnatto)CGMCC2108,由本实验室保藏。
培养基:LB固体琼脂培养基、LB液体培养基、胰蛋白胨大豆肉汤培养基(tryptose soya broth, TSB)。
试剂:0.1 g/100 mL结晶紫染液、33%体积分数乙酸、PBS缓冲液、葡萄糖、NaCl、十二烷基磺酸钠(sodium dodecyl sulfate, SDS)、柠檬酸二铵、苯扎溴铵,上海生工生物有限公司。
双层振荡培养箱,知楚仪器;1510全波长酶标仪,赛默飞世尔科技(中国)有限公司。
1.2 实验方法
1.2.1 培养基的配制
LB液体培养基(g/L):NaCl 10、胰蛋白胨10、酵母提取物5。固体培养基即加入2 g/L的琼脂粉。
TSB培养基(g/L):胰蛋白胨17、大豆木瓜蛋白酶消化物3、NaCl 5、K2HPO42.5、葡萄糖2.5。
1.2.2 纳豆芽孢杆菌菌种活化及培养
从-80 ℃的冰箱中取出1管菌种在LB固体培养基上划线分离单菌落,挑取单菌落于装有30 mL LB液体培养基的250 mL摇瓶中,37 ℃摇床培养12~16 h,吸取2 mL转接至50 mL TSB液体培养基中37 ℃振荡培养12~16 h至对数生长期。
1.2.3 改良微孔板法
以有盖的24孔板为载体,每孔中加入300 μL的菌液,然后加入2.5 mL的新鲜TSB培养基,3个重复孔,并且以空TSB培养基作为对照,37 ℃培养72 h定量测定生物膜。首先缓慢移除每孔中的培养物,然后用PBS缓冲液清洗2~3次,洗去未黏附的菌体,自然干燥后加入3 mL 0.1 g/mL的结晶紫染液进行染色20 min,再用PBS进行缓慢冲洗,直至流出无色为止,室温静置干燥,除去多余水分,随后加入3 mL体积分数33%乙酸进行脱色15 min,最后用酶标仪测定OD570 nm的值衡量生物膜的多少。
OD570 nm是用来反映生物膜与非生物介质表面黏附的牢固程度,实验结果的比较分析参考文献所述方法,即:以只有TSB培养基的对照孔的平均值加上3倍标准差(ODc)与实验组进行比较,来表示生物膜的黏附等级: OD≤ODc为无黏附(-),ODc
1.2.4 纳豆芽孢杆菌生物膜形成时间筛选
将活化培养之后的菌液加入TSB培养基中,平行3次,37 ℃分别在12、24、36、48、60、72、84、96 h之后从恒温培养箱中拿出,按照1.2.3的方法测定,拍照记录。
1.2.5 培养基pH对纳豆芽孢杆菌生物膜形成的影响
在确定生物膜形成的最佳时间后,配制不同pH值(5、6、7、8)的TSB培养基,每个水平3个平行,37 ℃培养72 h,按照1.2.3的方法测定。
1.2.6 葡萄糖和NaCl的含量对纳豆芽孢杆菌成膜的影响
配制含有不同质量浓度的葡萄糖(0、1、3、5 g/100 mL)和NaCl(0、1、3、5 g/100 mL)排列组合的TSB培养基37 ℃培养72 h后,按照1.2.3的方法进行菌株的成膜性能比较。
1.2.7 培养温度对纳豆芽孢杆菌生物膜形成的影响
确定生物膜形成的最适pH值后,分别在不同的温度(16、30、37、42 ℃)条件下进行培养,平行3次,按照1.2.3的方法进行定量测定。
1.2.8 不同表面活性剂对纳豆芽孢杆菌成膜能力的影响
选择不同类型的表面活性剂:阳离子型的十六烷基三乙基溴化铵(cetyl trimethyl ammonium bromide, CTAB)、阴离子型的SDS、两性离子型的柠檬酸二铵以及非离子型的聚乙二醇-200(polyethylene glycol-200,PEG-200)。配制上述不同浓度表面活性剂(表1)的母液加入24孔板中,每个浓度3个平行,以不加表面活性剂的TSB培养基为对照,37 ℃培养72 h,测定生物膜形成量。

表1 不同类型表面活性剂加入培养基的质量浓度Table 1 The mass concentration of different surfactantsadded into the medium
2 结果与分析
2.1 纳豆芽孢杆菌生物膜形成最佳时间的确定
生物膜的形成是一个有序过程,主要涉及细胞-介质表面、细胞-胞外聚合物、细胞-细胞之间的互作,形成过程包括细菌在介质表面的黏附、细菌集聚和微菌落发育以及生物膜的成熟与解离3个阶段。
由图1可知,在0~72 h之间,生物膜产生量呈现逐渐上升的趋势,72 h生物膜产生量到达最高,随后生物膜产生量下降,胞外聚合物的产生能够促进生物膜刚性结构的产生,尤其是胞外多糖的产生。36、48、60、72 h处于气液界面的生物膜都很容易挑起,但在72 h生物膜的黏附量最大;在12、24、84、96 h时生物膜松散甚至不完整,容易受到外界的影响重新变回浮游状态。因此,36~72 h之间Bsn的生物膜处于菌体聚集和发育的稳定阶段;0~24 h之间处于初始的黏附阶段;72 h之后生物膜成熟并且解离进入下一个循环。

图1 不同时间下纳豆芽孢杆菌生物膜的形成Fig.1 Formation of Bsn biofilms at different times
2.2 pH值对纳豆芽孢杆菌生物膜形成的影响
由图2可知,在不同pH值的条件下,生物膜形成具有较大的差异,pH值为7时生物膜形成量最多,可能是因为7为Bsn生长的最适pH值,生长代谢旺盛,运动能力强,菌体能够在此条件下由原来的单细胞状态转变为聚集的多细胞状态,是生物膜形成的重要条件之一;但是pH值为5时生物膜基本无黏附,在试验记录过程中,前期并没有生物膜形成,浮游的单细胞并没有耐酸环境的能力;并且酸性环境会减弱细胞与物体表面的黏合力,导致生物膜产生量大幅降低。有趣的是,在72 h之后形成成熟的生物膜,然后测定不同初始pH值条件下菌液的pH值,发现pH值都维持在8.45左右,初步推测是Bsn产生生物膜,其胞外聚合物使pH值升高,但具体机制尚不明确,后续实验会进一步进行实验分析。
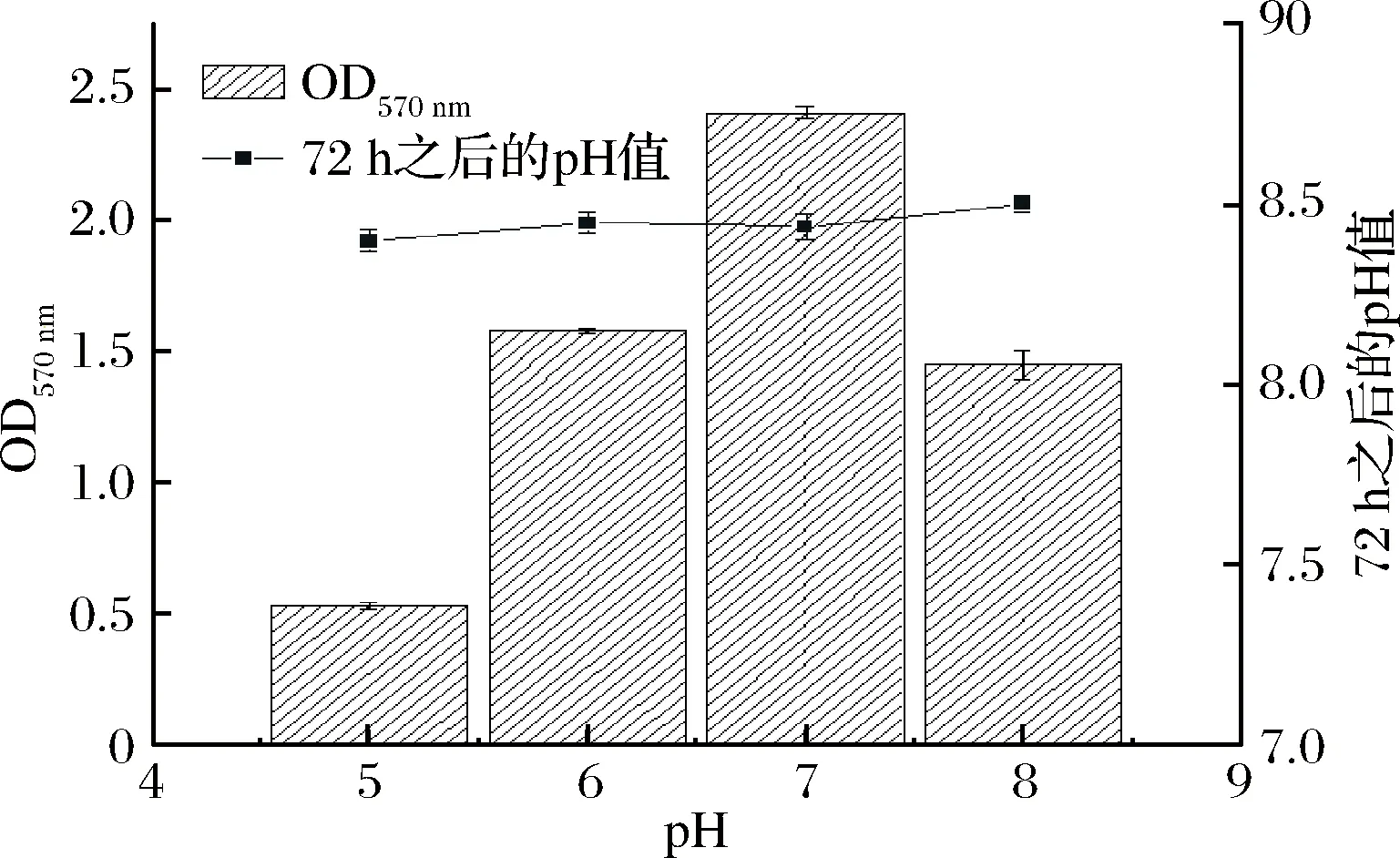
图2 不同pH对Bsn生物膜形成的影响及其72 h之后菌液的pH值Fig.2 Effect of different pH values on biofilm formationof Bsn and pH value of bacteria solution after 72 h
2.3 不同质量浓度的葡萄糖和NaCl条件下纳豆芽孢杆菌生物膜的形成
由表2可知,在37 ℃、葡萄糖质量浓度为0、NaCl质量浓度为1、3 g/100 mL的条件下以及NaCl质量浓度为5 g/100 mL, 葡萄糖质量浓度为0、1、5 g/100 mL的条件下都能够使生物膜黏附。比较葡萄糖和NaCl单独作用和葡萄糖和NaCl联合作用(表2)的结果来看,Bsn在葡萄糖和NaCl联合作用的情况下生物膜的形成率最高。我们将Mn2+、Mg2+、Ca2+、Fe2+、Na+以1.0 g/L的质量浓度加入到培养基中进行生物膜的培养,发现Na+存在的情况下生物膜的形成量最佳,Mg2+次之(图3)。

表2 不同葡萄糖和NaCl含量下纳豆芽孢杆菌生物膜的形成Table 2 Formation of Bsn biofilms at different glucoseand salt concentrations
注:括号中为测定生物膜时3个平行实验OD570nm的平均值
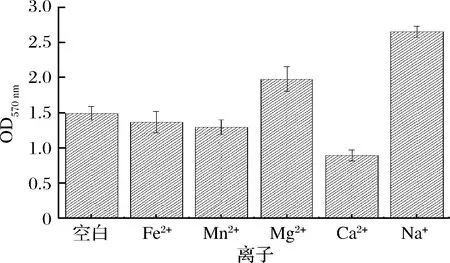
图3 不同离子对Bsn生物膜形成的影响Fig.3 Effectof different ions on biofilm formation of Bsn
NaCl作为一种无机盐,能够维持细胞正常的渗透压。纳豆芽孢杆菌对高盐的耐受性[18]使其能够在5 g/100 mL的NaCl环境中存活, Na+的存在能够使细胞的细胞壁结构更加完整,但是过高或者过低的Na+质量浓度均会影响细胞的正常生长, 生物膜结构可能会随盐浓度的增加而逐渐解体, 膜密度变得疏松, 胞外多糖减少而不能使生物膜与非生物介质进行黏附。靳嘉巍等[19]的研究表明葡萄糖对表皮葡萄球菌的生物膜形成具有诱导作用, 主要是通过诱导其相关基因的表达从而使生物膜产生量增加。但生物膜的形成是一个复杂的过程, 不同的外界环境条件具有不同的信号转导机制。
2.4 温度的不同对纳豆芽孢杆菌形成生物膜的影响
TONE等[20]研究表明温度对生物膜的影响与葡萄糖和NaCl有关。由图4可知,在不同温度、葡萄糖和NaCl的质量浓度的一系列组合下,Bsn的生物膜形成具有复杂性和多样性。不同的温度对Bsn生物膜产生的影响显著,随着温度的升高,生物膜有不断上升的趋势,但在42 ℃时生物膜的量出现下降,空气干燥不利于生物膜的生长;16 ℃时生物膜形成量较少,且菌体沉淀在24孔板底部,低温条件下,菌体生长和代谢缓慢,运动能力急剧下降,因此低温抑制生物膜的形成。且在37 ℃条件下成膜能力最强,较高的温度不利于生物膜的形成。
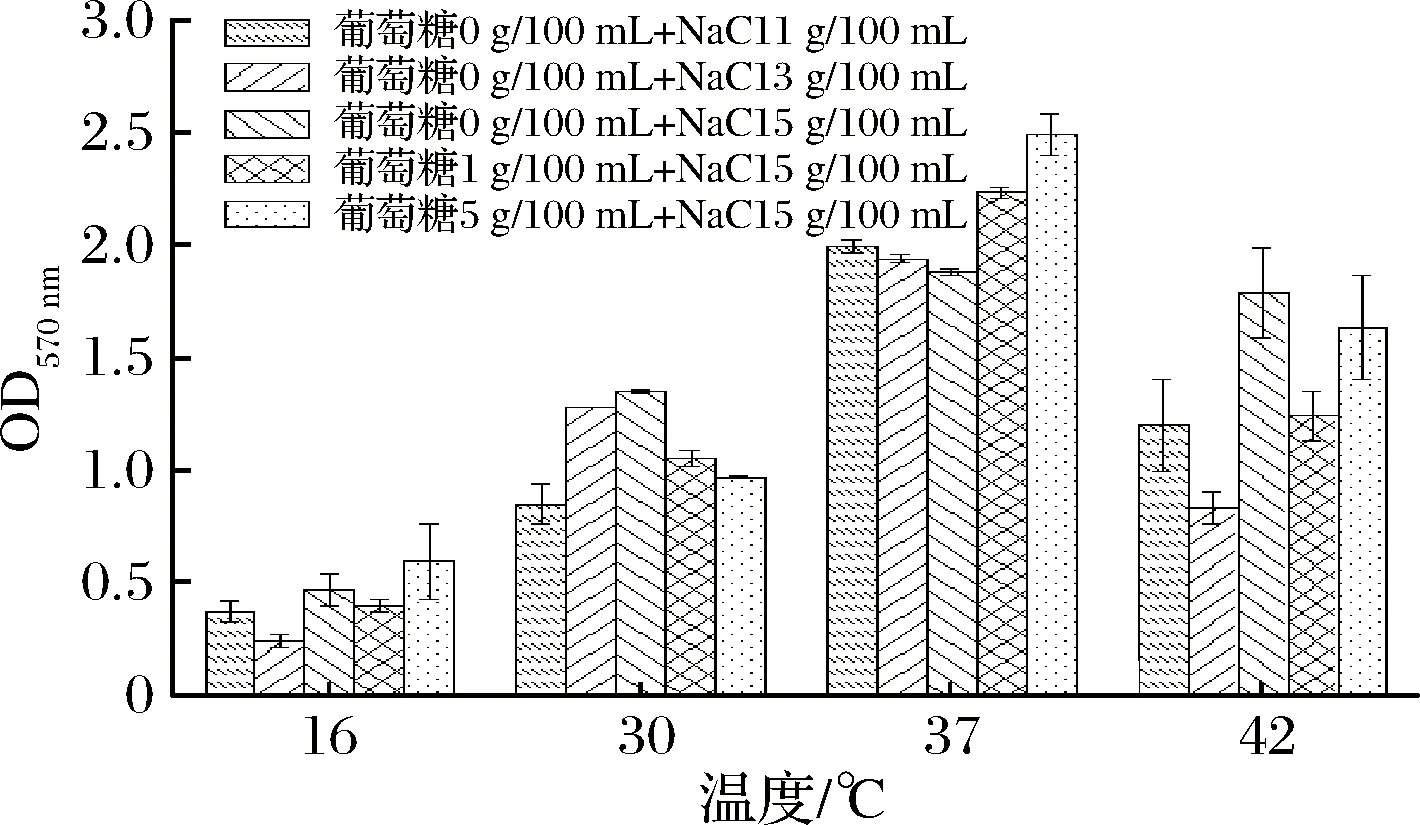
图4 不同温度下葡萄糖和NaCl的含量对Bsn生物膜的影响Fig.4 Effect of glucose and NaCl concentrations onbiofilm formation of Bsn at different temperatures
2.5 表面活性剂对纳豆芽孢杆菌生物膜的影响
分子中具有亲水基与疏水基,能富集(吸附)于界面,使界面性质发生显著改变而出现界面活性的物质称为表面活性剂。常用的表面活性剂为低分子量化合物,应用于生物膜抗菌剂、药物载体与控制释放、生物模拟、聚合物LB膜、乳液聚合等的研究。由于表面活性剂类型多样导致作用不一,因此,本文选择阴离子型、阳离子型、非离子型和两性离子型的表面活性剂进行实验,探究表面活性剂对Bsn生物膜的影响。为了确定不同的表面活性剂对Bsn的生物量没有显著影响,因此在把菌液加入24孔板前测定了加入1.0 g/L不同表面活性剂的Bsn的生长曲线,如图5所示,在没有形成生物膜之前,加入表面活性剂菌体的生物量没有明显的变化。
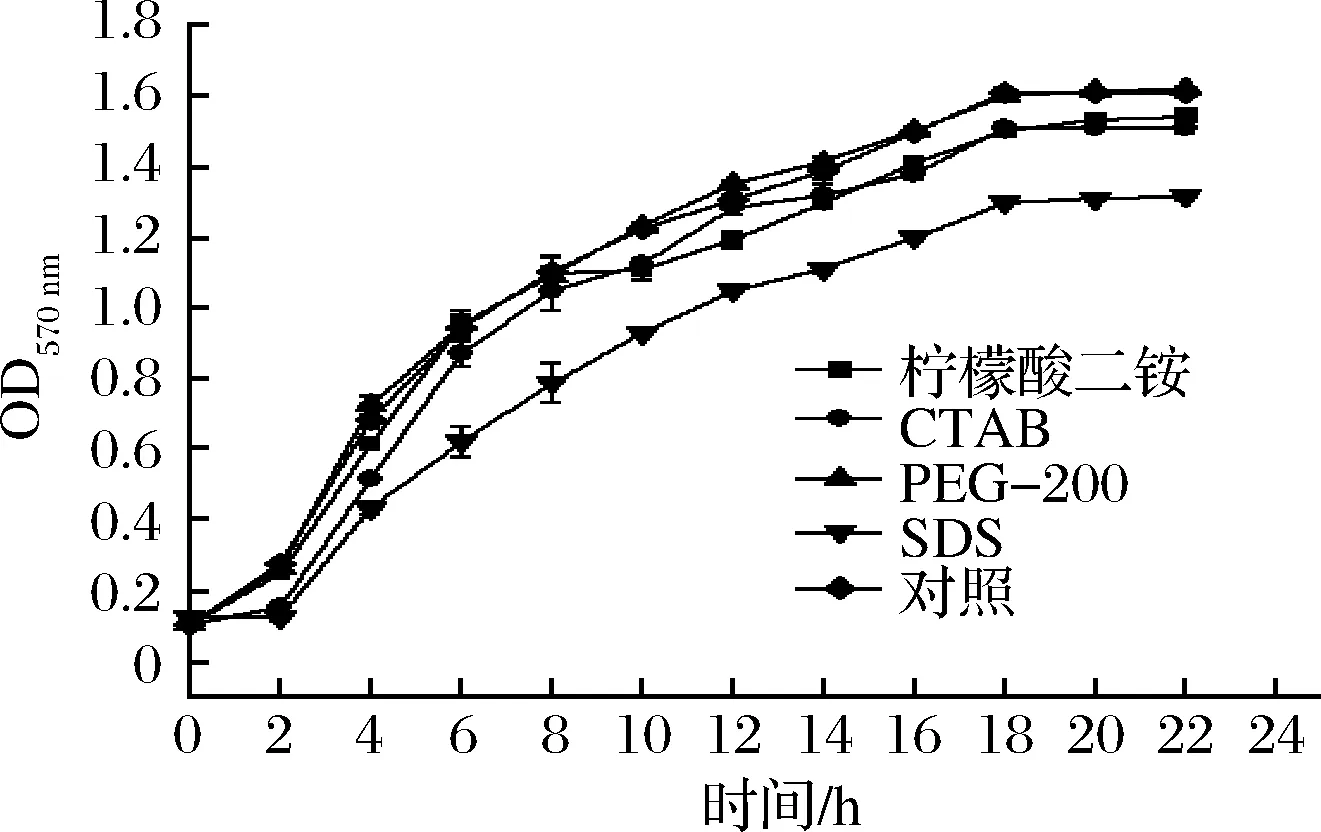
图5 加入不同的表面活性剂后Bsn的生长曲线Fig.5 Growth curve of Bsn after adding different surfactants
2.5.1 柠檬酸二铵对纳豆芽孢杆菌生物膜的影响
由图6可知,随着柠檬酸二铵质量浓度的增加,生物膜的形成反而降低,但是在0.8 g/L时生物膜形成量达到最高,但当质量浓度超过0.8 g/L,生物膜形成量又下降。佘鹏飞等[21]研究表明,两性离子化合物使铜绿假单胞菌的生物膜厚度和尺寸减小。DESROSIERS等[22]通过菌落计数法进行评估,发现柠檬酸两性离子型表面活性剂使金黄色葡萄球菌和铜绿假单胞菌的菌落数明显减少,同时,激光共聚焦显微镜显示,其生物膜的覆盖率也明显下降。可能是因为柠檬酸二铵是一种两性离子表面活性剂,在溶液中有两种离子形态,在低浓度或者高浓度时能够与胞外聚合物中的钙离子桥结合,从而降低胞外聚合物的稳定性,使Bsn生物膜形成量减少。
2.5.2 SDS对纳豆芽孢杆菌生物膜的影响
如图6所示,SDS对Bsn的生长具有很大的影响。即使在0.2 g/L的低浓度下也不能使菌体正常生长,生物膜也基本无黏附。BOO等[23]的研究表明,阴离子抗菌剂更容易改变细胞膜的通透性,渗透到细胞中。产生此类现象的原因可能是SDS是一种阴离子表面活性剂,能够进入到细菌内部,对细胞具有较强的穿透力,可使细胞膜崩解,与膜蛋白疏水部分结合并使其与膜分离,高浓度SDS可破坏蛋白质中的离子键和氢键等共价键,甚至改变蛋白质的构象。影响蛋白质结构以及使胞外聚合物中的蛋白质变性,导致生物膜不能形成或者解散脱落。

图6 不同柠檬酸二铵和SDS质量浓度对Bsn生物膜形成的影响Fig.6 Effect of different diammonium citrate and SDSconcentrationson biofilm formation of Bsn
2.5.3 CTAB对纳豆芽孢杆菌生物膜的影响
由图7可知,在所设的质量浓度范围内,生物膜产生量具有先上升后下降的趋势,当CTAB的质量浓度为0.4 g/L时,生物膜量到达峰值,之后又随着质量浓度的增加而降低,但是依然比对照组要高。MULCAHY等[24]研究发现eDNA能诱导铜绿假单胞菌阳离子抗菌肽耐药性操纵子PA3552 PA3559的表达,从而使对阳离子抗菌剂的耐药性增加2 560倍。eDNA是生物膜胞外聚合物的重要组分之一,稳定生物膜的空间结构,促进菌体的聚集和生物膜的黏附。促进生物膜的形成可能是因为CTAB是一种常用的阳离子型表面活性剂,能在低浓度时与胞外聚合物中的蛋白质和脂质相互作用,增加细胞膜的通透性,使胞外聚合物分泌增多,尤其是eDNA的含量;但在高浓度时,长链烷基能够刺穿细胞膜,导致菌体死亡,生物膜产生量下降。在加入2.0 g/L CTAB之后OD570nm稍微出现上升,查阅文献[25]发现,CTAB处理后存活的细菌细胞使生物膜得以再生和恢复,同时CTAB对生物膜的恢复似乎没有抑制作用,虽然使生物膜的稳定状态受到了影响,但是生物膜也可以通过不同的方式恢复到新的稳定状态。
2.5.4 PEG-200对纳豆芽孢杆菌生物膜的影响
由图7可知,PEG-200对Bsn生物膜的影响在质量浓度为1.0 g/L时达到最高,低于或高于这个质量浓度时都会使生物膜的产生量降低。PEG-200是一种非离子型表面活性剂,即在水溶液中不电离,不会产生离子;具有润湿、乳化等特性。EDGAR等[26]认为非离子型表面活性剂在高浓度时能够抵抗细菌黏附,因为疏水基团能产生很大的排斥体积和反渗透压,影响生物膜形成过程中高聚物的形成,从而影响生物膜的形成和稳定性。所以在大于1.0 g/L的质量浓度之后,生物膜的产生量会下降,抑制生物膜的形成。但在质量浓度为1.0 g/L时能够促进生物膜的产生,可能是因为PEG-200能够提供湿润的环境,适宜生物膜的生长,另一方面是表面活性剂增加细胞膜的透性,使胞外聚合物的含量提高,促进生物膜的黏附。

图7 不同CTAB和PEG-200质量浓度对Bsn生物膜形成的影响Fig.7 Effect of different CTAB and PEG-200 concentrat-ionson biofilm formation of Bsn
3 结论
目前,控制生物膜形成的策略有2大类:一是通过修饰改变表面性质和表面活性剂来防止细菌的黏附和生物膜的形成;二是利用物理力、酶等消除或者破坏已经形成的生物膜。本文通过采用结晶紫染色法确定Bsn生物膜形成最佳时间以及在不同温度、pH值、营养条件和不同类型的表面活性剂对Bsn的生物膜产生的影响进行分析,筛选了柠檬酸二铵、SDS、CTAB、PEG-200这4种表面活性剂进行实验。研究结果表明,培养条件为37 ℃、pH为7、1 g/100 mL NaCl、3 g/100 mL NaCl、5 g/100 mL NaCl、1 g/100 mL 葡萄糖-5 g/100 mL NaCl、3 g/100 mL 葡萄糖-5 g/100 mL NaCl、5 g/100 mL葡萄糖-5 g/100 mL NaCl条件下都能够形成生物膜,且在37 ℃,培养72 h条件下,5 g/100 mL葡萄糖-5 g/100 mL NaCl成膜能力最佳。适当的盐浓度和高温促进生物膜的形成,柠檬酸二铵的质量浓度为0.8 g/L时能够促进生物膜的形成,PEG-200在1.0 g/L时可以促进生物膜的形成,低于或高于这个浓度都会抑制生物膜的产生量,CTAB对Bsn生物膜的影响是先升高后降低,但都比对照组的生物膜产生量高,在0.4 g/L时达到最大值,此外,SDS对Bsn生物膜的形成具有很强的抑制作用。本研究结果能够为Bsn的生物膜研究提供一定的实验基础,同时在控制其生物膜的形成方面具有借鉴意义。
