脓毒症患者cf-DNA/NETs、炎症细胞亚群以及血清IL-6、 IL-10水平变化的意义
2020-02-26闫雪梅
闫雪梅
新疆医科大学第一附属医院医学检验中心,新疆乌鲁木齐 830000
脓毒症是因为感染产生的全身炎症反应综合征,进一步发展会引起患者脓毒性休克,影响患者生命健康[1-2]。脓毒症患者体内有强烈的炎症应答,可能有促炎和抗炎反应失衡紊乱的现象。在脓毒症的炎症应答调控中,多种免疫细胞和免疫分子扮演着重要的角色[3-4]。本研究旨在观察治疗前后脓毒症患者中性粒细胞胞外诱捕网(cf-DNA/NETs)、炎症细胞亚群变化以及血清白细胞介素-6(IL-6)、白细胞介素-10(IL-10)水平变化,并探讨其临床意义,现报道如下。
1 资料与方法
1.1一般资料 选取本院2016年11月至2018年11月收治的脓毒症患者48例作为脓毒症组。纳入标准:(1)符合脓毒症 3.0[5]中的脓毒症诊断标准;(2)年龄>18岁;(3)患者知情同意。排除标准:(1)伴有严重基础疾病,如心肺复苏后、特重型颅脑损伤,预后极差,可能成为主要死因的病症;(2)合并原发性心、脑、肾、肺等器官功能障碍;(3)恶性肿瘤;(4)合并自身免疫性疾病。脓毒症组中男29例,女19例;年龄19~77岁,平均(45.3±9.5)岁;急性生理学及慢性健康状况评分系统(APACHE)Ⅱ评分为(22.35±5.12)分;序贯器官衰竭(SOFA)评分为(12.35±3.12)分;脓毒症的诱因:肺部感染24例,腹腔感染18例,植入物感染3例,化脓性胆管炎2例,盆腔脓肿1例。纳入同期30例健康志愿者作为健康组,其中男22例,女8例;年龄19~76岁,平均(44.8±8.6)岁。两组研究对象在年龄、性别之间差异无统计学意义(P>0.05),具有可比性。
1.2方法
1.2.1治疗方法 脓毒症组按照《中国严重脓毒症/脓毒性休克治疗指南(2014)》[6]的推荐意见进行集束化治疗,给予针对原发病的对症治疗、抗感染、营养支持、免疫调节、对症支持等治疗,并加用乌司他丁30万IU/次静脉注射,3次/日,连续7 d。
1.2.2外周血单个核细胞(PBMCs)和血清的分离 脓毒症组患者在治疗前及治疗7 d后清晨、健康组在清晨采集外周静脉血13 mL,其中抗凝静脉血10 mL采用密度梯度离心法分离PBMCs,调整细胞水平为106个/mL,在37 ℃、5%CO2湿化空气环境选择含10%胎牛血清的RPM11640中培养。非抗凝静脉血3 mL,3 000×g离心10 min分离血清。
1.2.3流式细胞术测定外周血炎症细胞 取1×106个细胞置于流式细胞检测专用试管中,分别加入抗CD3-FITC、抗CD4-perCPCy5.5、抗CD8-APC(购自美国eBioscience公司)各10 μL。4 ℃ 避光孵育20 min,用PBS缓冲液冲洗1次,1 200 r/min离心5 min,用PBS缓冲液冲洗1次,采用FACSCalibur型流式细胞仪(购自美国R&D公司),采用CellQuest软件获取并分析,采用FlowJo软件分析测定结果。
1.2.4细胞因子测定 采用人Luminex细胞因子检测试剂盒,Luminex LX-200分析仪(包括xPONENT 3.1软件购自美国BD公司)检测血清IL-6、IL-10水平。
1.2.5cf-DNA/NETs检测 血浆复温后取100 μL,采用基于PicoGreen荧光染料法,用荧光酶标仪测定荧光值,按照标准曲线计算游离DNA(cf-DNA/NETs)水平。

2 结 果
2.1脓毒症组治疗前后及健康组炎症细胞比例比较 脓毒症组患者治疗前杀伤性T 细胞比例明显低于健康组,NK 细胞比例明显高于健康组,差异均有统计学意义(P<0.05)。两组的辅助性T 细胞上比例差异无统计学意义(P>0.05)。与治疗前相比,脓毒症组治疗后的辅助性T 细胞和杀伤性T 细胞比例明显增高,NK 细胞比例明显降低,差异均有统计学意义(P<0.05)。见表1。
2.2脓毒症组治疗前后及健康组cf-DNA/NETs、IL-6、IL-10水平比较 如表2所示,脓毒症组患者治疗前血清IL-6、 IL-10水平以及血浆cf-DNA/NETs明显高于健康组,差异均有统计学意义(P<0.05)。与治疗前相比,脓毒症组患者治疗后血清IL-6、 IL-10水平及血浆cf-DNA/NETs明显降低,差异均有统计学意义(P<0.05)。
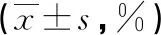
表1 脓毒症组治疗前后及健康组炎症细胞 比例比较
注:与健康组比较,*P<0.05;与组内治疗前比较,#P<0.05。

表2 脓毒症组治疗前后及健康组血清IL-6、 IL-10水平比较
注:与健康组比较,*P<0.05;与组内治疗前比较,#P<0.05。
3 讨 论
如今脓毒症被认为是宿主对感染应答失调引起脏器功能失衡的症候群,关于其病理机制尚未完全清楚,主要与促炎反应和抗炎反应的失衡,微循环障碍,免疫功能紊乱等有关。严重感染引起的全身性炎性反应及器官功能损害是因为激活单核/巨噬细胞、内皮细胞等炎症细胞所引起的[7-8]。免疫应答过度激活,活化的单核/巨噬细胞能够识别其特异性受体,释放前炎症介质(如TNF-α、IFN-γ、IL-1、IL-6、IL-8等),进而引起细胞因子的瀑布样分级反应。但是相关学者发现,免疫抑制并非相对促炎反应而发生的代偿性反应,是在感染或损伤一开始就有的,说明严重感染最早是免疫低反应[9]。为此,严重感染一方面可能有免疫亢进,另一方面也有免疫抑制,免疫治疗的重点在于重建免疫平衡稳态。
本研究结果显示,脓毒症组治疗前杀伤性T 细胞比例明显低于健康组,NK 细胞比例明显高于健康组,差异均有统计学意义(P<0.05),但辅助性T细胞在脓毒症患者中的水平与健康组无明显差异。相关学者在动物实验中发现NK细胞的表达和本研究类似[10]。在细菌感染中,NK细胞具有促进免疫应答的作用。本研究结果显示脓毒症组患者治疗前血清IL-6、 IL-10水平明显高于健康组,差异均有统计学意义(P<0.05)。IL-6主要由T细胞和巨噬细胞合成,具有强烈的致炎活性,升高的IL-6对前炎性反应有分化作用,也可引起免疫功能失调[11]。既往研究认为,IL-6在严重脓毒症和脓毒性休克中的上调与预后存在紧密联系,提示该细胞因子在脓毒症发生、发展中发挥重要作用[12-13]。 IL-10是抗炎细胞因子,主要由Th2细胞、单核/巨噬细胞合成,能释放TNF-ɑ、IL-6、IL-8等致炎介质,还可以抑制炎性细胞的增殖作用,是体内的抗炎细胞因子[14-15]。本研究结果显示,脓毒症组患者治疗前血清 IL-10水平明显高于健康组,提示患者可能处于轻微的免疫抑制状态。本研究对脓毒症组进行集束化治疗并加用乌司他丁,乌司他丁可以独立抑制多种酶的活性,是理想的抗炎药物。治疗后脓毒症组患者的辅助性T 细胞和杀伤性T 细胞比例明显高于治疗前,NK 细胞比例明显低于治疗前,差异均有统计学意义(P<0.05)。进一步说明NK细胞在脓毒症的发生、发展中有促进免疫应答的作用,乌司他丁起到了清除氧自由基以及抑制炎性递质释放的作用,能增加辅助性T 细胞和杀伤性T 细胞的数量,减少NK细胞的数量[16-17]。本研究中,与治疗前相比,脓毒症组治疗后的血清IL-6、 IL-10水平明显更低,说明该治疗方案可降低血清IL-6、 IL-10水平。相关学者在脓毒症合并多脏器功能衰竭综合征病例中也得到了类似的结论[18],患者血清中炎症因子IL-4、IL-6、IL-10均有不同程度的下降,但只有在IL-6上有明显差异,提示乌司他丁可诱导降低炎性递质的表达,调控脓毒症治疗过程中的免疫应答。
在脓毒症发展过程中,中性粒细胞的凋亡发挥了重要作用,其受到脂多糖刺激后,部分表面抗体释放增加,能够反映细菌感染,并且使NETs释放增加,诱导IL-1β、IL-8等炎症介质的释放。而且当病原体侵入机体后,NETs核心成分组蛋白水平可进行多种修饰,进而对免疫功能产生影响,造成损伤。本研究结果显示,脓毒症组患者治疗前血浆cf-DNA/NETs明显高于健康组,治疗后血浆cf-DNA/NETs明显下降。提示NETs可作为脓毒症某时期反映炎症损伤程度的标志物,值得进一步深入探讨。
综上所述,cf-DNA/NETs、炎症细胞亚群与IL-6、 IL-10在脓毒症发展过程中发挥了重要作用,患者存在严重的免疫平衡紊乱。集束化治疗并加用乌司他丁能改善炎症细胞亚群的比例,发挥免疫调控作用,调节IL-6、IL-10、cf-DNA/NETs水平,有增强机体免疫防御的作用,但炎症因子间的作用形成错综复杂的调控网络,免疫状态形成确切机制十分复杂,有待于进一步深入研究。
