家蝇幼虫耐高温抗氧化蛋白的筛选及其功能研究
2020-02-26黄靖怡柯德森
黄靖怡,柯德森
(广州大学 生命科学学院,广州510006)
家蝇(Muscadomestica)对各种不良环境具有高度适应性,已作为一种资源昆虫受到广泛关注。而蝇蛆作为蝇的幼虫,富含脂肪酸、蛋白质等营养成分及多种维生素和生物活性物质,是一种宝贵的营养资源[1-2]。从蝇蛆中提取的蝇蛆油含有十分丰富的不饱和脂肪酸,不仅是维持生物体活动的重要成分,而且对皮肤损伤有良好的疗效[3],同时还可作为生物柴油的合成原料[4]。而蝇蛆蛋白质含量丰富、种类多样,具有良好的开发价值。研究发现,从蝇蛆中可提取抗菌谱广、杀菌能力强的抗菌物质(一般为多肽类物质),且该类抗菌物质普遍存在耐高温的特性[5]。Ai等[6-7]相继发现蝇蛆富含的蛋白质组分显示出优异的肝保护活性、禽流感病毒H9N2等病毒的抗病毒性、DPPH自由基与超氧阴离子自由基清除活性及免疫调节功能。Zhang等[8]发现家蝇幼虫蛋白水解物具有较高的综合抗氧化活性。
当机体受到有害刺激时,会产生过多活性氧(Reactive oxygen species,ROS)使机体内氧化与抗氧化系统失衡,发生脂质过氧化等反应导致机体氧化损伤,其中细胞膜系统将首先受到活性氧的攻击。而研究表明,活性氧堆积及引发的一系列反应是衰老及许多疾病的诱发因素[9-12]。目前,用于抵御脂质过氧化等氧化损伤反应所需抗氧化剂包括化学合成抗氧化剂[13]及天然抗氧化剂[14],但前者存在潜在的毒性作用,而后者在生产应用过程中会因高温等不良环境导致活力丧失,故开发兼具耐高温特性的天然抗氧化剂有重要意义,其中抗氧化肽因其微量高效等特点,成为天然抗氧化剂的研究热点。
基于抗氧化肽等天然抗氧化产品在生产应用中存在的活性成分不稳定现状及蝇的环境适应性特点,本研究对蝇蛆蛋白进行高温处理及体外抗氧化能力的综合评价,筛选具有较高温度耐受性的抗氧化蛋白,探究其对H2O2诱导损伤的H9c2细胞的保护作用,进一步探讨蝇蛆耐高温蛋白抗氧化活性效应,为优质蛋白资源开发及其在食品、保健品产业及饲料业和养殖业的应用提供理论基础。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
家蝇(Muscadomestica)幼虫,由广州市小卫生物技术有限公司提供,为经冷冻保存的3龄虫。NBT,上海麦克林生化科技有限公司;TPTZ,阿拉丁试剂股份有限公司;H9c2细胞,中山大学惠赠;Cell Counting Kit-8、LDH、BCA、SOD、CAT、GSH试剂盒,购于碧云天生物技术研究所;其他试剂均为分析纯。
1.1.2 仪器与设备
Bio-Rad蛋白电泳系统(配有PowerPac通用电泳仪电源和 mini-PROTEAN Tetra手灌胶系统),美国Bio-Rad公司;Gel Doc XR+全自动凝胶成像系统,美国Bio-Rad公司;FreeZone 6 L立式冻干机,美国Labconco公司;infinite 200Pro酶标仪,瑞士Tecan公司;Agilent 1220 Infinity高效液相色谱仪(配有紫外检测器和OpenLAB CDS ChemStation色谱工作站),美国Agilent 公司;CKX41倒置显微镜,日本Olympus公司;HERAcell150i CO2培养箱,美国Thermo公司。
1.2 实验方法
1.2.1 样品高温处理及蛋白质含量测定
家蝇幼虫与去离子水以1∶10的比例研磨2 min,静置5 min并用8层纱布过滤,4℃、12 000 r/min 高速离心30 min,去除上层油脂及沉淀,留清液。取等量清液分别进行60、80、100℃加热处理,前30 min每5 min取1次样,共处理1 h。处理后样品经4℃、12 000 r/min高速离心10 min,取上清液作为蝇蛆蛋白提取液备用。参考Grintzalis等[15]的方法,采用考马斯亮蓝法检测蝇蛆样液蛋白质含量,检测波长595 nm。
1.2.2 SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析
对Wu等[16]的方法作适当修改。采用10%的分离胶和4%的浓缩胶及考马斯亮蓝(R-250)染色,Bio-Rad凝胶成像系统观察,检测样品的蛋白质分布。
1.2.3 体外抗氧化能力测定
1.2.3.1 羟自由基清除能力
参考农石生等[17]水杨酸法测定羟自由基清除能力。取适当稀释样品与2 mmol/L FeSO4溶液、2 mmol/L水杨酸醇溶液、0.3% H2O2混合,于37℃水浴反应1 h。以50%乙醇为参比,510 nm下测吸光值。
式中:A0为对照组吸光值;A1为样品组吸光值;A2为不含H2O2的样品本底吸光值。
1.2.3.2 超氧阴离子自由基清除能力
参考Pandey等[18]NBT法测定超氧阴离子自由基清除能力。样品按梯度稀释,与13 mmol/L甲硫氨酸、63 μmol/L NBT、1.3 μmol/L核黄素、0.1 mmol/L EDTA-2Na(溶液均以pH 7.8、0.05 mol/L磷酸缓冲液配制)混合。光照15 min,设置空白对照与暗对照,测定样品吸光值,检测波长560 nm。其中加样量控制在A样品为A空白的一半左右。
超氧阴离子自由基清除活力=
式中:A空白为不加样品(空白对照)吸光值;A黑暗为不光照不加样品(暗对照)吸光值;A样品为样品吸光值;V加样为检测时加样体积,mL;V总为样液总体积,mL;W鲜重为样品鲜重,g。
1.2.3.3 还原力
参照Benzie等[19]FRAP法测定样品还原力。根据标准曲线,还原力以达到相同吸光值对应的FeSO4毫摩尔数表示。
1.2.4 疏水性分析
参照贡雯玉等[20]方法作适当修改,采用反相液相色谱法(RP-HPLC)分析样品的疏水性。色谱条件:Agilent 1220 Infinity高效液相色谱仪,RGL8565 C18色谱柱(150 mm×4.6 mm,5 μm),流动相为10%甲醇溶液,流速0.8 mL/min,检测波长254 nm,进样量10 μL,柱温(35±0.8)℃。
1.2.5 H2O2诱导H9c2细胞损伤模型的建立
H9c2细胞用含10%牛血清的DMEM培养液在37℃、5%CO2条件下培养,待细胞长至80%~90%时,加入胰蛋白酶消化。将H9c2细胞以1×105个/mL接种于96孔板中,培养24 h后分为6组,对照组不作处理,实验组分别给予由DMEM培养液配制的200、400、600、800 μmol/L的H2O2处理,每组5个复孔,分别作用8、12、24 h后,弃培养液,用CCK-8法检测细胞存活率(测定条件为加CCK后孵育2 h,用酶标仪检测450 nm处的吸光值)。

式中:A处理为含有细胞、CCK溶液和药物溶液的孔的吸光值;A对照为含有细胞、CCK溶液的孔的吸光值;A空白为含有培养基和CCK溶液的孔的吸光值。
1.2.6 蝇蛆耐高温抗氧化蛋白对H9c2细胞的毒性测定
将H9c2细胞以1×105个/mL接种于96孔板中,培养24 h后,分成5组,对照组加入含10%牛血清的DMEM培养液,实验组分别给予由DMEM培养液配制的0.5、1、2、4 mg/mL的蝇蛆耐高温抗氧化蛋白处理,每组5个复孔,分别作用8、12、24 h后,弃培养液,用CCK-8法检测细胞存活率。
1.2.7 蝇蛆耐高温抗氧化蛋白对H2O2诱导损伤的H9c2细胞氧化应激损伤的保护作用
将H9c2细胞接种于96孔板中,设置对照组、H2O2损伤模型组和给药组,对照组不作处理,H2O2损伤模型组给予600 μmol/L的H2O2处理8 h,给药组分别用0.5、1、2、4 mg/mL蝇蛆耐高温抗氧化蛋白预孵12、24 h后,换入600 μmol/L的H2O2处理8 h,用CCK-8法检测细胞存活率。
1.2.8 细胞形态观察
H9c2细胞以1×105个/mL培养于6孔板中并按1.2.6及1.2.7条件进行处理,在倒置显微镜下(×100)观察细胞形态,并用其配备的专用数码相机拍摄正常对照组、损伤模型组、给药组的典型细胞形态。
1.2.9 蝇蛆耐高温抗氧化蛋白对H2O2诱导损伤的H9c2细胞胞外LDH及胞内氧化还原酶系的影响
细胞以1×105个/mL接种于6孔板中,按1.2.7条件进行处理。收集细胞上清液检测乳酸脱氢酶(LDH)含量。此后,收集各组细胞,用细胞裂解液(Cell Lysis Buffer-10X)处理细胞,离心并取上清液(离心条件:13 200 r/min,4℃,6 min),检测蛋白质含量(BCA法)及超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活力与还原型谷胱甘肽(GSH)含量。LDH含量、蛋白质含量及各氧化还原酶系的检测按试剂盒说明书操作。
1.2.10 数据分析
实验重复3次,用Excel2007对数据进行处理,结果以“平均值±标准差”表示。采用SPSS 19.0软件进行单因素方差分析及LSD 多重比较,P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 蝇蛆耐高温蛋白筛选
图1、图2分别为不同温度处理的蝇蛆蛋白提取液蛋白质含量变化及SDS-PAGE分析结果。由图1、图2可见:未经高温处理的样品蛋白质相对分子质量主要集中在80~90 kDa;60℃处理的样品蛋白质含量略有下降,且主要集中在30~40 kDa,而处理时间对样品蛋白质含量影响不显著(P>0.05);80℃处理20 min及100℃处理5 min样品中蛋白质含量明显下降(P<0.05),且在40 kDa及20 kDa附近得到清晰条带。表明80℃以上高温加热能有效除去样品中不耐热蛋白,实现蛋白样品的初步纯化,而100℃处理用时更短,纯化效果更佳。
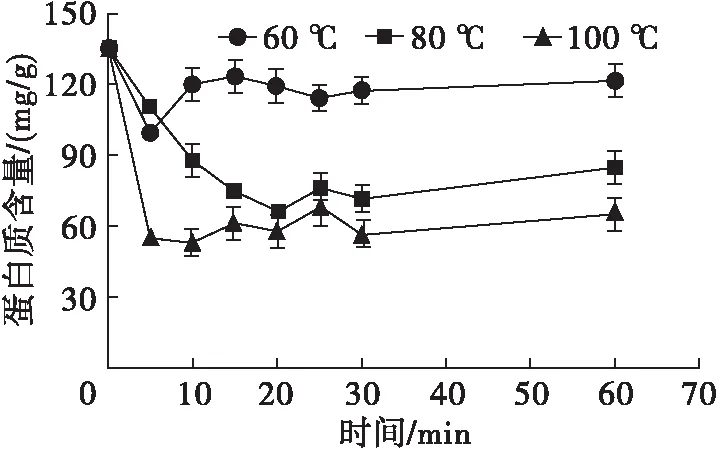
图1 60、80、100℃处理的蝇蛆蛋白提取液蛋白质含量变化
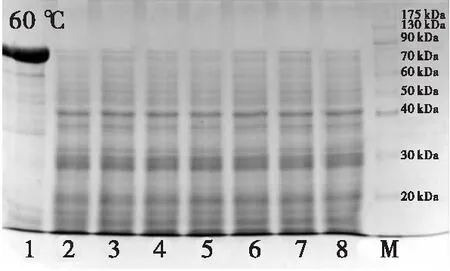
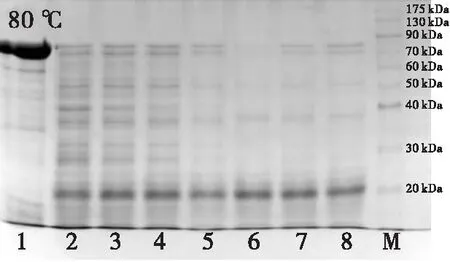

注:泳道1~8表示各温度下处理0、5、10、15、20、25、30、60 min的样品;M为标准蛋白。
2.2 蝇蛆耐高温抗氧化蛋白的筛选
对不同温度处理的蝇蛆蛋白提取液进行抗氧化能力测定,结果见图3。由图3可见,60℃处理仅对蝇蛆蛋白提取液还原力有显著降低作用(P<0.05),而80℃和100℃处理对蝇蛆蛋白提取液的还原力及超氧阴离子自由基清除能力均有显著降低作用(P<0.05),其中超氧阴离子自由基清除能力在100℃处理20 min后趋于稳定。此外,不同温度处理不同时间对蝇蛆蛋白提取液羟自由基清除能力无显著影响(P>0.05),清除率基本可达到70%,说明蝇蛆中可能存在清除羟自由基的有效成分,且该成分具有良好的热稳定性。结合图1、图2结果,证明蝇蛆耐高温蛋白具有超氧阴离子自由基、羟自由基清除能力及还原力,初步推测其抗氧化能力可能与40 kDa及约20 kDa的蛋白有关,且该范围内的蛋白质在80~100℃高温下仍能保持生物活性。蝇蛆蛋白的抗氧化性在前人研究[21-22]中已得到验证,而本研究发现蝇蛆耐高温蛋白在多种体外抗氧化系统中也具有较好的生物活性,有望成为良好的耐高温抗氧化功能蛋白的来源。 从作用效果等角度考虑,确定筛选耐高温抗氧化蛋白的优化条件为100℃处理20 min,对此条件下的蝇蛆蛋白提取液进行冷冻干燥处理,得到蝇蛆耐高温抗氧化蛋白冻干粉。
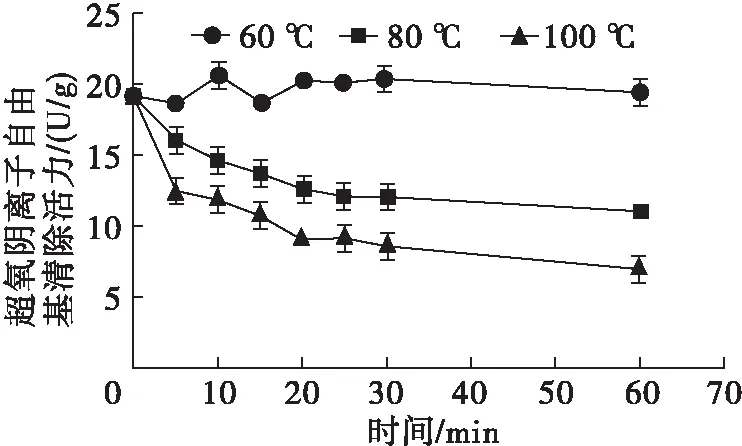
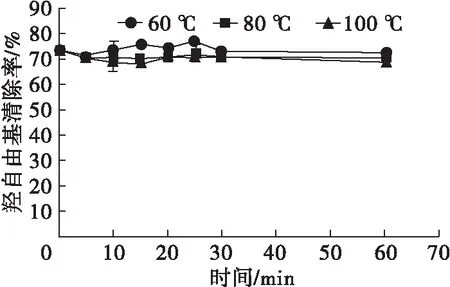

图3 60、80、100℃处理的蝇蛆蛋白提取液的抗氧化活性
2.3 蝇蛆耐高温抗氧化蛋白的疏水性
根据1.2.4,对未经高温加热处理以及100℃处理20 min的蝇蛆蛋白提取液进行疏水性分析,结果见图4。
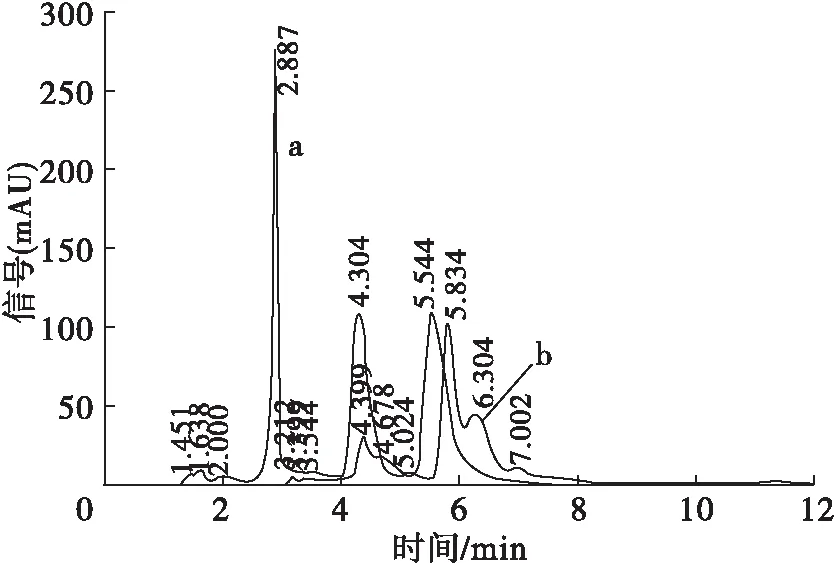
注:a、b分别为未经高温加热处理样品与100℃高温处理20 min的样品。
图4 蝇蛆蛋白提取液反相液相色谱图
由图4可见,未经高温加热处理的样品出现3个清晰主峰,峰1、2、3保留时间分别为2.887、4.304、5.544 min,其中峰3的峰面积大于峰1、2,占总峰面积的41.7%。100℃处理20 min的蝇蛆蛋白提取液在3 min以前基本无明显出峰,在4~7 min范围内出现3个明显峰,峰间有重叠。与未进行高温加热处理的样品相比,总峰面积下降约50%,出峰时间略有后移。说明经高温加热处理后,蝇蛆蛋白提取液中疏水性相对较弱的蛋白量大幅下降,疏水性相对较强的蛋白被较好地保留下来,推测耐高温蛋白具有较好的疏水性,该结果与杨楠等[23]研究结果相符。
2.4 H2O2诱导H9c2细胞损伤模型
H2O2处理可导致细胞氧化应激损伤,高浓度H2O2甚至引起细胞凋亡,因而H2O2常被用于细胞氧化损伤模型的构建[24]。通过探讨H2O2浓度及处理时间对H9c2细胞存活率的影响,构建H2O2氧化损伤模型,结果如图5所示。由图5可见:H9c2存活率与H2O2浓度及处理时间呈一定相关性,相同处理时间下,随着H2O2浓度增加,细胞存活率下降(P<0.05);而相同H2O2浓度下,随着处理时间的延长,H9c2存活率出现不同程度下降(P<0.05);400 μmol/L的H2O2处理12 h或600 μmol/L的H2O2处理8 h,H9c2存活率均达到50%左右,与对照组差异显著(P<0.05),符合H2O2诱导细胞损伤模型的建立条件。综合时间、效率等因素考虑,选取600 μmol/L H2O2处理8 h为建模条件用于后续研究。
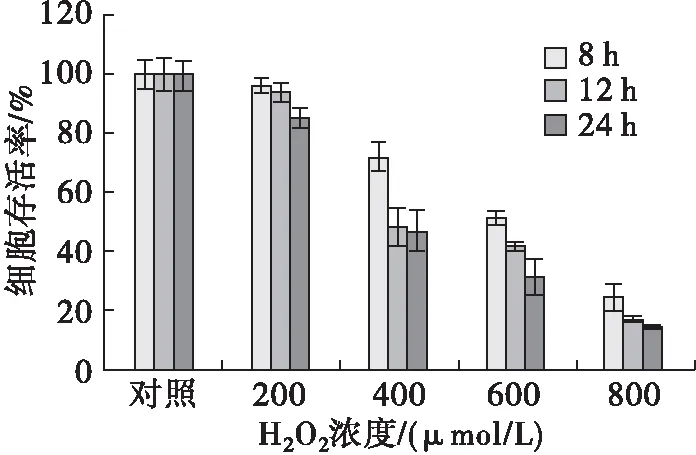
图5 H2O2浓度及处理时间对H9c2细胞存活率的影响
2.5 蝇蛆耐高温抗氧化蛋白对H9c2细胞的毒性分析
蝇蛆耐高温抗氧化蛋白对H9c2细胞存活率的影响如图6所示。由图6可见,蝇蛆耐高温抗氧化蛋白质量浓度在0.5~4 mg/mL范围内,分别处理H9c2细胞8、12、24 h,各处理时间下H9c2细胞存活率与对照组无显著差异(P>0.05)。此外,该蛋白未见明显剂量依赖性(P>0.05),不同处理时间H9c2细胞存活率间的差异无统计学意义(P>0.05)。表明蝇蛆耐高温抗氧化蛋白对H9c2细胞无明显毒性作用。
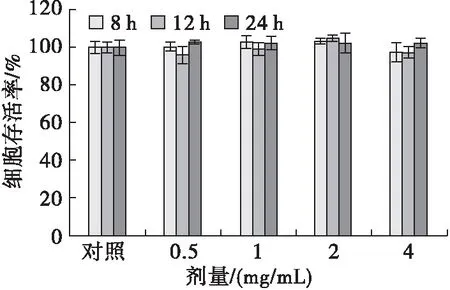
图6 蝇蛆耐高温抗氧化蛋白剂量及处理时间对H9c2细胞存活率的影响
2.6 蝇蛆耐高温抗氧化蛋白对H2O2诱导损伤的H9c2细胞氧化应激损伤的保护作用
蝇蛆耐高温抗氧化蛋白预孵育12、24 h后,600 μmol/L H2O2处理8 h,CCK-8法测定细胞存活率,结果如图7所示。由图7可见,与正常对照组相比,H2O2模型组H9c2细胞存活率下降至约46%(P<0.05),而经过不同质量浓度的蝇蛆耐高温抗氧化蛋白12、24 h预孵育后,H9c2细胞存活率明显提高,最大可提高约39%(P<0.05),并显示出一定范围内的剂量依赖性。相对于12 h预孵育,24 h预孵育能显著提高细胞存活率(P<0.05)。推测蝇蛆耐高温抗氧化蛋白对H9c2细胞有明显保护作用,并确定24 h为较佳预孵育时间。
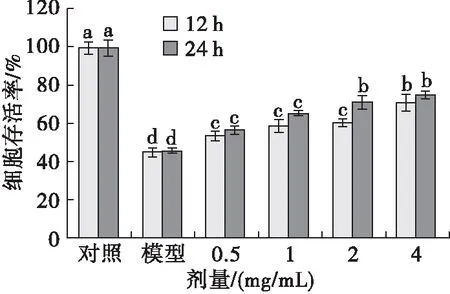
注:同一预孵时间不同字母代表差异显著(P<0.05)。
图7 蝇蛆耐高温抗氧化蛋白对H9c2细胞的保护作用
2.7 细胞形态
不同处理条件对H9c2细胞形态的影响如图8所示。
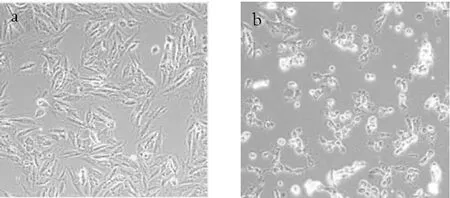
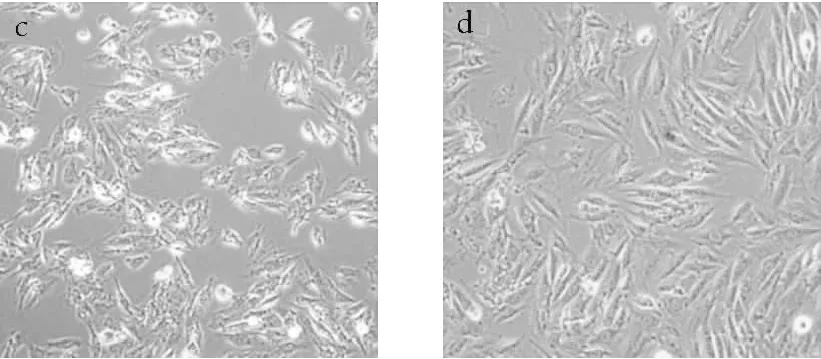
注:a.对照组;b.600 μmol/L H2O2损伤8 h;c.4 mg/mL蝇蛆耐高温抗氧化蛋白保护24 h后600 μmol/L H2O2损伤8 h;d.4 mg/mL蝇蛆耐高温抗氧化蛋白保护24 h。
图8 不同处理对H9c2细胞形态的影响(×100)
由图8a可见,细胞呈长梭形,贴壁紧密,生长状况良好。由图8b可见,600 μmol/L H2O2处理8 h后,细胞数量减少,形态出现较大改变,细胞皱缩呈现圆形,且堆积成团,显微镜下观察发现大量细胞漂浮,说明该条件下H2O2处理对H9c2细胞具有明显氧化损伤作用,细胞膜结构被破坏,细胞形态发生较大改变。由图8c可见,蝇蛆耐高温抗氧化蛋白保护24 h后,H2O2处理对H9c2细胞的损伤程度明显降低,部分细胞因损伤而皱缩呈圆形,但大部分细胞呈长梭形,贴壁情况较好,表明蝇蛆耐高温抗氧化蛋白在一定程度上能保护H9c2细胞,降低H2O2对其造成的氧化损伤。由图8d可见,4 mg/mL蝇蛆耐高温抗氧化蛋白保护24 h后,细胞分布均匀,形态正常,呈长梭形,贴壁紧密,未见明显损伤。0.5~2 mg/mL蝇蛆耐高温抗氧化蛋白处理后H9c2细胞形态与4 mg/mL蛋白处理结果相似,表明在一定质量浓度范围内,蝇蛆耐高温抗氧化蛋白对H9c2细胞无明显毒害作用。H9c2细胞形态变化与细胞存活率结果基本吻合。
2.8 蝇蛆耐高温抗氧化蛋白对H2O2诱导损伤的H9c2细胞胞外LDH及胞内氧化还原酶系的影响
乳酸脱氢酶(LDH)是一种胞内酶,细胞损伤或凋亡会导致细胞膜破裂,胞内LDH释放到培养液中,检测给药前后培养液中LDH含量,可评估蝇蛆耐高温抗氧化蛋白对H9c2细胞膜的保护作用,LDH释放可作为细胞膜完整性的重要指标。超氧化物歧化酶(SOD)可清除细胞内产生的超氧化物阴离子,其活力高低可反映细胞抵抗氧化损伤的能力;过氧化氢酶(CAT)是体内清除过氧化氢,降低其导致的机体氧化损伤的重要抗氧化酶;而谷胱甘肽过氧化物酶可通过还原型谷胱甘肽(GSH)清除机体中的过氧化氢及脂类过氧化物,有效阻止活性氧自由基对机体的氧化损伤。蝇蛆耐高温抗氧化蛋白对H2O2诱导的H9c2细胞的LDH释放及胞内氧化还原酶系的影响见表1。由表1可见,H2O2损伤模型组细胞中LDH含量显著提高(P<0.05),而SOD活力、CAT活力及GSH含量显著下降(P<0.05),表明600 μmol/L H2O2处理8 h可导致H9c2细胞发生氧化损伤,大量LDH释放到培养液中,胞内氧化还原酶系受到破坏;而蝇蛆耐高温抗氧化蛋白预处理后,与H2O2损伤模型组相比,细胞培养液中的LDH含量显著降低(P<0.05),细胞中的SOD活力、CAT活力及GSH含量显著提高(P<0.05),表明蝇蛆耐高温抗氧化蛋白对H9c2细胞有一定保护作用,可有效降低H2O2对细胞膜系统及细胞内氧化还原酶系造成的氧化损伤,可减少细胞膜破裂,降低LDH释放。此外,该样品在一定范围内存在剂量依赖性,4 mg/mL 给药处理后LDH释放量出现较明显降低(降低24%),SOD活力、CAT活力及GSH含量均高于0.5~2 mg/mL 的给药处理。此结果与赵春江等[25]的结果相似,证明蝇蛆耐高温抗氧化蛋白具有较好的抗氧化活性。
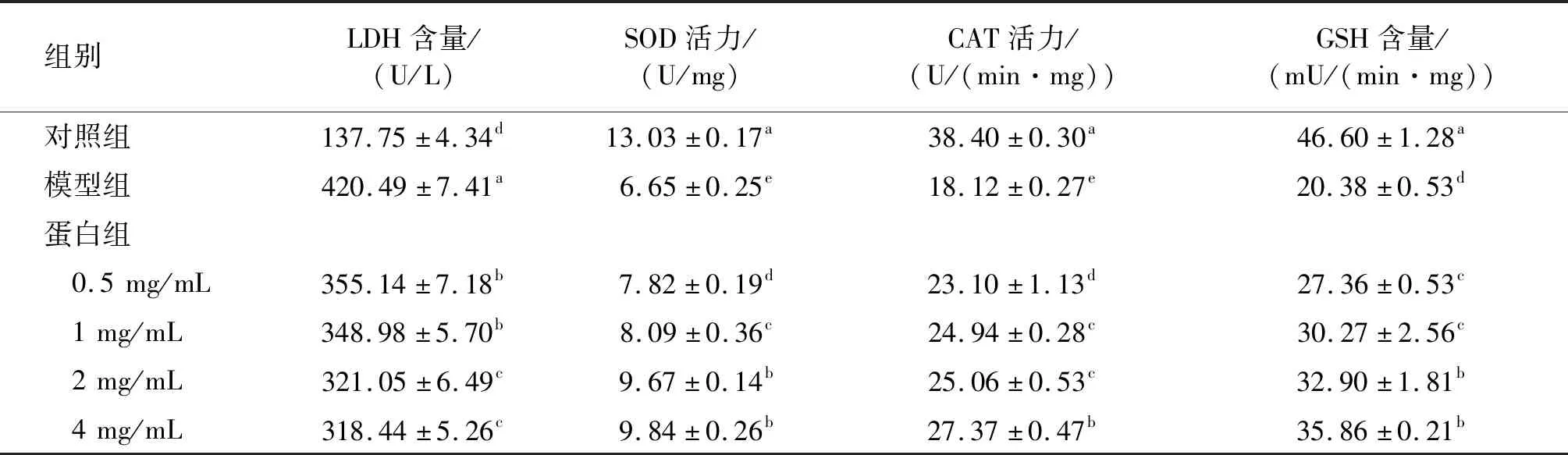
表1 蝇蛆耐高温抗氧化蛋白对H9c2细胞的LDH释放及胞内氧化还原酶系的影响
注:同列不同字母代表差异显著(P<0.05)。
3 结 论
通过加热法从蝇蛆中获得了热稳定性蛋白,在100℃处理20 min的条件下,对体外抗氧化能力综合评价发现所得蝇蛆耐高温抗氧化蛋白具有良好的超氧阴离子自由基、羟自由基清除能力和还原力。对细胞存活率、LDH释放及SOD活力、CAT活力、GSH含量等与细胞抗氧化酶系相关指标的检测证明,获得的蝇蛆耐高温抗氧化蛋白对H2O2诱导损伤的H9c2细胞有保护作用,且在一定范围内存在剂量依赖性。提示蝇蛆耐高温抗氧化蛋白可提高细胞抗氧化系统相关酶活力,降低活性氧自由基对细胞造成的氧化损伤。
