环境丝状真菌对3种重金属的耐受性能比较与解析*
2020-02-25毛航球李文英高绣纺
毛航球 李文英 高绣纺 李 夏 宋 磊
(1.广东省农业科学院农业资源与环境研究所,广东 广州 510640;2.长江大学资源与环境学院,湖北 武汉 430000;3.湿地生态与农业利用教育部工程研究中心,湖北 荆州 434025)
随着工农业的发展和化石燃料的燃烧,重金属在水体、土壤环境中大量富集,使得环境中重金属污染问题日益严重[1]。重金属污染具有隐蔽性、持续性、不可逆转性[2],如何绿色环保地治理重金属污染问题是各国科研组织和机构研究的热门话题[3]。微生物修复重金属污染是近几十年来兴起的环保型、高性价比的修复技术,微生物可以改变重金属在环境中的化学行为,通过对环境中重金属进行转化、迁移或固定从而达到修复的目的,具有成本低、效率高等特点,应用前景十分广阔[4-5]。
Pb、Cd、Cr是环境中常见的重金属,可通过食物链在生物体内富集,即使少量的污染也会对人体健康产生威胁[6]。国内外研究表明一些真菌对特定的重金属具有耐受性的同时也对重金属具较强的生物吸附、转化等作用。XIE等[7]分离出一株真菌Aspergillusaculeatus对Cd2+有较好的耐受性。ZAFAR等[8]从土壤中分离出的Trichodermasp.和Aspergillussp.对Cd2+和Cr(Ⅵ)有较好的耐受性,特别是后者对Cd2+和Cr(Ⅵ)的吸附量分别达到2.7、1.2 mg/g。宋瑛瑛等[9]测定了Pb2+耐受菌株LadosporiumcladosporioidesB142对Pb2+的吸附能力,结果表明在吸附时间为15、60 min时,其对Pb2+的吸附量分别为14.73、19.54 mg/g。
本研究利用前期从污染环境中分离的11株丝状真菌,比较了3 种重金属(Cr(Ⅵ)、Pb2+和Cd2+)对菌丝生长扩展的影响作用及耐受性,观察测定重金属对菌株培养性状和菌落直径的影响程度,为后续利用高效菌株解决重金属污染问题提供理论依据和实际参考。
1 材料与方法
1.1 实验材料
1.1.1 实验仪器
LRH-150型生化培养箱,DE-CJ-1N型超净工作台,CL-32L型高压蒸汽灭菌锅,游标卡尺,打孔器等。
1.1.2 菌株信息及来源
11株供试真菌为前期从污染环境中分离获得的纯培养菌株,分别为:大单孢属(Aplosporellasp.)(菌株号Ap1229)、葡萄座腔菌属(Botryosphaeriasp.)(菌株号Bo1075)、色二孢属(Diplodiasp.)(菌株号Di0237)、毛色二孢属(Lasiodiplodiasp.)(菌株号La1636)、毛霉属(Mucorsp.)(菌株号Mu-tea1)、新壳梭孢(Neofusicoccumsp.)(菌株号Nf1172)、新暗色柱节孢(Neoscytalidiumsp.)(菌株号Ns1680)、青霉属(Penicilliumsp.)(菌株号Pe-soil2)、暗葡腔菌属(Phaeobotryonsp.)(菌株号Ph1212)、假壳梭孢属(Pseudofusicoccumsp.)(菌株号Ps0108)、斯潘氏菌属(Spencermartinsiasp.)(菌株号Sp1370)。
1.1.3 供试材料及试剂
供试菌株均采用马铃薯琼脂(PDA)培养基进行培养。实验所用试剂Pb(NO3)2、CdCl2、K2Cr2O7为分析纯。
1.2 实验方法
分别用Pb(NO3)2、CdCl2和K2Cr2O7配制3种重金属的高浓度母液(Cr(Ⅵ) 1 000 mg/L,Cd2+100 mmol/L,Pb2+100 mmol/L),并用微孔滤膜过滤除菌。
对PDA培养基进行高压蒸气灭菌(121 ℃,20 min),待其冷却到50 ℃左右,加入适量的重金属母液,配置不同浓度梯度的重金属培养基(Cr(Ⅵ)为 0、20、40、60、100、160、220 mg/L;Cd2+、Pb2+均为0、3、5、8、12、16、18 mmol/L),调节pH≤5,防止金属离子沉淀。在无菌操作台中用打孔器在空白处理(未添加重金属)菌落边缘取生长状况良好的菌饼(直径5 mm),倒置放于重金属培养基的正中央,于26 ℃生化培养箱中培养。每个浓度设置3个重复,培养观察14 d,测定菌株最小抑制浓度(MIC),也即重金属抑制微生物细胞生长的最低浓度[10]。采用十字交叉法测量菌落直径并记录菌落形态(质地、形状、颜色等)[11]。
1.3 数据处理与统计分析
采用Excel和Origin软件进行实验数据处理,SPSS软件进行多重性比较分析。
2 结果与讨论
2.1 11株丝状真菌对3种不同重金属的耐受性测定
表1为11株供试菌株在不同浓度Cr(Ⅵ)培养基下的生长情况及MIC。由表1可见,当Cr(Ⅵ)低于20 mg/L时,所有菌株都能生长,逐渐提高重金属浓度,菌株明显被抑制,当Cr(Ⅵ)提高到100 mg/L时,菌株Mu-tea1和菌株Pe-soil2可以生长,当Cr(Ⅵ)提高到220 mg/L时,只有菌株Mu-tea1能够生长。由表1可见,菌株Mu-tea1、Pe-soil2、Nf1172对Cr(Ⅵ)的耐受性能相对更强。
表2为11株供试菌株在不同浓度Cd2+培养基下的生长情况及MIC。从表2可以看出,当Cd2+低于3 mmol/L时,所有供试菌株都能生长,随着提高培养基中Cd2+浓度提高,菌株生长状况均变弱,Cd2+为8 mmol/L时大多菌株表现为被抑制,菌落不能明显延伸,当Cd2+提高到18 mmol/L时,只有菌株Nf1172和菌株Pe-soil2能生长。相比而言,对Cd2+有较强耐受的优势菌株有Nf1172、Pe-soil2、La1636。
表3为11株供试菌株在不同浓度Pd2+培养基下的生长情况及MIC。从表3可以看出,当Pb2+低于3 mmol/L时,所有供试菌株都能生长,逐渐提高Pb2+浓度,菌株均明显被抑制,当Pd2+提高到8 mmol/L时,只有菌株Nf1172和菌株Pe-soil2能够生长,继续提高Pb2+到18 mmol/L时,只有Pe-soil2可以生长。对Pb2+有较强耐受的优势菌株为La1636、Nf1172和Pe-soil2。
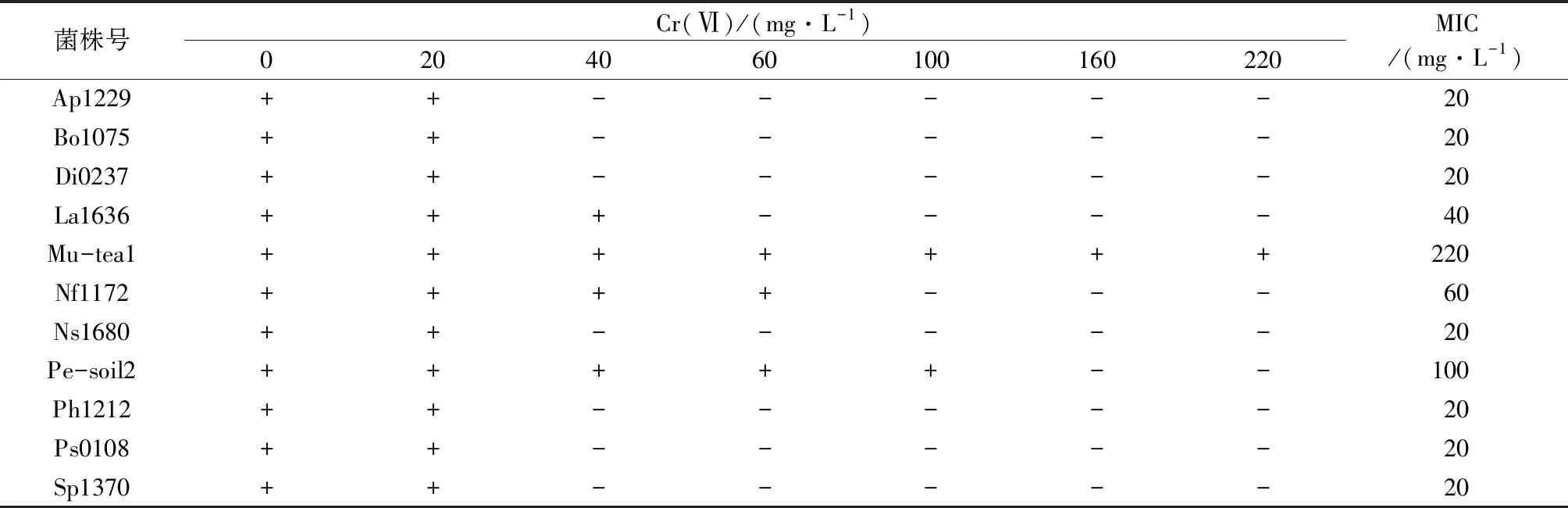
表1 供试菌株对Cr(Ⅵ)的耐受性1)
注:1)“+”表示能够生长,“-”表示抑制生长,表2、表3同。
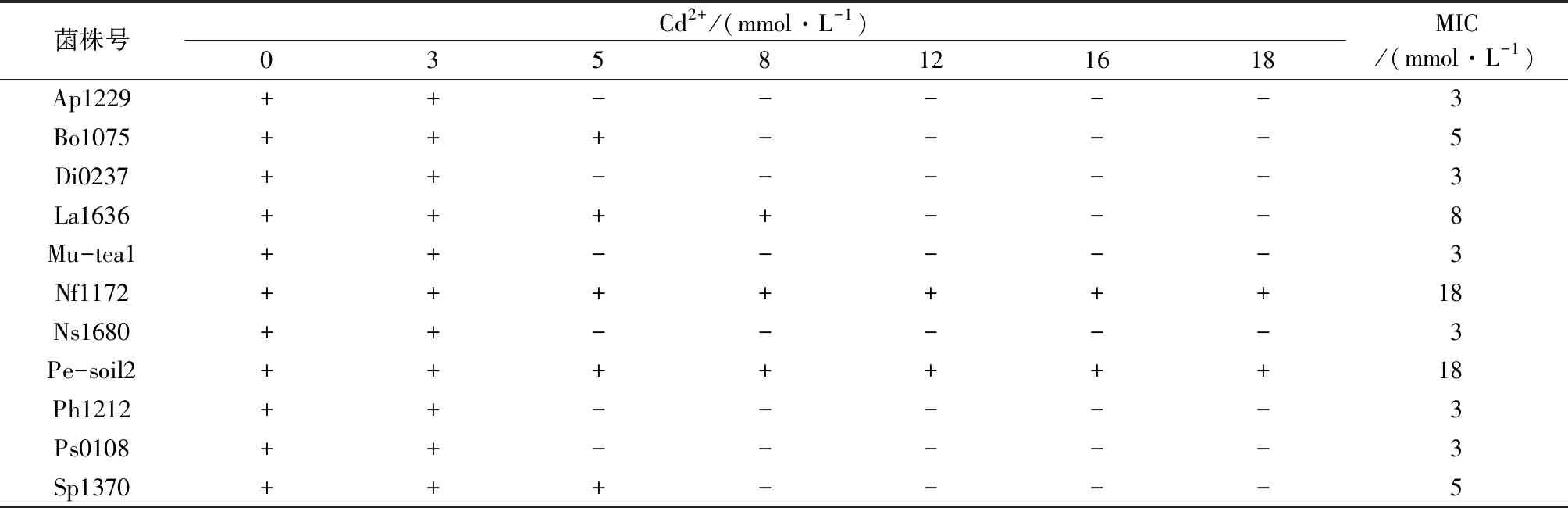
表2 供试菌株对Cd2+的耐受性
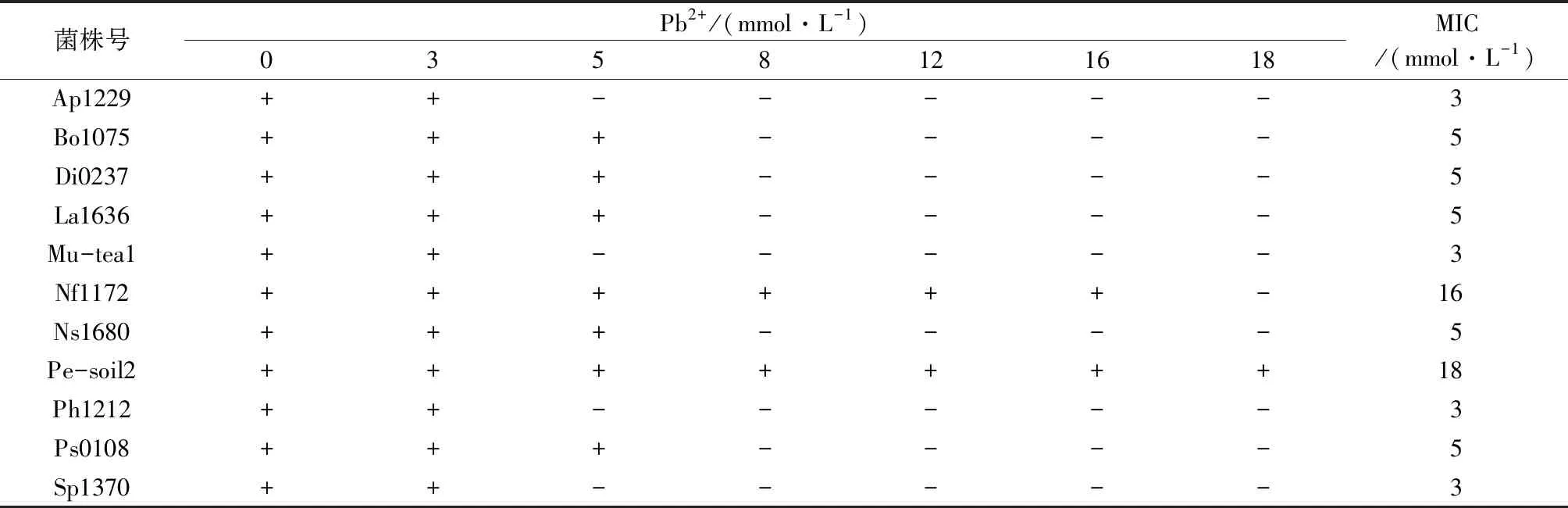
表3 供试菌株对Pb2+的耐受性
MIC可以反映菌株对重金属离子的耐受性程度。从上述结果可以看出,供试菌株对不同种类重金属的耐受性有较大的差异,这可能与重金属进入菌丝体内形成不同化合物有关[12]。同一菌株对不同重金属浓度耐受性也有较大差异,在低浓度条件下,重金属对菌丝体毒害作用较弱,提高重金属浓度,其对菌株的抑制毒害作用显著增强。MUNOZ等[13]从矿区污水中分离出一株Trichosporonsp.对Pb2+的MIC为12~14 mmol/L,本研究中菌株Nf1172、Pe-soil2对Pb2+的MIC为18 mmol/L,说明Nf1172、Pe-soil2对Pb2+有更好的耐受性。OLADIPO等[14]从矿山分离的Bacilluskochii对Cr(Ⅵ)的MIC为150 mg/L,本研究中菌株Mu-tea1对Cr(Ⅵ)的MIC为220 mg/L,耐受性能明显增强,这可能是由于丝状真菌生长快、生物量大、有细胞壁等原因,所以对重金属的抗性能力要优于细菌。
2.2 3种重金属对强耐受性菌种菌丝生长的抑制作用
真菌在重金属胁迫培养下的生长状况可直接反映重金属对其产生的危害程度。从供试菌株中分别选出对Cr(Ⅵ)、Pb2+和Cd2+耐受性最强的3株菌株,在不同胁迫浓度下培养14 d,观察菌落直径的变化。根据表1筛选结果,选择菌株Nf1172、Mu-tea1和Pe-soil2进行Cr(Ⅵ)胁迫的菌落直径对比,结果见图1。
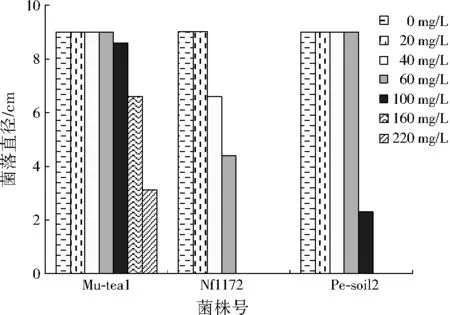
图1 3株供试菌株在不同Cr(Ⅵ)质量浓度下的菌落直径Fig.1 The colony diameters of 3 tested fungi strains under different Cr(Ⅵ) concentrations
由图1可见,3株供试菌株对不同浓度Cr(Ⅵ)的耐受性具有一定的差异性。当Cr(Ⅵ)≤20 mg/L时,其对3株供试菌株抑制效果不明显,菌落直径都为9.0 cm。当培养基Cr(Ⅵ)提高至60 mg/L时,菌株Nf1172的菌落直径为4.3 cm,与Cr(Ⅵ)为0 mg/L的空白处理组相比有显著性差异(p<0.05),菌株Mu-tea1和Pe-soil2在Cr(Ⅵ)为60 mg/L下均能正常生长。继续提高Cr(Ⅵ)至220 mg/L时,只有菌株Mu-tea1能够扩展,菌落直径为3.1 cm,与其他菌株相比有显著性差异(p<0.05)。3株供试菌株对Cr(Ⅵ)的耐受性大小为Mu-tea1> Pe-soil2> Nf1172。不同菌株对Cr(Ⅵ)耐受性差异明显,可能是菌株体内的官能团通过减少对Cr(Ⅵ)的吸收或增加体内Cr(Ⅵ)的排出量存在差异,从而对Cr(Ⅵ)的抵抗力不同[15]。
根据表2筛选结果,选择菌株La1636、Nf1172和Pe-soil2在不同浓度Cd2+胁迫下培养14 d进行菌落直径观察,结果见图2。从图2可以看出,随着Cd2+浓度的增加,3株供试菌株菌落的直径均逐渐减小。当Cd2+≤3 mmol/L时,3株供试菌株的菌落直径均为9.0 cm。提高Cd2+摩尔浓度至8 mmol/L,菌株La1636的菌落直径为3.3 cm,与Cd2+摩尔浓度为0 mmol/L的空白对照组相比有显著差异(p<0.05),而该浓度水平下菌株Nf1172和Pe-soil2的菌落直径均为9.0 cm。提高Cd2+摩尔浓度至18 mmol/L时,只有菌株Nf1172和Pe-soil2能生长,菌落直径分别为2.3、2.7 cm,与其他菌株相比差异显著(p<0.05)。3株供试菌株对Cd2+耐受性大小为Pe-soil2>Nf1172>La1636。菌株Pe-soil2对Cd2+显现出更好的耐受性可能是因为细胞膜表面的官能团对Cd2+有排斥作用,从而增大其对Cd2+的耐受性[16]。
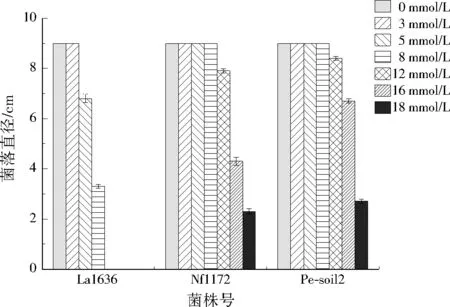
图2 3株供试菌株在不同Cd2+摩尔浓度下的菌落直径Fig.2 The colony diameters of 3 tested fungi strains under different Cd2+ concentrations
根据表3筛选结果,选择菌株La1636、Nf1172和Pe-soil2在不同浓度Pb2+胁迫下培养14 d进行菌落直径观察,结果见图3。从图3可以看出,在14 d观察时间内,当Pb2+≤3 mmol/L时,3株供试菌株的菌落直径均为9.0 cm。当Pb2+摩尔浓度提高到8 mmol/L时,菌株La1636完全被Pb2+毒性所抑制,菌株Nf1172的菌落直径为6.7 cm,与Pb2+为0 mmol/L的空白对照组相比有显著性差异(p<0.05),而菌株Pe-soil2的菌落直径仍为9.0 cm。提高Pb2+摩尔浓度至18 mmol/L时,只有菌株Pe-soil2能够生长,菌落直径为4.3 cm,与其他菌株相比差异性显著(p<0.05)。可以看出,3株供试菌株对Pb2+耐受性大小为Pe-soil2>Nf1172>La1636。不同菌株对Pb2+耐受性的差异可能与菌株体内无机酸根离子含量多少有关,Pe-soil2中无机酸根离子含量较高,可与Pb2+离子形成络合沉淀从而减低体内Pb2+含量。
上述实验结果表明,菌株Mu-tea1对Cr(Ⅵ)表现出更强的耐受性,而菌株Nf1172和Pe-soil2对Pb2+、Cd2+比其他供试菌株表现出更强的耐受性。不同浓度的重金属对同一菌株菌丝生长具不同程度的抑制作用,且抑制作用随重金属浓度的升高而增强,菌落扩展速率也随着重金属浓度的升高而减小。不同菌株对重金属耐受性差异明显,可能与菌株细胞内部官能团结构和重金属影响菌株次生代谢有关。杨超等[17]分离出一株Phaeoacremoniummortoniae对Pb2+胁迫条件下的半致死质量浓度为951 mg/L,本研究中Pe-soil2在18 mmol/L Pb2+条件下能够生长,菌落直径为4.3 cm,这是由于丝状真菌体内的抗氧化酶系统能有效降低活性氧的伤害,分泌多种有机酸,可络合、沉淀重金属离子,从而降低重金属的毒害。徐在超等[18]从矿区分离3株具重金属抗性的内生真菌Fusariumsp.(菌株号CBRF14)、Penicilliumsp.(菌株号CBRF65)和Alternariasp.(菌株号CBSF68),对Cd2+的MIC分别达到了20.54、53.43、27.25 mg/L,对Pb2+的MIC分别为299.8、356.6、188.9 mg/L,对Pb2+和Cd2+也表现出较好的耐受性,可能是丝状真菌通过表面吸附作用,菌丝分泌出多糖物质产生结合作用使重金属的毒性降低[19]。
3 总 结
(1) 将11株丝状真菌在含有不同浓度Cr(Ⅵ)、Cd2+、Pb2+的培养基中培养,在高浓度重金属胁迫条件下菌丝扩展均受到明显抑制,菌落的形态也有着明显的变化,证实了Cr(Ⅵ)、Cd2+、Pb2+对真菌的生长具有不同程度的抑制作用。
(2) 不同菌株对不同重金属耐受能力不同,菌株Mu-tea1对Cr(Ⅵ)耐受能力最强,Nf1172和Pe-soil2对Cd2+、Pb2+耐受能力较强,与其他供试菌株相比具有明显的优势。
(3) 本研究供试菌株均从华南特色环境中分离出来,在利用优势菌株修复华南区域性重金属污染等方面,具备得天独厚的优势,可为下一步研发环境污染控制及微生物修复技术提供科学依据和材料基础。
